Indool: eigenschappen, reacties, productie en toepassingen

Wat is indool?
Indool, ook bekend als 1-benzo[b]pyrrool, is een aromatische heterocyclische organische verbinding met een bicyclische structuur (een benzeen gefuseerd aan een pyrrool) met de chemische formule C8H7N. Het is een kleurloze vaste stof met een zeer aanhoudende muffe geur.
Indool werd voor het eerst ontdekt door A. V. Baeyer en C. A. Knop in 1866 als resultaat van onderzoek naar de reductie van isatine, dat is afgeleid van de natuurlijke kleurstof indigo. Indool werd gesynthetiseerd door oxindool te verhitten met zinkstof. In 1910 isoleerde R. Weissgerber indool uit steenkoolteer.
Indool is gevonden in Robinia pseudacacia, de jasmijn en bepaalde citrusplanten; in het parfum van Hevea bruziLiensis, in sinaasappelbloesems; en in het hout van Celtis reticulosa. Het vormt 2,5% van jasmijnolie en 0,1% van sinaasappelbloesemolie. Wanneer het in hogere concentraties in geuren wordt gebruikt, verspreidt het een intense fecale geur.
Indool is planair met 10 π-elektronen in een volledig geconjugeerd systeem. De ring wordt geclassificeerd als een π-overmatige heteroaromatische verbinding vanwege het elektronendonerende karakter van het pyrrool-type stikstofatoom. Het π-systeem is relatief elektronenrijk, met name bij koolstof C-3.
Inhoudsopgave
1. Fysieke eigenschappen van indool
Indool is een kleurloze, kristallijne vaste stof die gemakkelijk oplosbaar is in ethanol, benzeen, ether en de meeste organische oplosmiddelen, maar matig oplosbaar in water. Het is vluchtig met stoom.
Indool is een neutrale verbinding (niet-basische stikstofverbinding), maar kan worden geprotoneerd of gedeprotoneerd door respectievelijk een zeer sterk zuur of een zeer sterke base. De pKa van het geconjugeerde zuur is ongeveer -2,4; die van de neutrale verbinding is ongeveer 16,7.
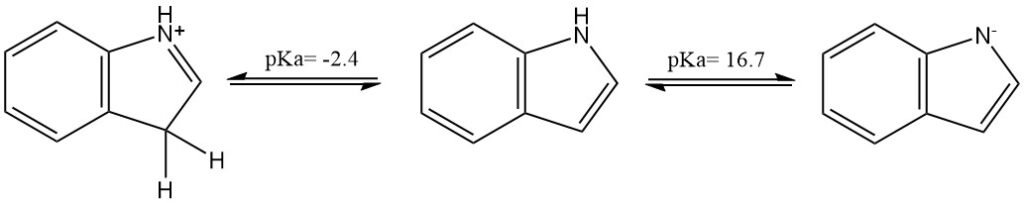
De fysische eigenschappen van indool worden samengevat in de volgende tabel:
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [120-72-9] |
| Chemische formule | C8H7N |
| Moleculair gewicht | 117,15 g/mol |
| Smeltpunt | 52–54◦C |
| Kookpunt | 254 °C |
| Dichtheid | 1,22 g/cm3 |
| pKa | 16,7 |
| Verbrandingswarmte | 3,650 kJ/kg (bij 25 °C) |
| Enthalpie van verdamping (10,3–27,4 °C) | 597,5 kJ/kg |
| Dipoolmoment | 2,11 D (benzeen) |
2. Chemische reacties van indool
Indool als heterocyclische verbinding vertoont een reactiviteit die kenmerkend is voor zowel pyrrool als benzeen. Het waterstofatoom dat aan de stikstof is gebonden, kan worden vervangen door alkalimetalen. Oxidatie van indool levert indigo op, terwijl milde hydrogenering 2,3-dihydroindool (indoline) oplevert. Reacties met zuren resulteren in de vorming van diindool, triindool en polymeerproducten.
2.1. Elektrofiele aromatische substitutie van indool
Indool kan elektrofiele aromatische substitutie ondergaan vanwege de elektronenrijke aard van de pyrroolgroep. De koolstof op positie 3 is het meest reactief vanwege zowel de elektronendichtheidsverdeling als de stabiliteit van tussenliggende structuren.
Computationele studies met behulp van moleculaire orbitaalmethoden hebben onthuld dat de elektronendichtheid op positie 3 hoger is dan op positie 2. Bovendien suggereren de relatieve energieën van de tussenliggende structuren die worden gevormd tijdens elektrofiele substitutie dat de 3-positie gunstiger is voor aanval.
Deze voorkeur is waarschijnlijk te danken aan het behoud van het benzenoïde karakter van de carbocyclische ring in het tussenliggende materiaal dat wordt gevormd op de 3-positie.
In het geval van 3-gesubstitueerde indolen kan er nog steeds een elektrofiele aanval plaatsvinden op de 3-positie, zelfs als deze al is gesubstitueerd. Dit kan leiden tot een complex patroon van substitutie, aangezien de nieuwe of de oorspronkelijke substituent naar de 2-positie kan migreren.
Veel voorkomende elektrofiele aromatische substitutiereacties kunnen worden uitgevoerd op indool. Er ontstaan echter vaak complicaties door de buitensporige reactiviteit van indool of de relatieve instabiliteit van de substitutieproducten. Een voorbeeld hiervan is halogenering.
2.1.1. Halogenering
Halogenering van indool kan worden bereikt met behulp van verschillende reagentia, zoals hypochlorietion, sulfurylchloride, pyridiniumtribromide en jodium. Het primaire product van halogenering is doorgaans het 3-haloindool derivaat.
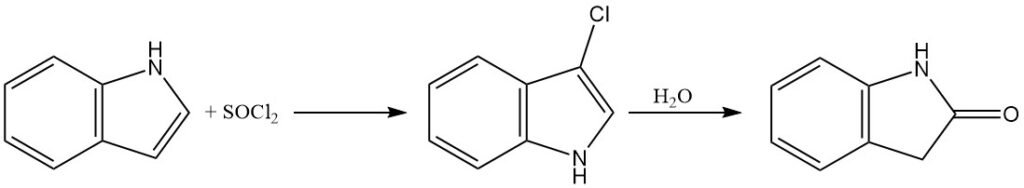
Indool kan worden gechloreerd met behulp van hypochlorietion of sulfurylchloride om 3-chloroindool te verkrijgen. Echter, 3-chloroindool is relatief onstabiel in zure waterige oplossingen en kan hydrolyse ondergaan tot oxindole.
3-Broomindool kan worden bereid met behulp van pyridiniumtribromide als bron van elektrofiel broom. Indool reageert met jodium om 3-joodindool te geven.
Zowel 3-broomindool als 3-joodindool zijn gevoelig voor hydrolyse in zure omstandigheden, maar zijn relatief stabiel in basische omgevingen.
2.1.2. Nitratie
Nitratie van indool kan een complexe reactie zijn vanwege de vorming van stikstofoxiden, die kunnen deelnemen aan oxidatieve transformaties. In sterk zure media vindt nitratie van 2-gesubstitueerde indolen voornamelijk plaats op de 5-positie.
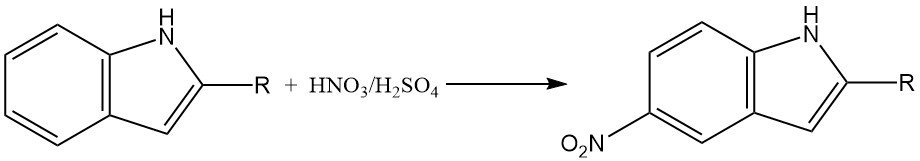
Dit komt waarschijnlijk door de vorming van een geconjugeerd zuur intermediair, dat een gereduceerd aromatisch karakter heeft en gevoeliger is voor nitrering op de 5-positie.
2.1.3. C-alkylering
C-alkylering van indool kan worden bereikt door indool te laten reageren met alkylerende middelen onder geschikte omstandigheden. De regioselectiviteit van C-alkylering kan worden beïnvloed door de reactieomstandigheden en de aard van het alkylerende middel.
Omstandigheden die de vorming van het elektrofiele aromatische substitutie-intermediair bevorderen, zoals het gebruik van sterke basen of nauwe metaalcoördinatie bij stikstof of zeer reactieve alkylerende middelen zoals allylische en benzylische verbindingen, bevorderen C-3-alkylering.
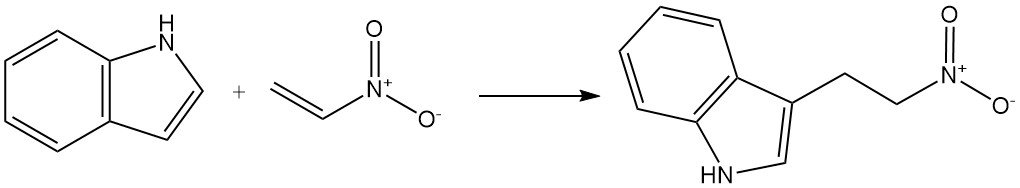
Onverzadigde reagentia geactiveerd door elektronenzuigende groepen kunnen ook reageren met indool om C-3-alkylering te ondergaan. Een voorbeeld is de reactie van indool met nitro-ethyleen om 3-(2-nitro-ethyl)indool te vormen.
Gramine, een intermediair gevormd door de reactie van indool met N,N-dimethylformaldiminiumion, kan worden gebruikt om een verscheidenheid aan substituenten op de 3-positie te introduceren. De dimethylaminogroep in gramine kan worden verdrongen door nucleofielen, of gramine kan worden omgezet in zijn quaternaire zout vóór substitutie.
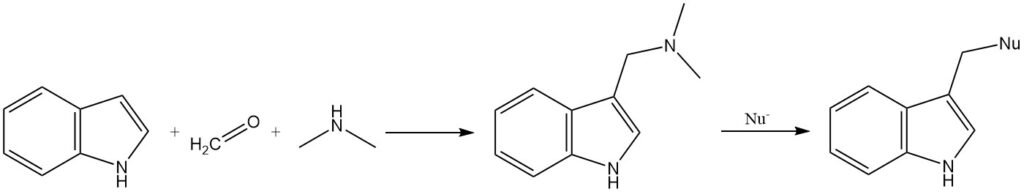
2.1.4. Acylering
Acylering is een andere belangrijke methode voor het introduceren van substituenten op de indoolring, met name op de 3-positie. Acylering kan worden bereikt met behulp van verschillende reagentia, zoals acylhalogeniden en Vilsmeier-Haack-reagentia.
Zeer reactieve acylhalogeniden, zoals oxalylchloride, kunnen indool direct acyleren zonder dat er een katalysator nodig is. Normale zuurchloriden kunnen worden omgezet met de magnesium- of zinkzouten van indool om acyleringsproducten te produceren.
De Vilsmeier-Haack-reactie, waarbij een amide en fosforoxychloride betrokken zijn, is een veelgebruikte methode voor acylering van indool.
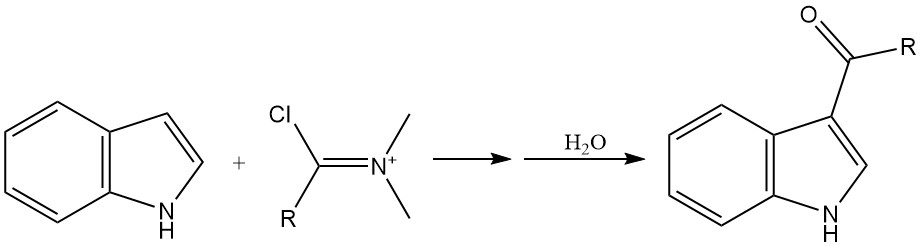
2.2. N-alkylering van indool
Om N-alkylering te vergemakkelijken, moet de indoolring worden gedeprotoneerd om het indoolanion te genereren, wat een sterkere nucleofiel is dan het neutrale indoolmolecuul.
Deze deprotonering kan worden bereikt met behulp van verschillende sterke basen, zoals natriumamide in vloeibare ammoniak, natriumhydride of kaliumhydride in aprotische oplosmiddelen (N,N-dimethylformamide en dimethylsulfoxide), of faseoverdrachtkatalyse.
Het gegenereerde indoolanion wordt gealkyleerd door reactie met een alkylhalide of ander alkyleringsmiddel. De keuze van het alkyleringsmiddel en de reactieomstandigheden kunnen de regioselectiviteit van N-alkylering beïnvloeden.
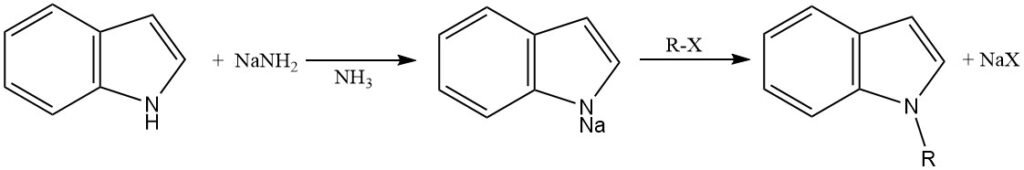
Primaire, secundaire en tertiaire alkylhalogeniden kunnen worden gebruikt voor N-alkylering van indool. Primaire alkylhalogeniden zijn echter over het algemeen reactiever dan secundaire of tertiaire alkylhalogeniden. Andere alkyleringsmiddelen, zoals dialkylsulfaten, alkyltosylaten en alkyltriflaten, kunnen ook worden gebruikt.
2.3. Arylering van indool
Arylering van indool is de introductie van een arylgroep op de indoolring. Deze reactie wordt doorgaans bereikt via gesubstitueerde tussenproducten in plaats van rechtstreeks op indool. Palladiumgekatalyseerde kruiskoppelingsreacties zijn de voorkeursmethode geworden voor arylering van indolen en andere heteroaromatische ringen.
Palladiumgekatalyseerde kruiskoppelingsreacties omvatten de koppeling van een arylhalogenide of aryltriflaat met indool in aanwezigheid van een palladiumkatalysator. De arylnucleofiel kan een indool-tin, indool-zink of indool-boronzuur zijn.
Palladium-gekatalyseerde kruiskoppelingsreacties zijn zeer selectief, kunnen worden gebruikt om een verscheidenheid aan arylgroepen op de indoolring te introduceren en worden uitgevoerd onder milde omstandigheden.
2.4. Lithiatie en daaropvolgende transformaties
Lithiatie van indool is de introductie van een lithiumatoom op de positie 2 indoolring. Drie tussenproducten zijn veelvuldig gebruikt, zoals 1-fenylsulfonylindool (1), 1-t-butoxycarbonylindool (2) of lithiumindool-1-carboxylaat (3), en hebben een goede opbrengst behaald.
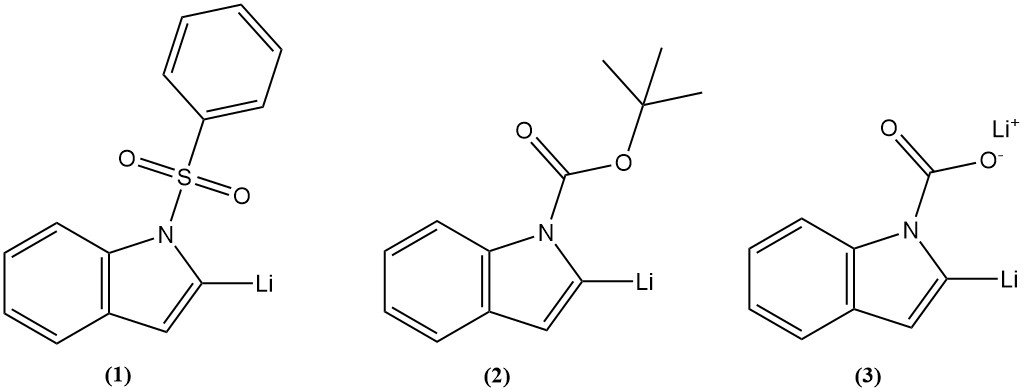
Lithiatie van indool op de 2-positie kan worden gevolgd door een reactie met verschillende elektrofielen om een grote verscheidenheid aan substituenten te introduceren. Lithiatie op andere posities op de indoolring kan worden bereikt door halogeen-metaaluitwisseling.
2.5. Oxidatie van indool
Indool is gevoelig voor oxidatie vanwege zijn elektronenrijke aard. Oxidatie van indool kan leiden tot de vorming van verschillende tussenproducten en producten, afhankelijk van het gebruikte oxidatiemiddel.
Oxidatie van indool met zuurstof leidt vaak tot de vorming van 3-hydroperoxy-3H-indool-tussenproducten. Deze tussenproducten kunnen verdere transformaties ondergaan, zoals ontleding of herschikking, om verschillende oxidatieproducten te vormen.
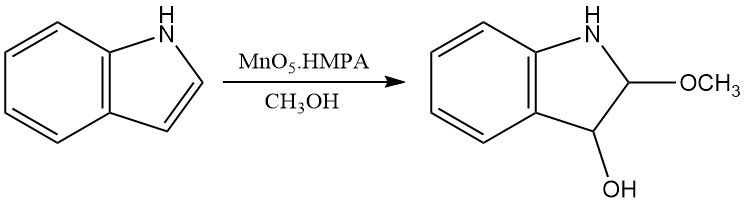
Peroxycarbonzuren kunnen indool ook oxideren om soortgelijke producten te verkrijgen als die verkregen met zuurstof. Andere chemische oxidatiemiddelen, zoals dimethylsulfoxide in waterig zuur of MoO5·HMPA, produceren respectievelijk oxindolen en 3-hydroxy-2-methoxyindolines.
3. Productie van indool
Indool wordt voornamelijk verkregen uit twee bronnen: steenkoolteer en chemische synthese. Hoewel synthetische methoden zijn beschreven voor de productie van indool, is extractie uit de steenkoolteerdestillaatfractie de enige commerciële bron.
Hogetemperatuursteenkoolteer bevat ongeveer 0,2% indool. Tijdens de destillatie van steenkoolteer wordt indool geconcentreerd in een bifenyl-indoolfractie die kookt binnen een nauw temperatuurbereik van 245 tot 255 °C.
Na het verwijderen van fenolen en basen wordt indool gescheiden van bifenyl door:
- Reactie met kaliumhydroxide om het kaliumzout te vormen, dat kan worden gescheiden van bifenyl.
- Azeotrope destillatie met di-ethyleenglycol.
- Extractie uit het bifenyl-indoolmengsel met behulp van selectieve oplosmiddelen zoals glycolen, waterige dimethylsulfoxide of monoethanolamine.
De ruwe indool die uit deze processen wordt verkregen, kan verder worden gezuiverd door kristallisatie uit alifatische koolwaterstofoplosmiddelen.
Er zijn verschillende chemische methoden ontwikkeld voor de synthese van indool op technische schaal, waaronder:
- Madelung-synthese omvat de formylering van o-toluidine met behulp van mierenzuur, gevolgd door cyclisatie om indool te vormen.
- Dehydrogenering en cyclisatie van 2-ethylaniline om indool te vormen.
- Cyclocondensatie van aniline en ethyleenglycol in de vloeibare of gasfase om indool te produceren.
- Cyclisatie van 2-(2-nitrofenyl)ethanol.
3.1. Productie van indool door Madelung-synthese
De Madelung-synthese is een klassieke methode voor de bereiding van indolen. Deze reactie is een intramoleculaire condensatie van een o-alkylanilide. O-toluïdine reageert met mierenzuur om N-formyl-o-toluïdine te produceren, dat met natriumamide wordt behandeld om indool te vormen.
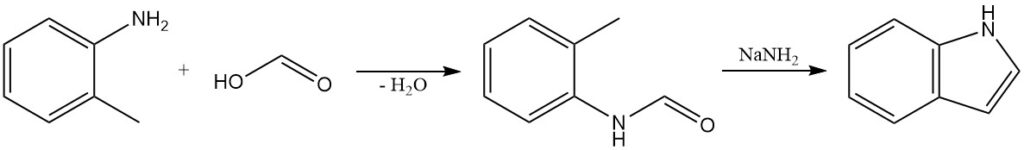
De Madelung-synthese is gebruikt om een verscheidenheid aan gesubstitueerde indolen te bereiden, waaronder die met functionele groepen zoals halogenen, alkylgroepen en arylgroepen.
De oorspronkelijke Madelung-synthese gebruikte hoge temperaturen en sterke basen zoals natriumamide. O-methylacetanilide kan bijvoorbeeld worden omgezet in 2-methylindool door het te verhitten met natriumamide bij verhoogde temperaturen.
In de afgelopen jaren hebben onderzoekers mildere omstandigheden ontwikkeld voor de Madelung-synthese, wat voordelig kan zijn voor gevoelige substraten of wanneer het vermijden van nevenreacties belangrijk is.
Eén methode omvat het gebruik van sterke, niet-nucleofiele basen zoals n-butyllithium of lithiumdiisopropylamide om een dilithioderivaat van het anilide te vormen, dat vervolgens cyclisatie kan ondergaan onder mildere omstandigheden.
3.2. Andere synthesemethoden
Indool kan via verschillende routes worden gesynthetiseerd, waaronder de reactie van aniline met ethyleenbromide, het verhitten van o-amino-ω-chloorstyreen met natriumethoxide en het verhitten van de dianilide van wijnsteenzuur met zinkchloride.
Indool-2-carbonzuur, dat indool oplevert door decaraboxylatie, kan worden gevormd door het verhitten van o-formylfenylglycine met azijnzuuranhydride en natriumacetaat.
Andere methoden voor indoolsynthese omvatten de destillatie van oxaal-o-tolueenzuur met zinkstof of het bariumzout ervan, pyrolyse van N-ethylaniline, katalytische dehydrogenering van o-ethylaniline en verhitting van o,o’-diaminostilbeenhydrochloride onder verminderde druk.
Indool kan ook worden verkregen door de reductie van o-nitrofenylacetonitril, o-nitrokaneelzuur of o-nitrofenylacetaldehyde.
Tot slot kan indool worden bereid door acetyl-o-aminokaneelzuur te behandelen met zoutzuur bij hoge temperaturen of door reductie van o-ω-dinitrostyreen. Verhitting van indool-2-carbonzuur en chinoline-2,3-dicarbonzuur met calciumcarbonaat geeft ook indool.
3.3. De Fischer Indool Synthese
De Fischer-reactie is de meest veelzijdige gebleken voor de synthese van indoolderivaten, hoewel de reactie zelf geen indool kan produceren. Vanuit een theoretisch oogpunt zou acetaldehyde-fenylhydrazon indool opleveren via de Fischer-synthese, maar in werkelijkheid wordt er geen indool verkregen.
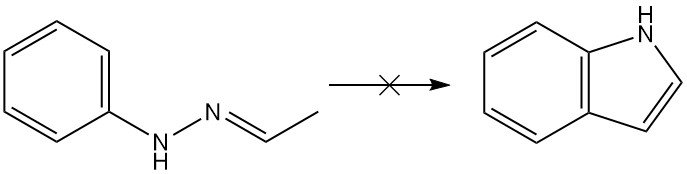
De Fischer-indoolsynthese is een klassieke methode voor de bereiding van indolen die de cyclisatie van een N-arylhydrazon onder zure omstandigheden omvat om een indool te vormen.
De belangrijkste stap in de Fischer-indoolsynthese is een [3,3]-sigmatrope herschikking van het enehydrazon-tautomeer van de hydrazon. Om de cyclisatie te laten plaatsvinden, moet er ten minste één α-waterstofatoom aan de C-N-binding zitten. De regioselectiviteit van de reactie wordt beïnvloed door de substituenten op het hydrazonkoolstof.
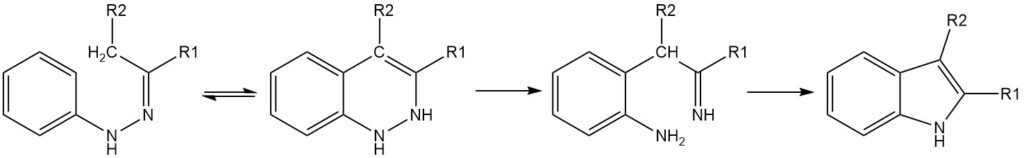
Als er maar één waterstofatoom α aan de C-N-binding zit, is het product een 3,3-digesubstitueerde-3H-indool. Als beide substituenten op het hydrazonkoolstofatoom één of meer α-waterstoffen hebben, kunnen er productmengsels ontstaan.
Over het algemeen is de kans groter dat de meer vertakte substituent cyclisatie ondergaat. Fenylhydrazonen afgeleid van methylalkylketonen leveren bijvoorbeeld doorgaans 2-methylindolen op. De selectiviteit kan echter onder bepaalde reactieomstandigheden worden teruggedraaid.
De aanwezigheid van substituenten op de fenylring van de hydrazon kan ook de regioselectiviteit van de Fischer-indoolsynthese beïnvloeden. Meta-substituenten kunnen leiden tot de vorming van isomere indolen, terwijl ortho-substituenten de reactie ingewikkelder maken.
3.4. Biosynthese van indool uit tryptofaan
Een van de primaire bronnen van indool in biologische systemen is het aminozuur tryptofaan. De omzetting van tryptofaan naar indool vindt plaats via een reeks enzymatische reacties die bekend staan als het tryptofaanafbraakpad. Dit pad wordt voornamelijk aangetroffen in bacteriën en schimmels, maar kan ook actief zijn in bepaalde zoogdierweefsels, zoals de lever en de darmen.
De eerste stap in dit pad is de splitsing van tryptofaan door het enzym tryptofanase. Deze reactie produceert indool, pyruvaat en ammoniak.
Naast het tryptofanasepad kan tryptofaan ook worden afgebroken via het kynureninepad, dat voornamelijk betrokken is bij de productie van niacine (vitamine B3), maar ook indoolderivaten produceert.
4. Toepassingen van indool
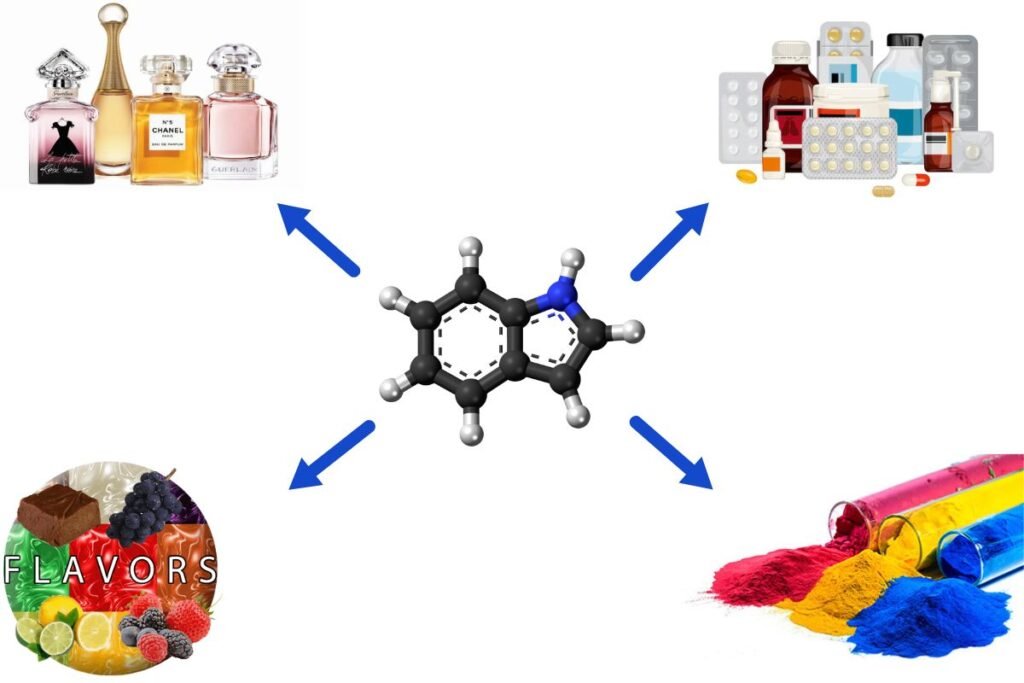
Indool wordt gebruikt in verschillende industrieën, waaronder farmaceutica, parfumerie en smaakstoffen. Het is ook een natuurlijk bestanddeel van verschillende stoffen, zoals tabaksrook, jasmijnolie en oranjebloesemolie. Het is een bacterieel afbraakproduct van tryptofaan in de darmen.
Vanwege het aangename aroma wordt indool al jarenlang gebruikt als fixeermiddel voor geuren. Het wordt ook gebruikt als synthetisch smaakmiddel.
Indool kan fungeren als een kairomon, een vluchtige chemische stof die door planten wordt vrijgegeven om fytofage insecten aan te trekken.
Indool is een voorloper voor de synthese van het essentiële aminozuur tryptofaan. Zowel chemische als biotechnologische methoden kunnen worden gebruikt om tryptofaan uit indool te produceren.
Indool wordt gebruikt om plantengroeiregulatoren te synthetiseren, zoals indool-3-azijnzuur en indool-3-butaanzuur. Indoline, een derivaat van indool, wordt gebruikt bij de synthese van fungicide en bacteriedodende plantenbeschermingsmiddelen.
Indoolderivaten hebben een breed scala aan farmaceutische toepassingen, zoals:
- Indomethacine en andere indoolderivaten worden gebruikt als milde analgetica.
- Indoline en zijn derivaten worden gebruikt bij de synthese van antihypertensiva.
- Tryptamine, een derivaat van indool, wordt gebruikt bij de synthese van de vaatverwijder Vincamine.
- Pyridylalkylindolen, afgeleid van indool, worden gebruikt als antidepressiva, antihistaminica en antihypertensiva.
- 3-peridinylindolen, verkregen uit indool, worden gebruikt om anoxie te voorkomen.
- 5-Chloroindool, een derivaat van indool, wordt gebruikt bij de productie van kalmeringsmiddelen, bloeddrukverlagende medicijnen en anti-emetica, en bij de behandeling van de ziekte van Parkinson. ziekte.
Indool en zijn derivaten worden gebruikt als tussenproducten bij de synthese van verschillende kleurstoffen, waaronder kationische diazokleurstoffen, cyaninekleurstoffen, indolylmethaankleurstoffen en carbazole-ftaleïnekleurstoffen.
5. Toxicologie van indool
De algemene bevolking kan worden blootgesteld aan indool door inademing van omgevingslucht of tabaksrook, inname van besmet voedsel en huidcontact met dampen, voedsel, parfums of andere producten die indool bevatten. Beroepsmatige blootstelling kan plaatsvinden op werkplekken waar indool wordt geproduceerd of gebruikt.
Indool kan via verschillende routes worden opgenomen, waaronder inademing, inname en huidcontact.
Indool dat wordt opgenomen uit het maag-darmkanaal wordt in de lever gemetaboliseerd tot indoxyl, dat vervolgens wordt geconjugeerd met sulfaat om indican te produceren. Deze metabolieten worden voornamelijk via de urine uitgescheiden.
Indool wordt gemakkelijk opgenomen uit het maag-darmkanaal en ondergaat een snelle metabolisatie in de lever. De primaire metabolieten van indool omvatten indican en oxindole, die voornamelijk via de urine worden uitgescheiden.
De acute orale LD50 van indool bij ratten en muizen is respectievelijk ongeveer 1000-1100 mg/kg en 500 mg/kg. Autopsieonderzoeken na acute blootstelling onthulden bloedingen en hyperemie in interne organen en weefsels. Indool heeft een onaangename geur en kan misselijkheid veroorzaken bij lage concentraties.
Indool kan lichte tijdelijke irritatie van de huid en ogen veroorzaken bij plaatselijke toepassing. In tegenstelling tot het gemethyleerde derivaat, skatol, veroorzaakt indool geen longschade bij runderen na herhaalde orale toediening.
Hoge chronische doses indool (20-200 mg/kg/dag gedurende meer dan drie maanden) bij muizen, ratten, konijnen en honden zijn in verband gebracht met hematologische effecten, waaronder bloedarmoede, leukocytose en leukopenie. Bij runderen zijn hemolyse en hemoglobinurie-nefrose waargenomen na herhaalde orale doses.
Hoewel er geen definitief experimenteel bewijs is voor de carcinogeniciteit van indool, kan het de vorming van tumoren die door andere middelen worden veroorzaakt, beïnvloeden. Hoge doses indool (800 mg/kg/dag) blijken de ontwikkeling van huidtumoren en blaaskankers in diermodellen te versnellen.
Wat betreft genotoxiciteit, is gebleken dat indool de mutagene effecten van andere middelen in de Ames-test versterkt. Indool zelf was echter niet mutageen in de Ames-test of in een celtransformatietest. In een DNA-hersteltest veroorzaakte indool herstelbare DNA-schade in Bacillus subtilis.
Indool heeft de GRAS-status (generally recognized as safe) gekregen van de Flavor and Extract Manufacturer’s Association (FEMA) en is goedgekeurd voor gebruik als smaakstof in voedsel. Er zijn echter geen specifieke beroepsmatige blootstellingslimieten voor indool vastgesteld door regelgevende instanties.
Referenties
- Indole; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a14_167
- Indole; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0914041519211404.a01
- Indole; Encyclopedia of Toxicology (Third Edition). – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543008605
- Indole; Chemistry of Heterocyclic Compounds, Volume 8. – https://onlinelibrary.wiley.com/doi/10.1002/9780470186572.ch1
- https://www.sciencedirect.com/science/article/abs/pii/S092809871630207X
- https://www.sciencedirect.com/science/article/abs/pii/S0040403921007413
