Cumeen: eigenschappen, reacties, productie, toepassingen en toxicologie
Wat is cumeen?
Cumeen, ook bekend als isopropylbenzeen of 2-fenylpropaan, is een aromatische koolwaterstof met de chemische formule C9H12. Het is een kleurloze, brandbare vloeistof met een karakteristieke benzine-achtige geur.
Cumeen komt voor als een klein bestanddeel van ruwe olie en van aardolie afgeleide brandstoffen. Het wordt voornamelijk gebruikt als tussenproduct in de chemische industrie, met name bij de productie van fenol en aceton.
Inhoudsopgave
1. Fysische eigenschappen van cumeen
Cumeen is een kleurloze, vluchtige vloeistof met een karakteristieke aromatische geur. Het is mengbaar met vele organische oplosmiddelen, waaronder ethanol, di-ethylether, aceton, benzeen, petroleumether en tetrachloorkoolstof. De oplosbaarheid in water is laag, ongeveer 61,3 mg/l bij 25 °C.
Cumeen vormt azeotropen met water, alifatische carbonzuren, ethyleenglycolethers, cyclohexanol en cyclohexanon.
Cumeen heeft een variabele geurdrempel, met gerapporteerde waarden variërend van 0,008 tot 0,13 ppm. Hoewel sommige studies een menselijke geurwaarneming van slechts 0,0032 ppm rapporteren, noemen andere waarden dichter bij 0,012 ppm. Geurdetectie is geen betrouwbare methode om gevaarlijke blootstelling aan cumeen te beoordelen.
De explosiegrenzen voor cumeen-luchtmengsels liggen tussen 0,8% en 6,0% volume. Dit komt overeen met een cumeenconcentratie van 40-300 g/m³.
Tabel 1 bevat alle belangrijke fysische eigenschappen van cumeen.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | 98-82-8 |
| Chemische formule | C9H12 |
| Molaire massa | 120,2 |
| Vriespunt, °C | −96,03 |
| Kookpunt, °C | 152,39 |
| Dichtheid, g/cm3 (0 °C) | 0,8797 |
| Dichtheid, g/cm3 (20 °C) | 0,8633 |
| Dichtheid, g/cm3 (40 °C) | 0,8465 |
| Breukindex, n20D | 1,4915 |
| Thermische geleidbaarheid bij 25 °C, W/(m·K) | 0,124 |
| Viscositeit, mPa·s (0 °C) | 1,073 |
| Viscositeit, mPa·s (20 °C) | 0,790 |
| Viscositeit, mPa·s (40 °C) | 0,610 |
| Oppervlaktespanning bij 20 °C, mN/m | 28,2 |
| Dampspanning bij 35 °C, kPa | 1 |
| Dampspanning bij 100 °C, kPa | 21 |
| Dampspanning bij 120 °C, kPa | 40 |
| Dampspanning bij 140 °C, kPa | 73 |
| Dampspanning bij 180 °C, kPa | 196 |
| Vlampunt, °C | 33 |
| Zelfontbrandingstemperatuur, °C | 425 |
| Brandgrenswaarden in lucht, vol.% (onder) | 0,9 |
| Brandgrenswaarden in lucht, vol.% (boven) | 6,5 |
| Kritische temperatuur, °C | 358,0 |
| Kritische druk, kPa | 3220 |
| Kritische dichtheid, g/cm3 | 0,280 |
| Verdampingswarmte bij kookpunt, J/g | 312 |
| Verdampingswarmte bij 25 °C, J/g | 367 |
| Vormingswarmte (vloeistof) bij 25 °C, J/mol | −44.150 |
| Vrije energie (damp) bij 25 °C, J/mol | 137.000 |
| Verbrandingswarmte (bruto, vloeibaar water), J/g | 43.370 |
| Verbrandingswarmte (netto, waterdamp), J/g | 41.170 |
| Warmtecapaciteit (vloeistof) bij 25 °C, J/(mol·K) | 197 |
| Warmtecapaciteit (ideale damp) bij 25 °C, J/(mol·K) | 153 |
2. Chemische reacties van cumeen
De oxidatie van cumeen tot cumeenhydroperoxide is de belangrijkste industriële reactie van cumeen. Andere reacties zijn onder andere typische aromatische substitutie (nitratie, sulfonering, halogenering, alkylering en acylering), zijketenhalogenering, hydrogenering en verbranding.
2.1. Het cumeenproces
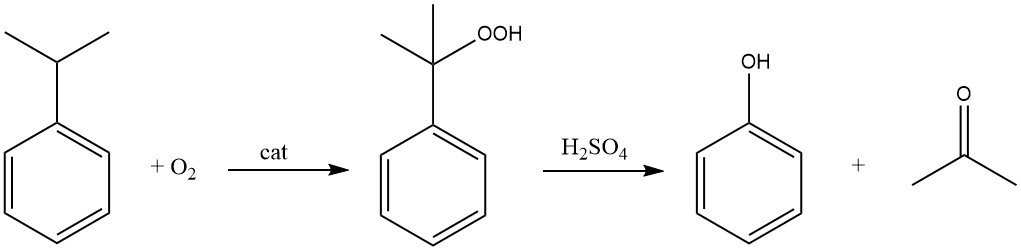
Het cumeenproces, ook bekend als het Hock-proces, begint met de synthese van cumeen zelf, gevolgd door een tweestapsconversie naar fenol en aceton.
Het cumeen wordt geoxideerd door lucht (zuurstof) in aanwezigheid van een radicaalinitiator om cumeenhydroperoxide te vormen. Deze reactie richt zich op het tertiaire waterstofatoom op het koolstofatoom dat aan de benzeenring gebonden is.
Met behulp van een zure katalysator zoals zwavelzuur wordt het cumeenhydroperoxide vervolgens gesplitst om fenol en aceton te produceren.
2.2. Reacties op de aromatische ring
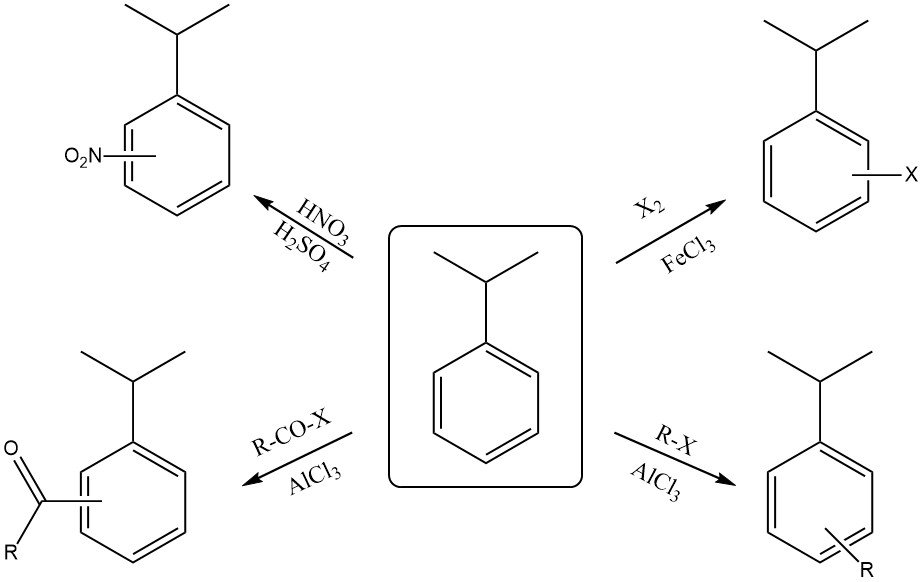
Cumeen reageert met een mengsel van geconcentreerd salpeterzuur en zwavelzuur tot een mengsel van ortho-nitrocumeen en para-nitrocumeen. Het para-isomeer is doorgaans het hoofdproduct vanwege sterische hindering door de omvangrijke isopropylgroep.
Halogenering van de ring met reagentia zoals chloor of broom in aanwezigheid van een Lewiszuurkatalysator (FeCl3 of FeBr3) leidt ook tot ortho- en para-substitutie.
Reactie met rokend zwavelzuur levert cumeensulfonzuur op.
Cumeen kan reageren met een alkylhalogenide en een Lewiszuurkatalysator (AlCl3 ) om alkylcumeen te vormen.
De reactie van cumeen met een acylhalogenide in aanwezigheid van een Lewiszuurkatalysator (AlCl3) levert een ortho- en para-acylcumeen op.
2.3. Reacties op de alkylzijketen
De benzylische waterstof (de waterstof op de koolstof die direct aan de benzeenring gebonden is) is bijzonder gevoelig voor radicaalreacties vanwege de stabiliteit van het resulterende benzylradicaal.
Cumeen kan worden geoxideerd met sterke oxidatiemiddelen zoals kaliumpermanganaat of chroomzuur. Deze reactie oxideert de benzylische koolstof volledig tot een carbonzuurgroep, waardoor benzoëzuur ontstaat en niet fenol.
Onder hoge temperaturen, UV-licht of in aanwezigheid van radicaalinitiatoren zullen halogenen zoals chloor of broom uitsluitend op de benzylische positie reageren om het waterstofatoom te vervangen.
Hydrogenatie van de aromatische ring levert isopropylcyclohexaan op met behulp van katalysatoren zoals Ni, Pt of Pd.
Net als andere koolwaterstoffen verbrandt cumeen in aanwezigheid van zuurstof, waarbij koolstofdioxide en water ontstaan.
3. Industriële productie van cumeen
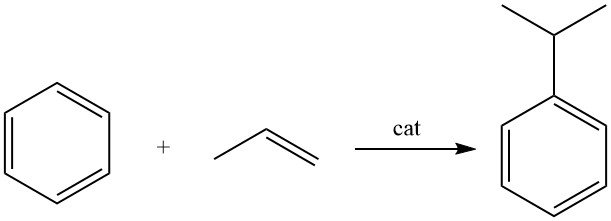
Cumeen wordt geproduceerd door de alkylering van benzeen met propeen in aanwezigheid van een zure katalysator.
Cumeen werd van oudsher in grote hoeveelheden gesynthetiseerd voor gebruik als component in vliegtuigbenzine tijdens de Tweede Wereldoorlog. Hoewel het een hoge verbrandingswaarde en octaangetal heeft, is het niet langer concurrerend als brandstof. De aanwezigheid ervan in moderne benzine is een klein bijproduct van raffinaderijprocessen zoals katalytische reforming en stoomkraken.
De productie van cumeen heeft aanzienlijke vooruitgang geboekt met de ontwikkeling van nieuwe katalysatortechnologieën, met name op zeoliet gebaseerde systemen, die oudere methoden met vast fosforzuur en aluminiumchloride hebben vervangen. Deze technologische verschuiving, die halverwege de jaren negentig begon, heeft de industrie radicaal veranderd.
Naast synthetische productie is cumeen van nature aanwezig in ruwe olie en geraffineerde aardolieproducten.
3.1. Alkylerings- en transalkyleringsreacties
Cumeen wordt geproduceerd door de alkylering van benzeen met propyleen in de vloeibare fase met behulp van een zure katalysator.
Deze voorwaartse reactie is thermodynamisch gunstig. De omzetting van propyleen kan echter worden beperkt door de activiteit van de katalysator en de massaoverdracht. Hoewel n-propylbenzeen thermodynamisch stabieler is dan cumeen, wordt het slechts in kleine hoeveelheden geproduceerd omdat de secundaire koolstof van het propyleenmolecuul reactiever is.
De secundaire koolstof vormt een carbokation op de zure plaats van de katalysator, dat vervolgens reageert met benzeen om cumeen te vormen. Een hoge selectiviteit voor cumeen ten opzichte van n-propylbenzeen, met een verhouding tot 10.000:1, is belangrijk, omdat deze isomeren niet gemakkelijk te scheiden zijn door destillatie.
Verdere alkylering kan ook plaatsvinden, waarbij cumeen reageert met meer propyleen om polyisopropylbenzenen te produceren, waaronder diisopropylbenzenen, triisopropylbenzenen en tetraisopropylbenzenen.
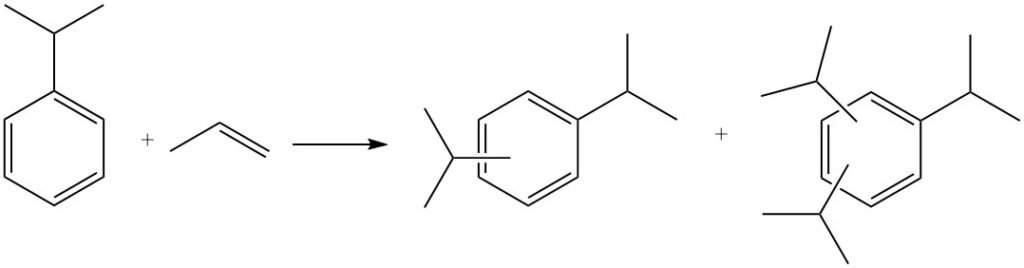
Polyisopropylbenzenen kunnen worden omgezet in cumeen door te reageren met benzeen in een proces dat transalkylering wordt genoemd.
Alkylering is een exotherme reactie, terwijl transalkylering in wezen isotherm is. Een overmaat aan benzeen wordt doorgaans gebruikt tijdens de alkylering om de temperatuur te beheersen, de vorming van polyisopropylbenzenen te minimaliseren en oligomerisatie van propyleen te voorkomen.
Hoewel een hoge benzeen/propyleenverhouding de cumeenselectiviteit bevordert, verhoogt het ook de kosten en energie die nodig zijn om de overtollige benzeen door destillatie terug te winnen.
3.2. Productie van cumeen door middel van vast fosforzuur (SPA)
Vóór 1996 was het SPA-proces de meest gebruikte methode voor de productie van cumeen, goed voor meer dan 80% van de wereldwijde productie. Dit proces gebruikte fosforzuur op aluminiumoxide als katalysator.
Bij deze methode, die wereldwijd door UOP is goedgekeurd, werd een mengsel van vloeibaar propyleen (vaak een propaan-propyleenmengsel) en benzeen, samen met een kleine hoeveelheid water om de katalysatoractiviteit te behouden, voorverwarmd en in een reactor met vast bed gevoerd die werkte bij 180-200 °C en ongeveer 550 psig.
De typische molaire verhouding benzeen/propyleen varieerde van 5:1 tot 8:1. De reactoren werkten adiabatisch en de warmte die bij de reactie vrijkwam, werd gedeeltelijk gebruikt om het gerecyclede propaan te verdampen.
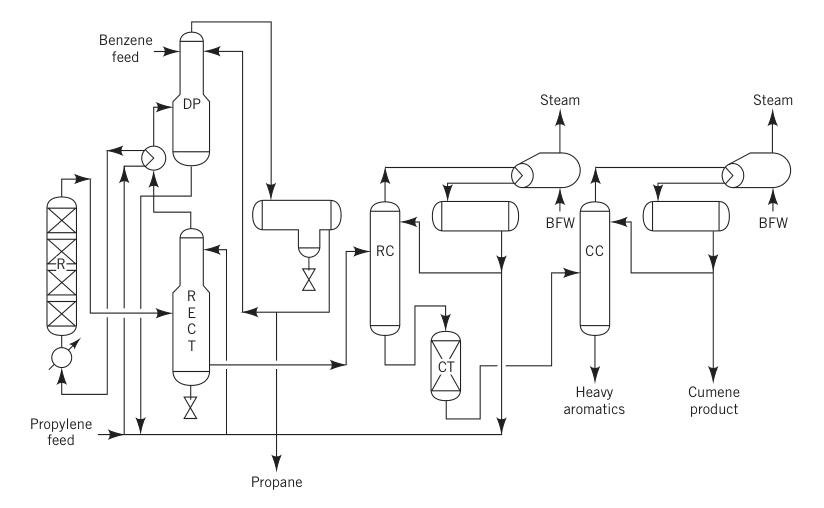
R = reactor; RECT = gelijkrichter; DP = depropanisator; RC = recyclekolom; CT = kleibehandelingsinstallatie; CC = cumeenkolom; en BFW = ketelvoedingswater.
Het SPA-proces was populair vanwege de lagere initiële investering en de flexibiliteit van de grondstof, omdat het gebruik kon maken van raffinaderijkwaliteit propyleen en benzeen met een lage zuiverheidsgraad. Bijproducten, zoals zware aromaten, konden worden gebruikt voor het mengen van benzine, wat een belangrijk voordeel was voor raffinaderijen.
Dit proces had echter een relatief lage opbrengst (~5% verlies) en produceerde onzuiverheden. Pogingen om de zware aromaten terug te winnen en te transalkyleren waren niet succesvol vanwege de hoge concentraties onzuiverheden zoals hexylbenzenen.
3.3. Productie van cumeen met behulp van het aluminiumchlorideproces
Een andere oudere methode voor de productie van cumeen gebruikte een aluminiumchloridecomplex als katalysator en werkte bij temperaturen lager dan 100 °C en lage druk. Dit proces vereiste grondstoffen met een hogere zuiverheidsgraad en een zorgvuldige dehydratie van benzeen om de katalysatoractiviteit te behouden en corrosie te verminderen.
Het aluminiumchlorideproces bood het voordeel dat het polyisopropylbenzenen kon transalkyleren tot cumeen, wat resulteerde in hogere opbrengsten. Het vereiste echter dure corrosiebestendige reactoren, zoals reactoren van Hastelloy of met een glazen binnenbekleding, uitgebreide effluentwassing en leidde tot milieuproblemen in verband met de afvoer van katalysatoren.
3.4. Productie van cumeen met behulp van moderne zeolietgebaseerde processen
Sinds midden jaren negentig is de cumeenindustrie snel overgestapt op zeolietgebaseerde alkyleringstechnologieën. Deze katalysatoren elimineerden de corrosie- en afvalafvoerproblemen die gepaard gingen met eerdere processen en boden tegelijkertijd hoge opbrengsten, een hoge selectiviteit en een zeer hoge productzuiverheid.
Moderne zeolietkatalysatoren kunnen herhaaldelijk worden geregenereerd, wat de afval- en bedrijfskosten verlaagt. Ze maken ook lagere benzeen-propeen-toevoerverhoudingen mogelijk, wat de omvang van het destillatiesysteem verkleint en het energieverbruik verlaagt.
Een opmerkelijk voorbeeld is het ExxonMobil/Badger-proces, dat gebruikmaakt van een gepatenteerde MCM-22-katalysator. In dit vloeistoffaseproces worden propyleen en benzeen voorgemengd en naar een vastbed-alkyleringsreactor geleid, waar propyleen volledig wordt verbruikt. Het effluent wordt vervolgens gezuiverd via een reeks destillatiekolommen.
Overtollig benzeen wordt gerecycled en polyisopropylbenzenen worden teruggewonnen en naar een aparte transalkyleringsreactor gestuurd, waar ze met benzeen reageren om meer cumeen te vormen.
Dit proces levert vrijwel stoichiometrische opbrengsten en een zeer zuiver product op. Bestaande SPA- of aluminiumchloride-installaties kunnen met relatief geringe investeringen worden omgebouwd naar deze technologie met capaciteitsverhogingen van 30 tot meer dan 100 procent.
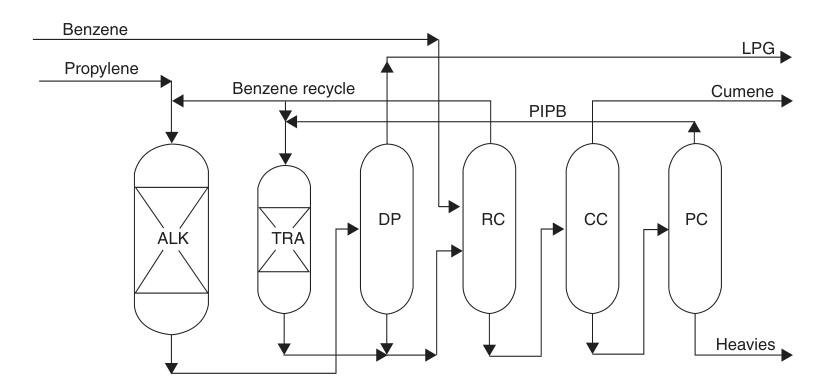
ALK = alkyleringsreactor; TRA = transalkyleringsreactor; DP = propanisator; RC = recyclekolom; CC = cumeenkolom; en PC = polyisopropylbenzenenkolom.
Andere bedrijven, waaronder CDTech, Dow/Kellogg en UOP, hebben ook hun eigen zeolietgebaseerde technologieën ontwikkeld. Zo maakt het Q-Max-proces van UOP gebruik van een nieuwe generatie katalysatoren die herhaaldelijk kunnen worden geregenereerd, waardoor afvalverwerking overbodig is.
Deze technologie kan ook de capaciteit van bestaande fabrieken uitbreiden met minimale kapitaalinvesteringen. De overstap naar deze geavanceerde processen heeft veel cumeenfabrieken in staat gesteld hun productiecapaciteit aanzienlijk te verhogen.
4. Toepassingen van cumeen
Cumeen heeft een octaangetal van 109, vergelijkbaar met dat van tolueen. Deze eigenschap maakte het in de jaren 40 waardevol als additief voor vliegtuigbenzine.
Cumeen wordt nu bijna volledig (95% van de totale productie) gebruikt als tussenproduct voor de productie van fenol en aceton. In aanwezigheid van zuurstof ondergaat cumeen oxidatie tot cumeenhydroperoxide, wat na zuurgekatalyseerde splitsing fenol en aceton oplevert.
De wereldwijde productie van cumeen bereikte in 2020 ongeveer 18 miljoen ton en zal naar verwachting toenemen, voornamelijk door de groeiende vraag naar bisfenol A bij de productie van polycarbonaat en epoxyhars.
Bijproducten die tijdens het oxidatieproces van cumeen ontstaan, zijn onder andere α-methylstyreen, acetofenon, cumylalcoholen en di-isopropylbenzeen.
α-methylstyreen wordt gebruikt bij de productie van acrylonitril-butadieen-styreen (ABS)-harsen, p-cumylfenol en andere tussenproducten.
Cumeenhydroperoxide wordt ook gebruikt als radicaalinitiator bij de copolymerisatie van styreen met butadieen en acrylaten en bij de vernetting van onverzadigde polyesterharsen. De reactie van cumeenhydroperoxide met α-methylstyreen levert dicumylperoxide op, een initiator voor de radicale vernetting van polyolefinen.
Hydrogenering van cumeen levert isopropylcyclohexaan (hydrocumeen) op, een cycloalifatisch oplosmiddel met een hoog kookpunt (154,5 °C) en een laag vriespunt (–90 °C).
Cumeen wordt ook in kleinere hoeveelheden gebruikt als verdunner voor verf, email en lak, en als oplosmiddel voor vetten en harsen, soms ter vervanging van benzeen in industriële toepassingen.
Volgens de Consumer Product Information Database (2022) wordt cumeen aangetroffen in meer dan honderd consumenten- en huishoudelijke producten, waaronder pesticiden en schoonmaakmiddelen.
5. Toxicologie van cumeen
Blootstelling aan cumeen vindt voornamelijk plaats door inademing van verontreinigde lucht op de werkplek en door de verdamping van aardolieproducten. Andere bronnen zijn sigarettenrook, verontreinigd voedsel en water, en accidentele inname of absorptie via de huid.
Inhalatie is de belangrijkste route, aangezien cumeen gemakkelijk via de longen wordt opgenomen, in de lever wordt gemetaboliseerd tot in water oplosbare verbindingen en efficiënt wordt uitgescheiden, voornamelijk via de urine, zonder aanwijzingen voor langdurige accumulatie.
Toxicokinetische studies bij mensen bevestigen dat cumeen en zijn metaboliet 2-fenyl-2-propanol binnen 40 uur na blootstelling worden geëlimineerd.
Acute blootstelling aan hoge concentraties cumeen veroorzaakt depressie van het centrale zenuwstelsel, wat zich manifesteert als hoofdpijn, duizeligheid, narcose, misselijkheid en bewusteloosheid bij concentraties die ver boven de beroepsmatige blootstellingslimieten liggen.
Cumeen is ook een primaire irriterende stof voor de huid, ogen en luchtwegen. Herhaald of langdurig contact met de huid kan dermatitis en huiduitslag veroorzaken, terwijl inname een hoog risico op aspiratiepneumonie met zich meebrengt.
In dierstudies veroorzaakte kortdurende inhalatie bij concentraties boven 1000 ppm reversibele neurotoxische effecten, terwijl blootstelling aan zeer hoge doses leidde tot ernstige toxiciteit voor het centrale zenuwstelsel en de dood.
De orale LD50 bij ratten bedraagt ongeveer 1400 mg/kg en de inhalatie-LC50-waarden variëren van 2000 tot 8000 ppm, afhankelijk van de soort.
| Blootstellingsroute | Symptomen | Eerstehulpmaatregelen |
|---|---|---|
| Inademen en ruiken | Duizeligheid Coördinatieverlies Slaperigheid Hoofdpijn |
In de frisse lucht brengen en rusten Indien nodig medische hulp inroepen |
| Huidcontact |
Droge huid Uitslag Jeuk Rode huid |
Verontreinigde kleding onmiddellijk verwijderen en de huid met water wassen. Sommige bronnen suggereren om de huid na het spoelen met water en zeep te wassen. Raadpleeg een arts als de irritatie na het wassen aanhoudt. |
| Oogcontact |
Oogirritatie Roodheid |
Spoel de ogen onmiddellijk met veel water, waarbij u af en toe de onderste en bovenste oogleden optilt, als de chemische stof in contact komt met de ogen. Neem onmiddellijk medische hulp in. |
| Inslikken en inslikken |
Duizeligheid Coördinatieproblemen Slaperigheid Hoofdpijn |
Er bestaat een risico op aspiratie. Mondspoeling en spoelen worden aanbevolen. Vermijd braken. Raadpleeg onmiddellijk een arts. |
Chronische gegevens bij mensen zijn beperkt, maar dierstudies wijzen op milde hematologische en orgaaneffecten na subchronische inhalatieblootstelling, zoals passieve congestie van de longen, lever, nieren en milt. Er zijn geen consistente immunotoxische effecten gemeld.
Het bewijs voor reproductie- en ontwikkelingstoxiciteit is zwak; studies suggereren een snelle stofwisseling en uitscheiding zonder significante effecten op de vruchtbaarheid of de ontwikkeling van het nageslacht.
Genotoxiciteitstesten hebben overwegend negatieve resultaten opgeleverd in bacteriële, in-vitro- en in-vivosystemen, hoewel sommige dierstudies met hoge doseringen zwakke cytogenetische effecten meldden.
De carcinogeniteitsgegevens bij mensen zijn onvoldoende, maar langetermijninhalatiestudies bij knaagdieren hebben een verhoogde incidentie van lever-, nier- en longtumoren aangetoond, wat ertoe heeft geleid dat het Amerikaanse National Toxicology Program cumeen classificeert als “redelijkerwijs te verwachten kankerverwekkend voor de mens”.
Het Internationaal Agentschap voor Kankeronderzoek (IARC) heeft cumeen ook aangemerkt als mogelijk kankerverwekkend voor de mens (Groep 2B).
De Occupational Safety and Health Administration (OSHA) en de American Conference of Governmental Industrial Hygienists (ACGIH) hebben een tijdgewogen gemiddelde toegestane blootstellingslimiet en drempelwaarde van 50 ppm (245 mg/m³) vastgesteld.
Hoewel acute effecten over het algemeen omkeerbaar zijn, wijzen de langzame inductie en eliminatie van de dempende werking op het centrale zenuwstelsel op mogelijke cumulatieve risico’s.
Referenties
1. Hwang, S.Y. and Chen, S.S. (2010). Cumene. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0321130519030821.a01.pub3
2. Abdolmaleki, G.; Bayrami, Z. Cumene. In Encyclopedia of Toxicology, 4th ed.; Wexler, P., Ed.; Academic Press, 2024; pp 337–343. DOI: 10.1016/B978-0-12-824315-2.00295-5
3. Dimian, A.C. and Bildea, C.S. (2008). Alkylation of Benzene by Propylene to Cumene. In Chemical Process Design (eds A.C. Dimian and C.S. Bildea). https://doi.org/10.1002/9783527621583.ch6
4. Gollapudi, B. B.; Williams, A. L.; Bus, J. S. “A review of the genotoxicity of the industrial chemical cumene.” Mutat. Res./Rev. Mutat. Res., 2021, 787, 108364. DOI: 10.1016/j.mrrev.2021.108364
5. Schmidt, R., Griesbaum, K., Behr, A., Biedenkapp, D., Voges, H.-W., Garbe, D., Paetz, C., Collin, G., Mayer, D. and Höke, H. (2014). Hydrocarbons. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a13_227.pub3
