Cumarine: Eigenschappen, Reacties, Productie, Toepassingen en Toxicologie

Wat is cumarine?
Cumarine, ook bekend als 2H-1-benzopyran-2-one of 1,2-benzopyrone, is een natuurlijk aromatisch lacton met de chemische formule C9H6O2. Het is een kleurloze kristallijne vaste stof met een bitterzoete geur zoals hooi en wordt gebruikt als fixeermiddel in parfums.
Vogel isoleerde cumarine voor het eerst uit tonkabonen (Dipteryx odorata) in 1820, en in 1868 synthetiseerde William Perkin het via de Perkin-reactie.
Cumarine is wijdverspreid in het plantenrijk; het wordt gevonden in zoete klaver, walstro, cassia, honingklaver, lavendel, balsem van Peru en andere planten in een concentratie variërend van 87.000 ppm tot 5 ppb.
Vroeger werd cumarine gebruikt als smaakmaker in levensmiddelen, vooral in combinatie met vanilline. In de Verenigde Staten werd het gebruik ervan in de voedingsmiddelenindustrie echter in 1954 verboden.
Inhoudsopgave
1. Fysieke eigenschappen van cumarine
Cumarine verschijnt als kleurloze, glanzende blaadjes of rhombische kristallen bij kamertemperatuur met een aangename, zoete vanillegeur en een bittere, aromatische brandende smaak. Het is zeer oplosbaar in chloroform en pyridine, oplosbaar in ethanol en ether, en licht oplosbaar in water.
De fysieke eigenschappen van cumarine staan vermeld in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [91-64-5] |
| Chemische formule | C9H6O2 |
| Moleculair gewicht | 146,14 g/mol |
| Smeltpunt | 68-70 °C |
| Kookpunt | 301 °C bij 100 kPa 170,4 °C bij 2,7 kPa 138,5 °C bij 0,7 kPa |
| Dichtheid | 0,94 g/cm3 bij 25 °C 1,178 g/cm3 bij 100 °C |
| Dampspanning | 0,13 kPa bij 106 °C |
| Vlampunt | 150 °C |
| Oplosbaarheid in water | 0,25 g/100 g water bij 25 °C 2 g/100 g water bij 100 °C |
2. Chemische reacties van cumarine
Cumarine ondergaat typische reacties van het lacton van een α,β-onverzadigd aromatisch zuur.
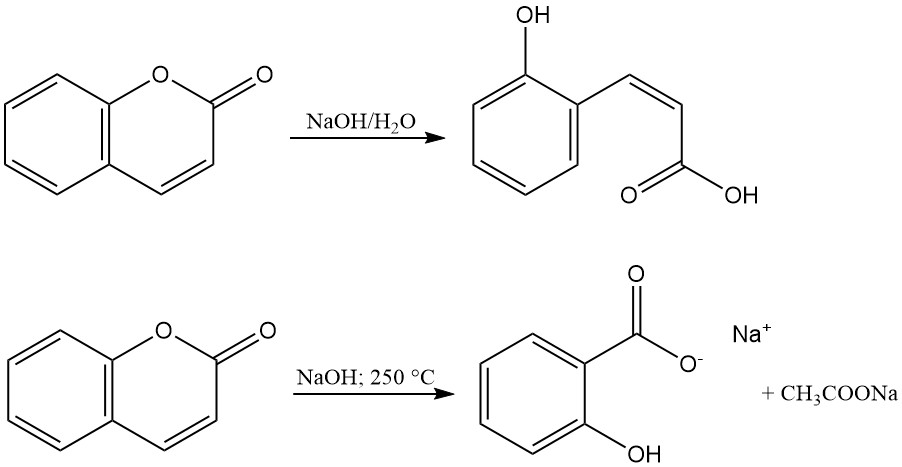
De lactonring van cumarine wordt gehydrolyseerd met alkaliën om zouten van cumarinezuur of o-hydroxy-cis-cinnaminezuur te produceren. Deze zouten zijn geurloos en keren terug naar cumarine door verzuring. De reactie van cumarine met gesmolten natriumhydroxide vormt natriumsalicylaat en natriumacetaat.
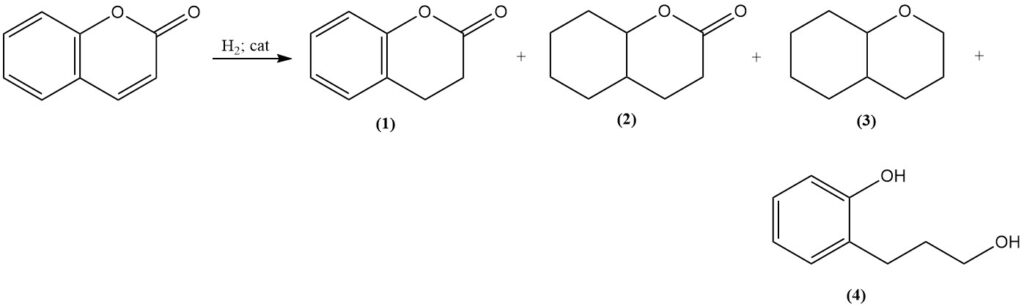
Katalytische hydrogenering van cumarine produceert verschillende producten op basis van reactieomstandigheden. Matige omstandigheden met behulp van Raney-nikkelkatalysator vormen 3,4-dihydrocumarine (1); echter, verhoogde temperatuur en druk leiden tot de vorming van octahydrocumarine (2), hexahydrochroman (3) en polymerisatieproducten.
Selectieve hydrogenering tot 3,4-dihydrocumarine (1) kan worden bereikt met een platina-sulfidekatalysator, en hydrogenering bij verhoogde temperaturen met behulp van een koperchromietkatalysator geeft 3-(o-hydroxyfenyl)-1-propanol (4) met een zeer goede opbrengst.
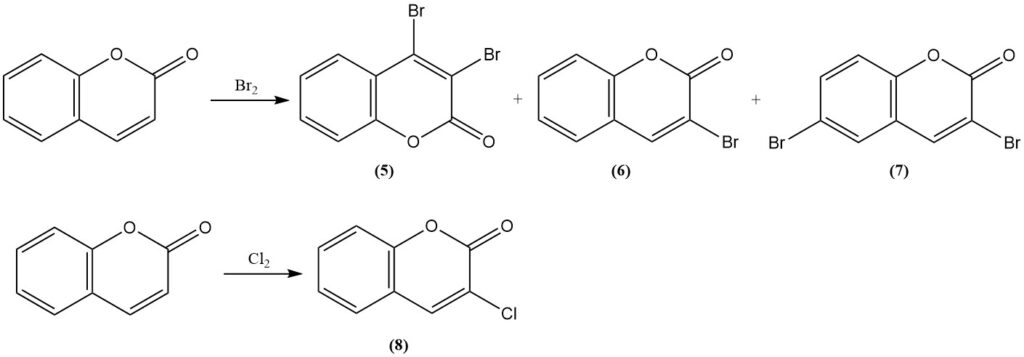
De reactie van cumarine met broom resulteert in 3,4-dibroomcumarine (5) onder milde omstandigheden. Strengere omstandigheden leveren 3-broomcumarine (6) en 3,6-dibroomcumarine (7) op. De reactie met chloor produceert 3-chloorcumarine (8).
De reductie van cumarine met lithiumaluminiumhydride produceert o-hydroxycinnamylalcohol.
O-allylfenol wordt bereid door de reactie van cumarine met diboraan.
Cumarine vormt oplosbare natriumhydrosulfonaten met natriumbisulfiet, die cumarine kunnen regenereren wanneer ze worden aangezuurd. Deze techniek wordt gebruikt om ruwe cumarine te zuiveren.
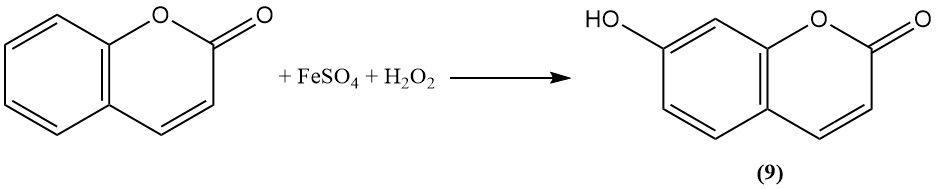
Oxidatie met Fenton’s reagens zet cumarine om in umbelliferon (7-hydroxycumarine) (9).
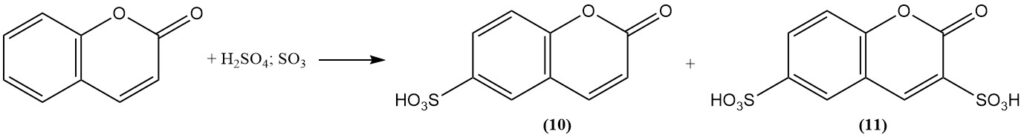
Sulfonering van cumarine met behulp van rokend zwavelzuur vormt bij gematigde temperatuur cumarine-6-sulfonzuur (10) en bij hogere temperatuur cumarine-3,6-disulfonzuur (11).
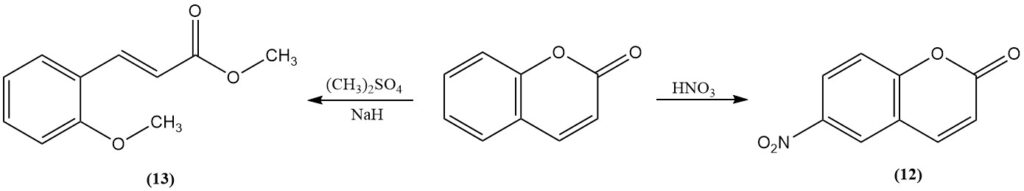
Nitratie met rokend salpeterzuur levert 6-nitrocumarine op (12). Methylering van cumarine met methylsulfaat of methyljodide in aanwezigheid van natriumhydride levert methyl-2-methoxycinnamaat op (13). Boortrifluoride katalyseert de fotodimerisatie van cumarine.
Cumarine kan andere aromatische elektrofiele substituties ondergaan, zoals halogenering, alkylering en acylering.
3. Productie van cumarine
Tot eind jaren 80 werd cumarine uitsluitend verkregen uit natuurlijke bronnen door extractie uit tonkabonen en herten tong. Tegenwoordig wordt het chemisch geproduceerd met o-cresol, fenol en salicylaldehyde als uitgangsmaterialen. Er bestaan diverse synthetische routes voor cumarinesynthese uit elk van deze grondstoffen.
3.1. Productie van cumarine uit o-cresol
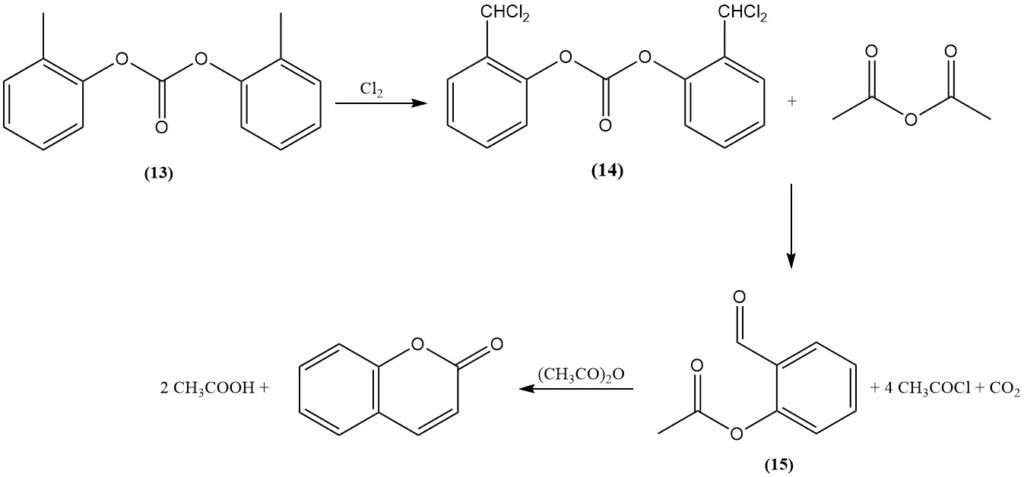
Het Raschig-proces, ontdekt in 1909, is een primaire synthetische route voor cumarine uit o-cresol. Aanvankelijk wordt de fenolische hydroxylgroep van o-cresol beschermd door verestering met fosfaat of, bij voorkeur, carbonaat (13). Vervolgens wordt de methylgroep door dichlorering omgezet in een benzalchloride-intermediair (14).
De resulterende α,α-dichlorocresylester wordt vervolgens omgezet met een alkaliacetaat in een gesmolten hydroxide of met azijnzuuranhydride gekatalyseerd door een metaaloxide, zoals kobaltoxide, om o-acetylsalicylaldehyde (15), acetylchloride en koolstofdioxide te vormen.
Ten slotte genereert de cyclisatie van o-acetylsalicylaldehyde met behulp van azijnzuuranhydride cumarine en azijnzuur.
3.2. Productie van cumarine uit fenol
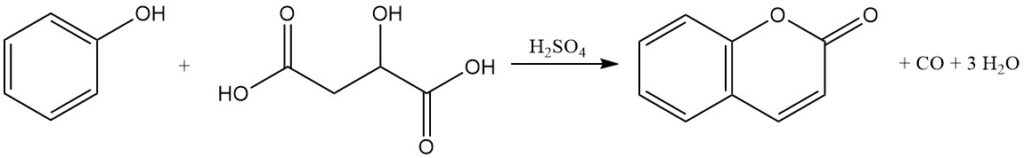
De Pechmann-condensatie, ontdekt in 1883, is een primaire methode voor de productie van cumarine uit fenol. In dit proces wordt cumarine geproduceerd door de reactie van fenol met appelzuur, maleïnezuur of fumaarzuur in aanwezigheid van geconcentreerd zwavelzuur.
De Pechmann-reactie wordt veel gebruikt bij de synthese van talrijke cumarinederivaten. De condensatie van fenol met ethylacetoacetaat produceert bijvoorbeeld 4-methylcumarine. Bovendien kan fenol reageren met diketeen om cumarine te vormen.
Fenol reageert met specifieke acrylzuurderivaten om cumarine te produceren.
Cumarine wordt ook geproduceerd door de reactie van fenol met 3-ethoxyacrylzuurchloride om fenylethoxyacrylaat te produceren, gevolgd door een cyclisatiereactie met behulp van zwavelzuur. Bovendien wordt cumarine gesynthetiseerd door de reactie van fenol met methylacrylaat in een zuur medium in aanwezigheid van lucht.
3.3. Productie van cumarine uit salicylaldehyde
Perkin-reactie
De Perkin-reactie, oorspronkelijk ontdekt door Perkin in 1868, vertegenwoordigt een klassieke methode voor cumarinesynthese uit salicylaldehyde. Dit proces omvat de reactie van salicylaldehyde met azijnzuuranhydride in aanwezigheid van natriumacetaat als katalysator. De reactie verloopt via de vorming van cis-o-acetoxycinnaminezuur (16) als intermediair.
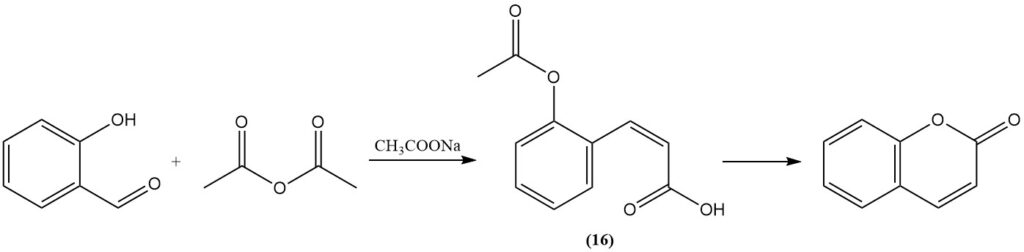
De Perkin-reactie is belangrijk voor de industrie, daarom is deze uitgebreid bestudeerd en aangepast om de efficiëntie ervan te verbeteren. Deze aanpassingen omvatten de toevoeging van jodium, metaaloxiden of zouten; de toevoeging van pyridine of piperidine als katalysatoren; de vervanging van natriumacetaat door kaliumcarbonaat of door cesiumacetaat; en het gebruik van alkalimetaalbiacetaat.
Knoevenagel-reactie
De Knoevenagel-condensatie is een reactie om 3-gesubstitueerde cumarinen te synthetiseren uit salicylaldehyde. Het omvat de condensatie van salicylaldehyde met actieve methyleenverbindingen, zoals acetoazijnzuur, malonzuur of cyanoazijnzuur, in aanwezigheid van een organische basekatalysator zoals ammoniak, pyridine en primaire en secundaire aminen.
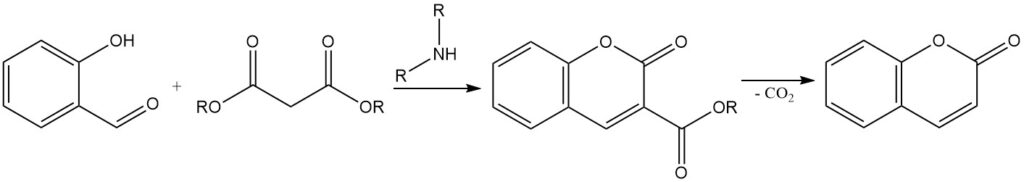
De resulterende 3-gesubstitueerde cumarine kan worden omgezet in cumarine door de substituentgroep te verwijderen. Bijvoorbeeld, cumarine 3-carbonzuur, verkregen uit de condensatie van salicylaldehyde met malonzuur, kan worden gedecarboxyleerd door verhitting tot 290 °C om cumarine te vormen.
Een milde decarboxyleringsreactie met een betere opbrengst kan worden bereikt met behulp van kwikzouten.
3.4. Andere methoden
Alternatieve synthetische routes naar cumarine omvatten de cyclodehydrogenering van oxocyclohexaanpropionaat en de dehydrogenering met behulp van elementaire zwavel of dampfasekatalyse met metaaloxiden van 3,4-dihydrocumarine, die wordt verkregen uit de Baeyer-Villiger-oxidatie van 1-indanon.
3.5. Zuivering van cumarine
Synthetische cumarine moet een hoge zuiverheid hebben om te kunnen worden gebruikt voor parfum. Conventionele zuiveringsmethoden omvatten fractionele destillatie onder verlaagde druk en kristallisatie uit oplosmiddelen zoals methanol of ethanol.
Extra behandelingen vóór het destillatieproces omvatten de volgende stappen: verhitting van de ruwe cumarine met geconcentreerd zwavelzuur, neutralisatie en wassen met water; oplossen van het gewassen product in geconcentreerd zwavelzuur gevolgd door oxidatie; en refluxen met waterige natriumhydroxide met daaropvolgende organische fasescheiding en wassen.
Vacuümazeotrope destillatie met polyhydroxyalcoholen, zoals triethyleenglycol, is een alternatieve zuiveringsmethode. Zone-smelttechnieken zijn ook gerapporteerd voor cumarinezuivering.
4. Toepassingen van cumarine
Vanwege zijn kenmerkende zoete aroma en stabiliteit wordt cumarine gebruikt als geurstof in parfums, zepen, detergenten en lotions in concentraties variërend van 0,01 tot 2,4%.
Cumarine wordt vaak gecombineerd met kruidige geuren en is een integraal onderdeel van de samenstelling van fougère- en chypre-geurtypen. Het wordt gebruikt als fixeermiddel om de levensduur van natuurlijke essentiële oliën, zoals lavendel, citrus, rozemarijn en eikenmos, te verlengen.
Naast parfumerie geeft cumarine aangename aroma’s aan huishoudelijke producten en industriële goederen, terwijl het onaangename geuren maskeert.
Het wordt ook gebruikt als medium in laserkleurstoffen en als sensibilisator in oudere fotovoltaïsche technologieën.
Cumarine en zijn derivaten zijn onderzocht voor mogelijke therapeutische toepassingen, waaronder de behandeling van schizofrenie, microcirculatiestoornissen, angiopathische ulcera, oedemen met veel eiwitten en kanker.
Het wordt gebruikt als medicijn voor de behandeling van lymfoedeem met veel eiwitten en voor verbeterde veneuze circulatie, en is in klinische proeven getest als een antineoplastisch middel
Cumarine is actief gebleken bij propigmentatie en het vertragen van haaruitval. Een cumarinederivaat is gebruikt in polariserende lichtgevende kristallen.
Tegenwoordig is cumarine verboden voor gebruik als direct voedingsadditief; het wordt echter gebruikt als tabaksmaak en het wordt ook gebruikt in de galvaniseerindustrie.
Het is belangrijk om te vermelden dat hoewel van cumarine afgeleide verbindingen zoals warfarine krachtige anticoagulantia zijn, cumarine zelf geen anticoagulantia is.
5. Toxicologie van cumarine
Cumarine brengt aanzienlijke gezondheidsrisico’s met zich mee. Inname, inademing en oogcontact zijn gevaarlijk, terwijl huidcontact minder ernstig is. Acute overmatige blootstelling kan dodelijk zijn. Cumarine vertoont matige toxiciteit voor lever en nieren, met een mediane dodelijke dosis van 275 mg/kg. Levertoxiciteit is uitgesprokener bij ratten dan bij muizen.
Toxicologische gegevens (LD50) voor cumarine zijn:
- 293 mg/kg (rat)
- 196 mg/kg (muis)
- 202 mg/kg (cavia)
Cassia bark, een kaneelsoort, bevat hoge niveaus cumarine. Het consumeren van overmatige hoeveelheden cassia bark kan schadelijk zijn vanwege het verhoogde cumarinegehalte.
De Amerikaanse Food and Drug Administration heeft de directe toevoeging van cumarine aan voedselproducten verboden. Niettemin zijn cumarinebevattende natuurlijke additieven, zoals walstro, toegestaan in alcoholische dranken onder specifieke regelgeving.
5.1. Blootstellingsroutes
Menselijke blootstelling aan cumarine vindt voornamelijk plaats door dermaal contact met parfums en producten die cumarinegeur bevatten. De huid absorbeert cumarine gemakkelijk, waardoor het een belangrijke toedieningsroute is voor therapeutische toepassingen zoals de behandeling van lymfoedeem.
Bovendien kan menselijke blootstelling plaatsvinden door orale inname via natuurlijke voedingsmiddelen, farmaceutische producten en tabaksproducten. Gastro-intestinale absorptie van cumarine is snel.
5.2. Toxicokinetiek
Uitgebreid onderzoek heeft de absorptie, het metabolisme en de uitscheiding van cumarine beschreven. De blootstellingsroute beïnvloedt de bloedspiegels en toxiciteit aanzienlijk.
Orale bolusdoses resulteren in plasmaconcentraties die duidelijk hoger zijn dan die waargenomen bij voedselinname, ondanks equivalente milligram per kilogram lichaamsgewicht.
Dermale blootstelling omzeilt het initiële levermetabolisme (first-pass-effect). Cumarine in het bloed passeert eerst de longen, waar een aanzienlijk deel kan worden uitgeademd vóór het levermetabolisme.
Mensen metaboliseren cumarine voornamelijk tot niet-toxisch 7-hydroxycumarine. De vorming van o-hydroxyazijnzuur in de lever is minimaal en wordt snel ontgift. De afwezigheid van overvloedige Clara-cellen in de menselijke longen voorkomt de vorming van pulmonale epoxide en o-hydroxyazijnzuur, zelfs bij hoge cumarinedoses.
Studies met menselijke levermicrosomen correleren een lage 7-hydroxylatiecapaciteit met verminderde epoxidevorming.
5.3. Acute en kortetermijntoxiciteit
- Dierstudies
De gerapporteerde LD50-waarden voor cumarine variëren van 160 tot 780 mg/kg lichaamsgewicht, met variaties die worden toegeschreven aan diersoort, stam en vastenstatus. Lichte oog- en huidirritatie is waargenomen na blootstelling.
Blootstelling aan cumarine via de voeding op niveaus ≥2500 ppm gedurende ten minste vier weken kan leiden tot een verminderde voedselconsumptie, verminderd lichaamsgewicht en microscopische leververanderingen. Hogere concentraties in het dieet (1-2%) leiden tot voedselweigering en sterfte.
De voortplanting kan nadelig worden beïnvloed bij hoge doseringen die een significante impact hebben op de voedselconsumptie, maar er zijn geen reproductieve of ontwikkelingseffecten gemeld bij lagere doseringen.
- Menselijke studies
Menselijke blootstelling aan cumarine vindt plaats via de consumptie van kaneel, groene thee, honing van zoete klaver en andere voedingsmiddelen. Er zijn gevallen gemeld van bloedingen in verband met kruidenthee met tonkabonen, melilot en walstro.
Farmaceutische cumarinedoseringen variëren van 70 tot 7000 mg/dag, waarbij 200 mg een- of tweemaal daags het meest voorkomende regime is.
Hepatotoxiciteit is zelden gemeld na gebruik van farmaceutische cumarine. Geassocieerde leverenzymveranderingen zijn vaak omkeerbaar na stopzetting van de behandeling en soms zelfs tijdens voortzetting van de behandeling.
Gerapporteerde incidentiecijfers variëren van <0,1 tot 6%, beïnvloed door de onderzoekspopulatie en dosering. Hoewel sommige sterfgevallen in verband zijn gebracht met cumarinegebruik, compliceren verstorende factoren zoals reeds bestaande medische aandoeningen de causale interpretatie.
Studies die het CYP2A6-polymorfisme bij mensen onderzoeken, hebben geen verband vastgesteld met cumarine-geassocieerde leverdisfunctie.
Cumarine is onderworpen aan sensibilisatietests in verschillende modellen, waaronder toepassing op de huid van cavia’s, een test op zwelling van muizenoren en een lokale lymfekliertest (LLNA). Zuivere cumarine leverde consequent negatieve resultaten op, zelfs bij concentraties tot 50% in recente LLNA-onderzoeken.
Een gechloreerde onzuiverheid (6-chlorocumarine) en minder zuivere cumarine afgeleid van o-cresol hebben echter sensibiliserende eigenschappen aangetoond, wat overeenkomt met gerapporteerde sensibilisatiegevallen met cumarinederivaten.
Menselijke populaties kunnen, in tegenstelling tot proefdieren, al eerder zijn blootgesteld aan cumarine of kruisreactieve stoffen, wat de beoordeling van menselijke sensibilisatie compliceert.
De anticoagulerende activiteit van cumarine is aanzienlijk lager dan die van warfarine. Casusrapporten suggereren dat cumarine de effecten van vitamine K-antagonisten kan versterken, hoewel het onderliggende mechanisme onduidelijk blijft. Cumarine is niet in verband gebracht met teratogeniteit of nadelige reproductieve effecten bij mensen.
5.4. Chronische toxiciteit
- Dierstudies
Er zijn uitgebreide langetermijnstudies naar toxiciteit en carcinogeniciteit van cumarine uitgevoerd. De belangrijkste bijwerkingen die bij dieren zijn waargenomen, zijn een verminderde voedselconsumptie die leidt tot een lager lichaamsgewicht en levertoxiciteit, met name bij ratten.
Levertumoren, hoewel niet-metastatisch en niet-dodelijk, zijn gemeld bij ratten die werden blootgesteld aan hoge doses (≥150 mg/kg lichaamsgewicht) die de toename van het lichaamsgewicht aanzienlijk verminderden. Longtumoren zijn geïdentificeerd bij muizen die werden blootgesteld aan hoge bolusdoses (≥150 mg/kg lichaamsgewicht), maar niet bij muizen die via de voeding werden blootgesteld.
- Menselijke studies
Beroepsmatige blootstelling aan cumarinestof kan irritatie van de luchtwegen veroorzaken. Bovendien kan cumarine werken als een zwakke huidsensibilisator bij gevoelige personen, waarbij de mate van sensibilisatie wordt beïnvloed door de zuiverheid van de stof. Er zijn geen andere langetermijneffecten bij mensen gedocumenteerd.
Het Internationaal Agentschap voor Kankeronderzoek (IARC) heeft cumarine ingedeeld in Groep 3, wat aangeeft dat het niet geclassificeerd kan worden als een carcinogeen voor mensen.
In Vitro Toxiciteit
Cumarine is niet mutageen en bindt zich niet aan DNA. Het vertoont geen clastogene eigenschappen, wat duidt op een verwaarloosbare impact op chromosomen.
Reproductieve Toxiciteit
In tegenstelling tot warfarine is cumarine niet teratogeen.
Genotoxiciteit
Meerdere onderzoeken hebben consequent aangetoond dat cumarine niet genotoxisch is. Het heeft beschermende eigenschappen vertoond tegen doxorubicine-geïnduceerde mutaties.
Carcinogeniciteit
Er is geen sluitend bewijs om cumarine te classificeren als een carcinogeen. Sommige onderzoeken suggereren zelfs mogelijke antioxiderende en antineoplastische effecten.
Klinisch beheer van overdosering
Vanwege de relatief lage toxiciteit van cumarine zijn specifieke protocollen voor overdosering beperkt. Algemene maatregelen, zoals maagdecontaminatie in gevallen van significante orale inname, kunnen worden overwogen. Monitoring van de internationale genormaliseerde ratio en leverfunctietesten wordt aanbevolen.
Ecotoxiciteit
Cumarine vertoont een lage milieutoxiciteit. Aquatische toxiciteitsstudies hebben LC50-waarden van 56 mg/l voor vissen en EC50-waarden van 55 mg/l voor Daphnia magna aangetoond. Algenademhaling wordt geremd bij laboratoriumconcentraties van 50 mmol/l.
Gezien de relatief lage persistentie wordt verwacht dat cumarine gemakkelijk in het milieu wordt afgebroken.
Referenties
- Coumarin; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0315211302150919.a01.pub2
- Coumarins. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543007983
- https://www.sciencedirect.com/science/article/abs/pii/B0123694000002696
- https://onlinelibrary.wiley.com/doi/10.1002/mnfr.200900281
- https://www.sciencedirect.com/science/article/abs/pii/B9780124095472126204
- https://pubchem.ncbi.nlm.nih.gov/compound/Coumarin
