Benzidine: Eigenschappen, Productie en Toepassingen
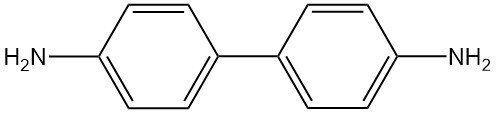
Wat is Benzidine?
Benzidine is een organische verbinding met de chemische formule C12H12N2. Het is een straalgeel, roodgrijs of wit kristallijn vast materiaal dat licht oplosbaar is in water.
Benzidine is een difenylbasen die veel wordt gebruikt als tussenproduct bij de productie van azokleurstoffen en pigmenten. Het wordt ook gebruikt als crosslinking agent in polyurethaankunststoffen en als analytische en diagnostische reagentia.
Benzidine kan reageren met een verscheidenheid aan stoffen, waaronder kationen, anionen, organische verbindingen en oxidatiemiddelen. Deze veelzijdigheid maakt ze waardevolle hulpmiddelen voor een breed scala aan toepassingen.
Inhoudsopgave
1. Fysieke eigenschappen van benzidine
Benzidine is een dizuurverbinding met de chemische formule C12H12N2 en de molaire massa van 184,24 g/mol. De fysieke eigenschappen van benzidine worden weergegeven in de volgende tabel:
| Eigenschap | Waarde |
|---|---|
| Uiterlijk | Wit poeder |
| Smeltpunt | 128 °C (grove staven), 122-125 °C (metastabiele modificatie) |
| Kookpunt | 400-401 °C |
| Dichtheid | 1,25 g/cm³ |
| Oplosbaarheid in water | 1 gewichtsdeel in 2447 delen water bij 12 °C, 106,5 delen water bij 100 °C |
| Oplosbaarheid in organische oplosmiddelen | Weinig oplosbaar in ether (45 delen) en absolute ethanol (13 delen) bij 20 °C |
| Zuurgraad | Diacidisch (kan twee protonen in oplossing doneren) |
| Dissociatieconstanten (bij 30 °C) | K1 = 9,3 x 10-10 K2 = 5,6 x 10-11 |
| Neutralisatiewarmte | 106,5 kJ/mol |
| Dampspanning | < 0,1 mmHg bij 25 °C |
| Breukindex | 1,652 bij 25 °C |
| Vlampunt | 205 °C |
| Zelfontbrandingstemperatuur | 300 °C |
2. Chemische reacties van benzidine
Benzidine verkleurt bij blootstelling aan lucht en is bestand tegen water.
Benzidine vormt blauwe, groene of rode verkleuringen en slaat neer met oxidatiemiddelen. Deze reacties zijn waardevol voor het detecteren van oxidatiemiddelen.
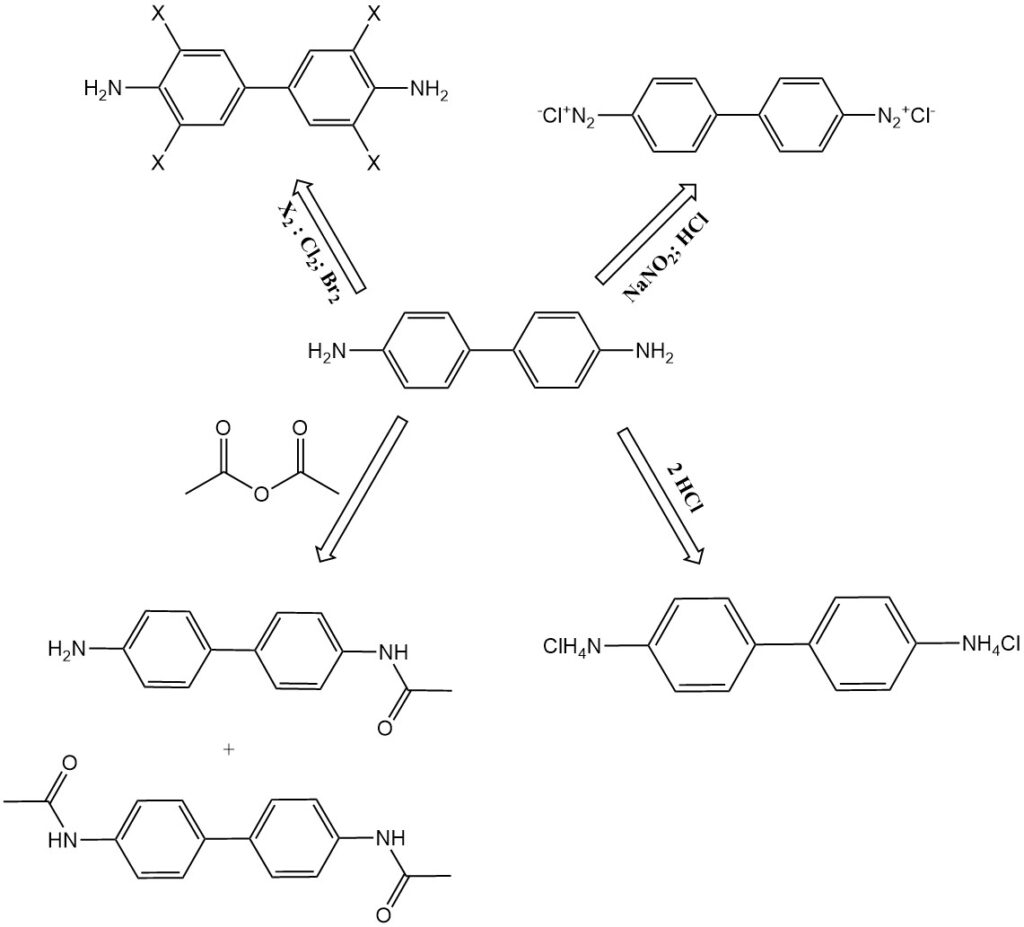
Benzidine transformeert in 3,3′,5,5′-tetrachloorbenzidine en tetrabroombenzidine door respectievelijk chlorering en bromering.
Benzidinesulfaat levert 2-nitrobenzidine, 2,2′-dinitrobenzidine en 2,3′-dinitrobenzeen op door nitreringsreacties. Sulfonzuren en sulfonen van benzidine kunnen worden gevormd onder sulfoneringsomstandigheden.
Benzidine reageert met azijnzuuranhydride om N-acetyleringsproducten te vormen, zoals N-acetyl-benzidine en N,N’-diacetyl-benzidine. Deze verbindingen worden ook aangetroffen als metabolieten in de spijsvertering van dieren.
Benzidine kan worden gediazoteerd om tetrazoniumverbindingen te vormen. De eerste diazoniumgroep koppelt krachtig, terwijl de tweede langzamer reageert. Dit maakt de productie van asymmetrische diazokleurstoffen mogelijk.
Benzidine vormt zouten met zuren, zoals benzidinemonohydrochloride, benzidinedihydrochloride en benzidinesulfaat.
3. Productie van Benzidine
Benzidine wordt in drie fasen geproduceerd:
- Nitrogroepreductie om hydrazoverbindingen te vormen
- Benzidineherrangschikking
- Base-isolatie
Benzidine wordt sinds het einde van de 19e eeuw industrieel vervaardigd uit nitrobenzeen. Veelvoorkomende productiemethoden zijn alkalische ijzerreductie, amalgaamreductie en elektrochemische reductie.
Het resulterende hydrazobenzeen wordt tijdens het afkoelen herrangschikt met zoutzuur of zwavelzuur en het product wordt geïsoleerd als benzidinehydrochloride of benzidinesulfaat. Om het risico op chronische toxiciteit te minimaliseren, wordt de omzetting van deze zouten in de vrije base zoveel mogelijk vermeden.
3.1. Reductie van nitrobenzeen
De reductie van nitrobenzeen tot hydrazobenzeen kan worden weergegeven door de volgende vergelijking:
2 C6H5NO2 + 10 H → C6H5NH-NHC6H5 + 4 H2O
Dit reductieproces staat bekend als het Haber-proces en verloopt via verschillende fasen, waarbij de tussenliggende condensatie van een nitrosoverbinding met een hydroxylamineverbinding plaatsvindt om de azoxyverbinding te vormen.
Deze methode resulteert in de vorming van symmetrische hydrazoverbindingen. Het primaire bijproduct dat wordt gegenereerd, is het monocyclische primaire amine, zoals aniline, dat overeenkomt met de oorspronkelijke nitroverbinding. Dit bijproduct wordt gevormd door zowel de verdere reductie van de fenylhydroxyamine als de disproportionering van de onstabiele hydrazoverbinding.
Verschillende reductietechnieken worden gebruikt in industriële toepassingen, waaronder:
1. Reductie met zinkstof: deze methode omvat de reductie van aromatische nitroverbindingen met zinkstof in een alkalische omgeving. De reactie wordt gegeven door:
2 C6H5NO2 + 5 Zn + 10 NaOH → C6H5NH-NHC6H5 + 5 Na2ZnO2 + 4 H2O
Industrieel wordt nitrobenzeen opgelost in een hoogkokend oplosmiddel en zinkstof wordt in de oplossing gesuspendeerd. Natriumhydroxide-oplossing wordt geëmulgeerd en de reductie vindt plaats. Zorgvuldige controle van de reactietemperatuur is noodzakelijk en het proces is voltooid wanneer de rode kleur van de azo-fase verdwijnt.
2. Reductie met ijzer: Reductie met ijzer en natriumhydroxide-oplossing is minder gebruikelijk in de preparatieve chemie, maar is onderzocht voor commerciële productie. De reductievergelijking is:
2 C6H5NO2 + 4 Fe + 6 H2O → C6H5NH-NHC6H5 + 2 Fe(OH)2 + 2 Fe(OH)3
Verschillende vormen van ijzer, zoals gietijzeren draaisels of ijzerpoeder, worden in deze methode gebruikt. De reductie wordt uitgevoerd in een molaire verhouding van 1:2:4 voor respectievelijk nitrobenzeen, ijzer en natriumhydroxide.
3. Reductie met natriumamalgaam: natriumamalgaam wordt gebruikt voor de reductie van nitrobenzeen bij verhoogde temperaturen. De reductie vindt plaats in een geëmulgeerd mengsel van nitrobenzeen in water of natriumhydroxide, en er wordt een azobenzeenproduct gevormd. Er kan echter enige overreductie tot monocyclische aminen optreden tijdens dit proces.
4. Elektrolytische reductie: elektrochemische reductie op commerciële schaal is een andere methode die wordt gebruikt voor de reductie van nitro tot hydrazoverbindingen. Het omvat het gebruik van elektrolytische cellen met kathoden, diafragma’s en anoden, en de reactie kan worden weergegeven als:
2 C6H5NO2 + 10 H+ + 10 e– → C6H5NH-NHC6H5 + 4 H2O
De reductie wordt uitgevoerd bij verhoogde temperaturen en specifieke stroomdichtheden, waarbij het proces wordt gereguleerd door de toevoeging van reactanten te regelen.
5. Katalytische reductie: Nitrobenzeen kan worden gereduceerd tot hydrazobenzeen door katalytische hydrogenering in aanwezigheid van een palladium-koolstofkatalysator. Deze methode kan verdunde alcohol, een base en verhoogde temperatuur- en drukomstandigheden omvatten.
Er zijn andere reductiemiddelen die worden gebruikt in de preparatieve chemie, zoals verschillende metalen, amalgamen en organische reductiemiddelen zoals methanol, formaldehyde en glucose, die worden gebruikt op basis van specifieke reactievereisten.
3.2. Benzidine-herrangschikking
De benzidine-herrangschikking is een belangrijke stap bij het produceren van diaminodifenylverbindingen. Deze verbindingen worden gevormd door aromatische hydrazoverbindingen te herrangschikken, die aanvankelijk zijn afgeleid van het reduceren van aromatische nitroverbindingen met een alkalische oplossing.
Het herschikkingsproces, dat doorgaans wordt gekatalyseerd door minerale zuren, leidt tot de vorming van diaminodifenylverbindingen (1), (2) en (3) en aminodifenylamineverbindingen (4) en (5).

- Ortho-herschikkingen produceren kleine hoeveelheden o-benzidine (2,2′-diaminodifenyl) (2) en difenyline (2,4′-diaminodifenyl) (3).
- Gedeeltelijke herschikkingen produceren o-semidine (2-aminodifenylamine) (4) en p-semidine (4-aminodifenylamine) (5).

Het type en de hoeveelheid herrangschikkingsproducten worden beïnvloed door de chemische structuur van het uitgangsmateriaal, maar kunnen slechts minimaal worden aangepast door de reactieomstandigheden te variëren. Sommige bijproducten, zoals difenyline (3), worden geproduceerd in hoeveelheden tot 15%, maar hebben geen commerciële waarde.
De benzidine-herrangschikking is een echte intramoleculaire reactie, wat betekent dat het geen gemengde benzidinen oplevert uit mengsels van verschillende hydrazoverbindingen. In plaats daarvan produceert het uitsluitend de overeenkomstige asymmetrische benzidine uit asymmetrisch gesubstitueerde hydrazobenzenen.
In een industrieel proces begint de benzidine-herrangschikking met de hete oplossing die wordt verkregen door het reduceren van nitrobenzeen tot hydrazobenzeen. Hoewel tussentijdse isolatie van hydrazobenzeen niet altijd nodig is, is het in specifieke gevallen raadzaam, zoals bij amalgaamreducties.
Om het azogehalte van hydrazobenzeen te verminderen, kunnen er vóór de herrangschikking reductiemiddelen zoals natriumhydrosulfiet (natriumdithioniet) of zinkstof worden toegevoegd.
De reactie vindt plaats wanneer de hydrazobenzeenoplossing wordt gemengd met een geschikt mineraalzuur, doorgaans 10 – 30% zoutzuur, 20 – 80% zwavelzuur of een mengsel van beide.
De optimale temperatuur voor de herrangschikking is 100 °C voor de difenylbasen. Het is cruciaal om de temperatuur binnen het juiste bereik te houden, omdat overmatige hitte de opbrengst kan verminderen, die doorgaans op 70 – 95% wordt gericht.
3.3. Isolatie van zuivere benzidine
De belangrijkste fase van de benzidine-herschikking is de vorming van het zoutzuur- of zwavelzuurzout van benzidine. Dit zout kan direct worden geïsoleerd, bijvoorbeeld door uitzouten met natriumchloride of natriumsulfaat, of eerst worden omgezet in de vrije base met behulp van een verdunde alkali, zoals natriumhydroxide-oplossing of ammoniakoplossing.
De bijproducten, met name de aniline en difenyline, kunnen worden gescheiden vanwege hun grotere oplosbaarheid. Het azobenzeen is de enige verbinding die overblijft in het inerte oplosmiddel na zuurextractie en kan worden teruggevoerd naar het reductieproces.
4. Toepassingen van benzidine
Benzidine kent verschillende toepassingen, waaronder:
- Kleurstofproductie: Benzidine wordt gebruikt om azokleurstoffen te produceren voor wol, katoen en leer. Het gebruik ervan in deze hoedanigheid is echter afgenomen vanwege de kankerverwekkende werking.
- Kwantitatieve bepaling van zwavelzuur: Benzidine kan worden gebruikt om de concentratie zwavelzuur te bepalen.
- Detectie en bepaling van anionen en metaalionen: Benzidine kan worden gebruikt om verschillende anionen en metaalionen te detecteren en te kwantificeren.
- Detectie van vrij chloor of pyridine: Benzidine kan worden gebruikt om sporen van vrij chloor of pyridine in drinkwater te detecteren.
- Bloeddetectie: Benzidine kan worden gebruikt om bloed te detecteren op basis van de kleurverandering van groen naar blauw in aanwezigheid van waterstofperoxide en peroxidasen.
- Rubberproductie: Benzidine wordt gebruikt als een cross-linking agent bij de productie van rubberproducten, zoals banden en slangen.
- Kunststofproductie: Benzidine wordt gebruikt als stabilisator bij de productie van sommige kunststoffen.
- Farmaceutische productie: Benzidine wordt gebruikt als tussenproduct bij de productie van sommige farmaceutische producten, zoals antihistaminica en antispasmodica.
Benzidine is een zeer giftige verbinding, maar wordt nog steeds gebruikt in verschillende chemische syntheses en toepassingen.
5. Toxicologie van benzidine
Acute orale toxiciteit: LD50 bij ratten = 1,57 g/kg
Subacute blootstelling via de voeding: Bijwerkingen bij muizen zijn onder meer troebele zwelling van de lever, vacuolaire degeneratie van de niertubuli, hyperplasie van myeloïde elementen in het beenmerg en veranderingen in lymfoïde cellen in de thymus en milt.
Dermale en pulmonale absorptie: Er is beperkte informatie beschikbaar, maar systemische manifestaties van toxiciteit suggereren dat er aanzienlijke absorptie kan optreden.
Intraveneuze injectie en metabolisme: Benzidine wordt omgezet in N-acetyl-benzidine en N,N’-diacetylbenzidine, die verder worden omgezet in N-hydroxy-N,N’-diacetylbenzidine en 3-hydroxy-N,N’-diacetylbenzidine. De laatste verbinding bindt zich aan nucleïnezuren.
Resultaten van de Ames-test: Benzidine test positief in de Ames-test en de metabolieten ervan blijken ook mutaties te veroorzaken.
Effecten van DNA: Benzidine leidt tot DNA-strengbreuken en celtransformatie. Het induceert ongeplande DNA-synthese in HeLa-cellen en rattenhepatocyten.
Kankerverwekkende eigenschappen: Benzidinehydrochloride blijkt hepatocellulair carcinoom te veroorzaken bij muizen en andere vormen van kanker bij ratten, hamsters en mensen.
Benzidine is een krachtig carcinogeen bij dieren en mensen. Het is geclassificeerd als Groep A1 door de MAK-commissie en Groep A1b door de ACGIH.
Referentie
- Benzidine and Benzidine Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_539
