Benzeen: eigenschappen, reacties en toepassingen
Wat is benzeen?
Benzeen is een aromatische verbinding met één ring met de formule C6H6. Het is een kleurloze, ontvlambare vloeistof met een zoete geur. Benzeen is thermisch stabiel en chemisch reactief, waardoor het een waardevolle voorloper is van veel andere chemicaliën.
Benzeen wordt voornamelijk gebruikt om styreen, fenol en cyclohexaan te produceren, die worden gebruikt bij de productie van kunststoffen, harsen en andere producten. Het wordt ook gebruikt als oplosmiddel, maar het gebruik ervan is afgenomen vanwege de hoge toxiciteit. Benzeen is ook een bestanddeel van benzine, waar het wordt gebruikt om het octaangetal te verhogen.
Benzeen werd voor het eerst geïsoleerd door Michael Faraday in 1825 en commerciële productieprocessen werden halverwege de 19e eeuw ontwikkeld. Tegenwoordig wordt benzeen voornamelijk verkregen uit aardolie.
Inhoudsopgave
1. Fysieke eigenschappen van benzeen
De Kekulé-structuur van benzeen, een zes-koolstofring met afwisselende enkele en dubbele bindingen, kan zijn eigenschappen niet verklaren. Benzeen is stabieler dan verwacht, zijn NMR-spectrum is ongebruikelijk en zijn bindingslengtes liggen tussen enkele en dubbele bindingen. Het is ook reactiever dan eenvoudige koolwaterstoffen.
Deze eigenschappen suggereren dat benzeen een hybride structuur heeft, met gedelokaliseerde elektronen.
Tabel 1 geeft belangrijke fysieke eigenschappen van benzeen:
| Eigenschap | Waarde |
|---|---|
| Moleculair gewicht | 78,11 g/mol |
| Geur | Zoet |
| Kleur | Kleurloos |
| Dichtheid bij 20 °C | 0,879 g/cm³ |
| Smeltpunt | 5,53 °C |
| Kookpunt | 80,01 °C |
| Breukindex bij 20 °C | 1,501 |
| Kritische dichtheid | 0,309 g/cm³ |
| Kritische druk | 48,9 bar |
| Kritische temperatuur | 288,9 °C |
| Vlampunt | -11 °C |
| Ontstekingstemperatuur | 595 °C |
| Explosiegrenzen in lucht (vol%) | 1,4–6,7 |
| Viscositeit bij 20 °C | 0,654 mPa·s |
| Oplosbaarheid in water | Licht oplosbaar |
| Oplosbaarheid in organische oplosmiddelen | Mengbaar met de meeste organische oplosmiddelen |
2. Chemische eigenschappen van benzeen
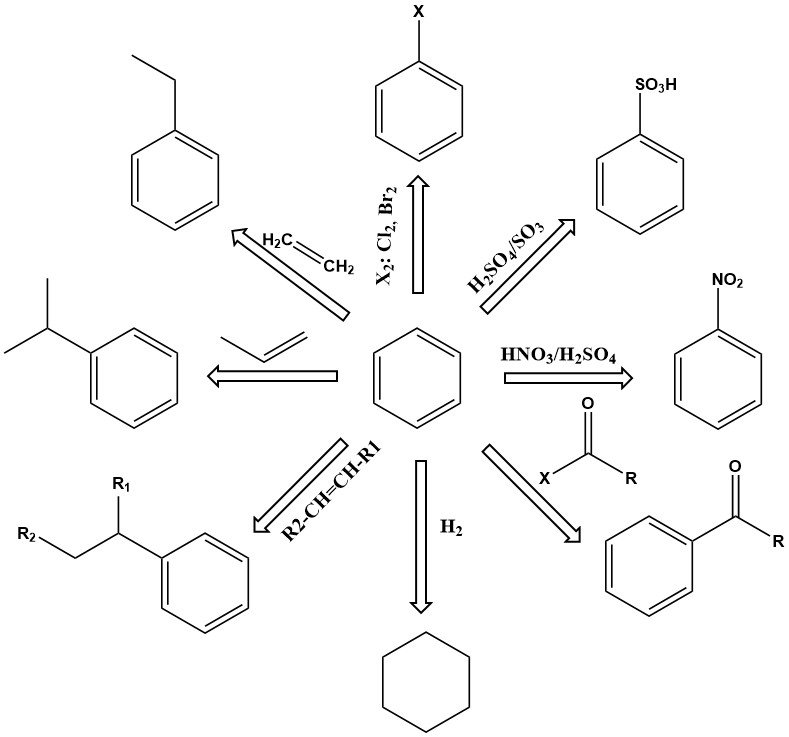
Benzeen als basiseenheid van aromatische verbindingen is een belangrijke industriële chemische stof met een breed scala aan toepassingen. Het is thermisch stabiel en ondergaat verschillende reacties, waaronder substitutie, additie en dehydrogenering, om een groot aantal nuttige producten te produceren.
Substitutiereacties van benzeen zijn van primair belang. Afhankelijk van de reactieomstandigheden kunnen een of meer van de waterstofatomen in de benzeenring worden uitgewisseld voor nitro, sulfonzuur, amine, hydroxyl, chloor, broom of andere groepen. Producten omvatten fenol, nitrobenzeen, chloorbenzeen, benzeensulfonzuur en vele anderen.
Andere belangrijke reacties van benzeen omvatten additie, zoals alkylering en hydrogenering. Deze reacties vinden over het algemeen plaats bij verhoogde temperatuur en druk, waarbij soms actieve katalysatoren nodig zijn.
Ethylbenzeen wordt bijvoorbeeld geproduceerd door de alkylering van benzeen met ethyleen in aanwezigheid van een aluminiumchloridekatalysator.
Cumeen is een ander belangrijk primair additieproduct van benzeen, geproduceerd door de dampfase katalytische alkylering van benzeen met propeen over fosforzuur of kiezelgoer katalysatoren bij 200–250 °C en 2,7–4,2 MPa overdruk.
Hydrogenering is ook een additiereactie. Een van de belangrijkste is de hydrogenering van benzeen om cyclohexaan te produceren.
De dehydrogenering van ethylbenzeen tot styreen is een belangrijke commerciële reactie. Deze endotherme reactie vereist een hoge temperatuur om kinetisch en thermodynamisch te verlopen.
Benzeen is een essentiële grondstof voor de productie van veel andere belangrijke chemicaliën, waaronder kunststoffen, harsen, detergenten en farmaceutische producten. De meeste reacties die in dit hoofdstuk worden besproken, zijn primaire reacties van benzeen. Talloze reacties en producten zijn afhankelijk van benzeen, direct of indirect, als hun bron.
3. Grondstoffen voor benzeen
Benzeen en zijn homologen, zoals tolueen en xylenen, worden in kleine hoeveelheden in ruwe olie aangetroffen, waardoor fysieke scheiding en winning onpraktisch zijn. Ruwe oliefracties uit Saoedi-Arabië en het Verenigd Koninkrijk hebben een laag benzeen-, tolueen- en xyleengehalte (BTX), maar een hoger nafteengehalte.
Zwaardere ruwe olie en synthetische ruwe olie uit teerzanden kunnen een hoger aromatisch gehalte hebben in de lichte naftafractie. Een analyse van de C5-150 °C naftafractie van een conventionele ruwe olie en een synthetische nafta afkomstig van Athabasca teerzanden toont aan dat de synthetische nafta een lager aromatisch en nafteengehalte heeft dan de conventionele ruwe oliefractie.
De hogere naftafractie van de synthetische ruwe olie heeft echter een aanzienlijk hoger aromatisch gehalte (32 versus 19%), hoewel het nafteengehalte lager is. Dit komt waarschijnlijk door dealkylering of ringopening van de aromaten met een hogere moleculaire massa in het bitumen.
- Bezoek de link voor een gedetailleerd artikel over de productie van benzeen →
4. Toepassingen van benzeen
Benzeen wordt gebruikt om ethylbenzeen, cumeen en cyclohexaan te produceren, die goed zijn voor 75-80% van het verbruik als chemische grondstof.
Ethylbenzeen wordt gedehydrogeneerd tot styreen, het monomeer voor belangrijke polymeren zoals acryl-butadieen-styreenharsen en styreen-butadieenrubber.
Cumeen wordt gebruikt om fenol en aceton te produceren. Fenol wordt voornamelijk gebruikt voor fenolharsen.
Cyclohexaan wordt gebruikt om adipinezuur te produceren, dat wordt gebruikt om nylons te maken.
Ongeveer 5% van de benzeen wordt genitreerd tot nitrobenzeen, dat vervolgens wordt gehydrogeneerd tot aniline.
Benzeen kan ook worden geoxideerd tot maleïnezuuranhydride, een voorloper van polyesterharsen.
Andere benzeenproducten zijn gehalogeneerde benzenen en lineaire alkylbenzenen, die worden gebruikt om detergenten te maken.
5. Toxicologie en beroepsgezondheid van benzeen
Benzeen is een giftige verbinding die acute en chronische effecten kan veroorzaken. Het wordt opgenomen door inademing, inname of huidabsorptie. Acute vergiftiging kan leiden tot hoofdpijn, verwardheid, verlies van spiercontrole en irritatie van de luchtwegen en het maag-darmkanaal. Hogere concentraties kunnen leiden tot bewusteloosheid of de dood. Chronische blootstelling kan leiden tot bloedarmoede en leukemie.
Inademing is de primaire bron van benzeenvergiftiging. Inname kan irritatie van de mond, slokdarm en maag veroorzaken. Huidabsorptie is geen significante bron van vergiftiging.
Verschillende onderzoeken hebben de toxiciteit van benzeen onderzocht. Het wordt selectief opgenomen door de longen en vastgehouden in verschillende lichaamsweefsels. Benzeen wordt langzaam gemetaboliseerd en vormt toxische tussenproducten. De individuele vatbaarheid voor vergiftiging varieert.
Blootstelling aan benzeen is in verband gebracht met leukemie, pancytopenie en aplastische anemie. Er is meer onderzoek nodig om het exacte causale verband te bepalen.
Emissies van benzeen komen van motorbenzine, koolstofverkoling van steenkool en historisch gezien van benzeenhoudende oplosmiddelen.
Voorkomen van benzeenvergiftiging omvat goede laboratorium- en fabriekspraktijken, het minimaliseren van concentraties in werkgebieden en het gebruiken van beschermende maatregelen.
Regelgevende instanties hebben blootstellingslimieten voor benzeen vastgesteld en het geclassificeerd als een potentieel kankerverwekkende stof.
Recente regelgeving is gericht op het verminderen van de emissie van vluchtige organische stoffen, waaronder benzeen, van aardolieraffinaderijen en chemische fabrieken.
Lopende studies en regelgevende inspanningen weerspiegelen de actieve betrokkenheid bij het begrijpen en beheersen van de toxiciteit van benzeen.
Voortgezet onderzoek en strenge maatregelen zijn nodig om de risico’s die gepaard gaan met blootstelling aan benzeen te beperken.
Referentie
- Benzene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_475
