Barnsteenzuur: eigenschappen, productie en toepassingen
Wat is barnsteenzuur?
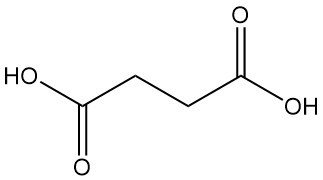
Barnsteenzuur, ook bekend als butaandizuur, is een dicarbonzuur met de chemische formule C4H6O4. Het is een kleurloze kristallijne vaste stof die wordt aangetroffen in barnsteen, in talloze planten (bijv. algen, korstmossen, rabarber en tomaten) en in veel lignieten.
Inhoudsopgave
1. Fysieke eigenschappen van barnsteenzuur
Barnsteenzuur is een kleurloze, kristallijne vaste stof met een zeer zure smaak. Het is oplosbaar in water; de oplosbaarheid neemt toe met de temperatuur; het is licht oplosbaar in ethanol, ether, aceton en glycerine; en het is onoplosbaar in benzeen, koolstofdisulfide en koolstoftetrachloride.
Een waterige oplossing van barnsteenzuur met een concentratie van 0,1 M heeft een pH van 2,7.
De fysieke eigenschappen van barnsteenzuur worden weergegeven in de volgende tabel.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [110-15-6] |
| Formule | HOOC-(CH2)2-COOH |
| Moleculaire massa | 118,08 g/mol |
| Smeltpunt | 188 °C |
| Kookpunt | 235 °C |
| Dichtheid | 1,57 g/cm3 |
| Breukindex | 1,450 |
| Decarboxylatietemperatuur | 290-310 °C |
| pKa1 bij 25 °C | 4,21 |
| pKa2 bij 25 °C | 5,64 |
| Warmte van Verbranding | -356,32 Kcal/mol |
| Vlampunt | 160 °C (open beker) |
2. Reacties van barnsteenzuur
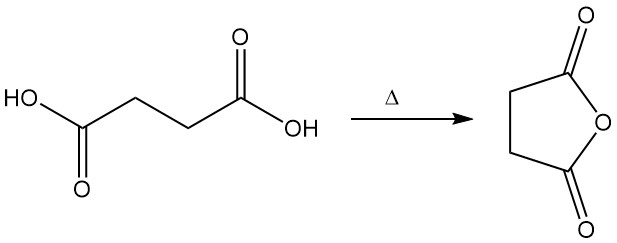
Barnsteenzuur, een dicarbonzuur, ondergaat een verscheidenheid aan reacties die kenmerkend zijn voor carbonzuren. Barnsteenzuur wordt bij verhitting omgezet in cyclisch anhydride.
Het kan zowel mono- als disalten vormen met basen. Bijvoorbeeld, reageren met natriumhydroxide kan natriumwaterstofsuccinaat of natriumsuccinaat opleveren.
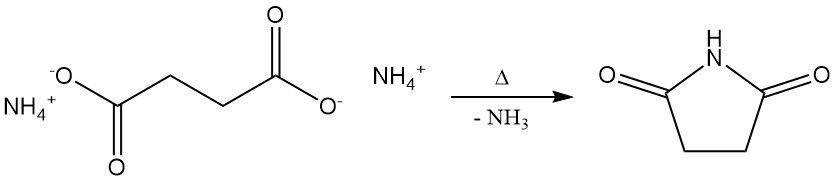
Wanneer het ammoniumzout van barnsteenzuur snel wordt gedestilleerd, wordt succinimide gevormd, met de afgifte van water en ammoniak.
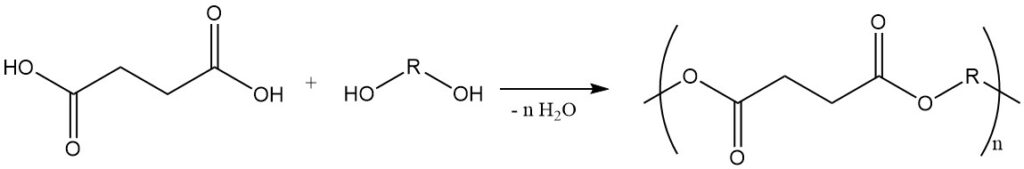
Barnsteenzuur reageert met dialcoholen om polyesters te vormen en met diamines om polyamiden te vormen. De reactie met monoalcoholen levert succinaatesters op. Al deze reacties zijn commercieel belangrijk.
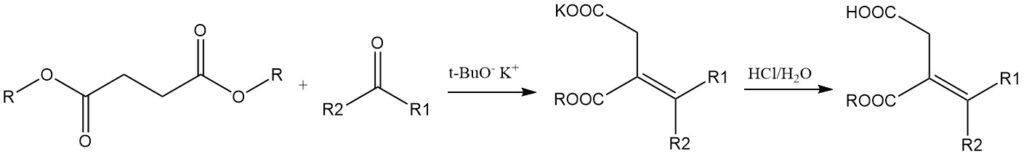
Barnsteenzuurester reageert met aldehyden of ketonen in aanwezigheid van natriumethoxide of kalium-tert-butoxide om alkylideenbarnsteenzuurmonoesters te vormen (Stobbe-condensatie), die vervolgens door hydrolyse, decarboxylering en hydrogenering kunnen worden omgezet in monocarbonzuren.
Barnsteenzuur kan worden gereduceerd tot 1,4-butaandiol met behulp van reductiemiddelen zoals lithiumaluminiumhydride.
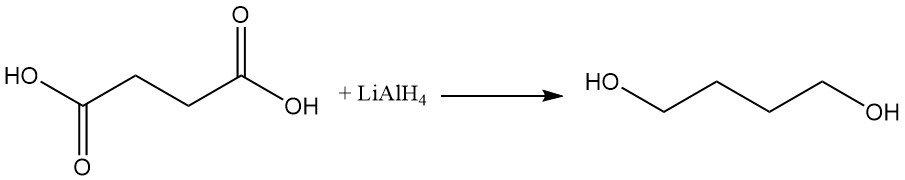
Door verhitting tot temperaturen boven 310 °C kan barnsteenzuur decarboxyleren tot propionzuur en koolstofdioxide.
3. Productie van barnsteenzuur
Barnsteenzuur wordt geproduceerd via diverse synthetische routes.
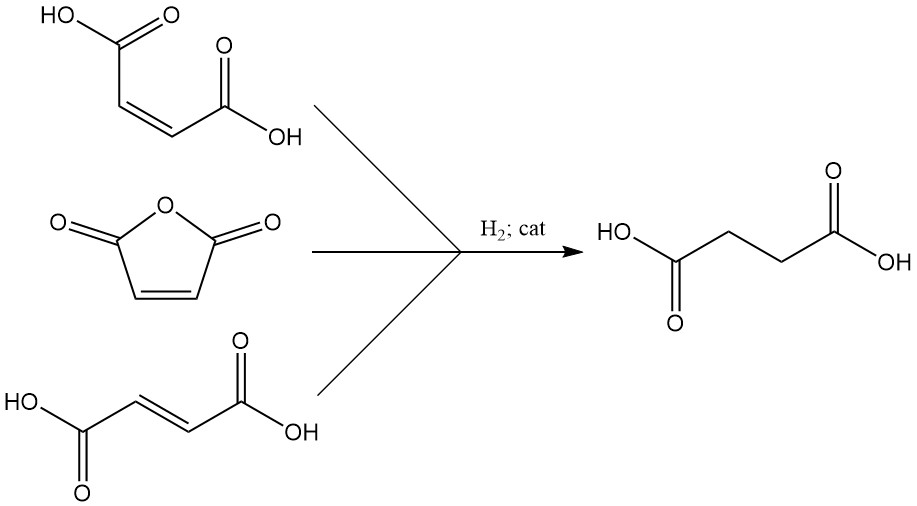
Hydrogenering van onverzadigde precursors zoals maleïnezuur, maleïnezuuranhydride of fumaarzuur levert barnsteenzuur op efficiënte wijze op. Katalysatoren voor dit proces omvatten doorgaans Raney-nikkel, koper, nikkeloxide, koper-zink-chroom, palladium-alumina, palladium-calciumcarbonaat of nikkel-diatomiet.
Als alternatief wordt barnsteenzuur geproduceerd door de oxidatie van 1,4-butaandiol. Oxidatiemiddelen omvatten zuurstof in een alkali-aardhydroxide-oplossing met palladiumkoolstofkatalysator bij 90–110 °C, ozon in waterig azijnzuur of stikstoftetroxide bij lage temperatuur.
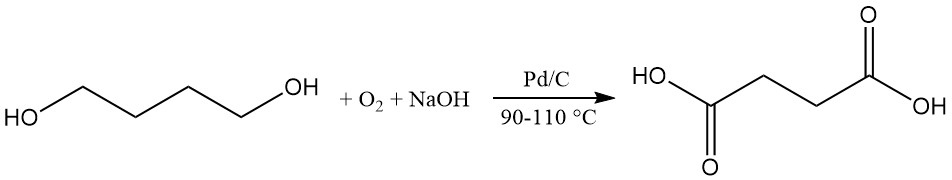
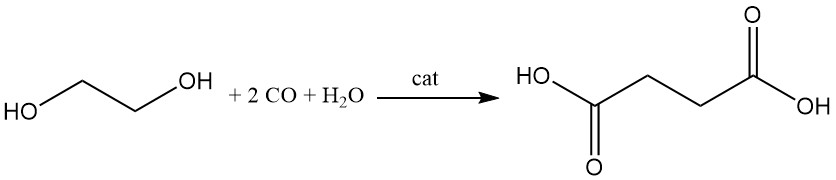
Reppe-carbonylering van ethyleenglycol, gekatalyseerd door rhodiumtrichloride-pentachloorthiofenol, of palladium-gekatalyseerde methoxycarbonylering van ethyleen produceert ook barnsteenzuur of zijn esters. Aanvullende carbonyleringsprocessen met behulp van acetyleen, acrylzuur, dioxaan of β-propiolacton produceren vergelijkbare resultaten.
Barnsteenzuur is een bijproduct in bepaalde oxidatieprocessen, zoals de productie van adipinezuur, oxidatie van enanthinezuur en ozonolyse van palmitinezuur.
Biogebaseerde productie van barnsteenzuur is ook haalbaar. BioAmber heeft een fermentatieproces op de markt gebracht met behulp van glucose uit hydrolyse van tarwezetmeel. Het bedrijf exploiteert een fabriek van 2000 ton per jaar in Frankrijk en plant er nog een in Canada.
Andere synthetische routes naar barnsteenzuur omvatten fase-overdracht-gekatalyseerde reacties van 2-haloacetaten, elektrolytische dimerisatie van broomazijnzuur of zijn ester, oxidatie van 3-cyanopropanal en fermentatie van n-alkanen.
4. Toepassingen van barnsteenzuur
Barnsteenzuur wordt gebruikt als grondstof bij de productie van alkydharsen, kleurstoffen, farmaceutische producten en pesticiden.
Het wordt ook gebruikt bij de synthese van polyesters door reactie met glycolen, en esters gevormd door reactie met monoalcoholen zijn belangrijke weekmakers en smeermiddelen.
Barnsteenzuur wordt gebruikt in de voedings- en drankenindustrie als zuurteregelaar en smaakversterker, en in farmaceutische producten als hulpstof en actief ingrediënt in sommige geneesmiddelen zoals metoprololsuccinaat, sumatriptansuccinaat en doxylaminesuccinaat.
5. Toxicologie van barnsteenzuur
Barnsteenzuur vertoont een lage acute toxiciteit. Het kan de huid, ogen en longen irriteren. Bij inslikken kan het schadelijk zijn. De acute orale toxiciteit bij ratten (LD50) was 2260 mg/kg
De orale LD50 wordt bepaald als >6740 mg/kg lichaamsgewicht, geëxtrapoleerd uit mononatriumsuccinaatgegevens. Dermale LD50 wordt verondersteld identiek te zijn aan orale LD50, wat overeenkomt met conservatieve schattingsmethoden.
Inhalatie LC50 wordt berekend als >1284 mg/m³ lucht op basis van fumaarzuur read-across en deeltjesgrootte overwegingen.
Fumaarzuur en barnsteenzuur delen structurele gelijkenis, beide zijn natuurlijk voorkomende citroenzuurcyclus intermediairen. Fysisch-chemische eigenschappen en toxiciteitsprofielen zijn vergelijkbaar. Derek-analyse, een toxiciteitsvoorspellingstool, onthult geen toxiciteitswaarschuwingen voor beide verbindingen.
Gezien de hoge LD50-waarden voor orale en dermale blootstelling en de geschatte LC50 die de maximaal haalbare concentratie overschrijdt, is geen classificatie gerechtvaardigd.
Referenties
- Dicarboxylic Acids, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_523.pub3
- https://pubchem.ncbi.nlm.nih.gov/compound/Succinic-Acid
- https://echa.europa.eu/registration-dossier/-/registered-dossier/15265/7/3/1
- https://www.flinnsci.com/sds_788-succinic-acid/sds_788/
