Antrachinon: eigenschappen, productie en toepassingen
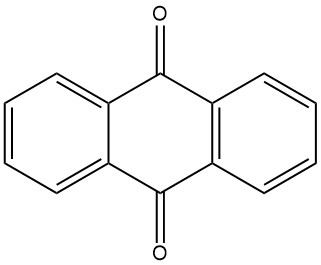
Wat is antrachinon?
Antrachinon is een organische verbinding met de formule C14H8O2. Het is een gele, kristallijne vaste stof die bij kamertemperatuur vrijwel onoplosbaar is in water en organische oplosmiddelen. De oplosbaarheid neemt toe met de temperatuur.
Antrachinon wordt gebruikt als voorloper bij de productie van een breed scala aan kleurstoffen, en als katalysator bij houtpulp.
Het werd voor het eerst gesynthetiseerd in 1835, maar de cruciale rol ervan in de kleurstoffenindustrie werd pas in 1868 gerealiseerd. Sindsdien is de antrachinonchemie snel uitgebreid, wat heeft geleid tot de ontwikkeling van nieuwe bijtende kleurstoffen, zure kleurstoffen, kuipkleurstoffen, disperse kleurstoffen en reactieve kleurstoffen.
De afgelopen decennia heeft de antrachinonindustrie een wereldwijde transformatie ondergaan. Er zijn nieuwe syntheseprocedures ontwikkeld om te voldoen aan de groeiende vraag naar antrachinon, en verwerkingsmethoden zijn geëvolueerd om efficiënter en milieuvriendelijker te worden.
Een van de meest baanbrekende toepassingen van antrachinon is het gebruik ervan als katalysator bij alkalische houtpulp. Deze tak van de antrachinonchemie ontwikkelt zich snel en heeft het potentieel om de vraag van de verfindustrie te overtreffen.
De vraag naar antrachinon is sinds 1870 gestaag toegenomen en de huidige jaarlijkse vraag overschrijdt 30.000 metrische tonnen.
Inhoudsopgave
1. Fysieke eigenschappen van antrachinon
De fysieke eigenschappen van antrachinon staan in de volgende tabel:
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | 84-65-1 |
| Chemische formule | C14H8O2 |
| Molaire massa | 208,20 g/mol |
| Uiterlijk | Kristallijn antrachinon is delicate, lichtgele tot lichtgele naalden. Wanneer het fijn verdeeld of neergeslagen wordt uit zwavelzuur, lijkt het bijna kleurloos. |
| Smeltpunt | 287 °C |
| Kookpunt | 377 °C |
| Kristalklasse | Monoklinisch |
| Ruimtegroep | P 21/a |
| Eenheidscelafmetingen |
|
| Kristaldichtheid |
|
| Dampspanning |
|
| Molaire warmtecapaciteit bij constante druk (cp) | 265 J mol-1 K-1 |
| Enthalpie van vorming | -179 kJ/mol |
| Enthalpie van verbranding | 6449 kJ/mol bij 25 °C |
| Smeltenthalpie | 32,57 kJ/mol bij 287 °C |
| Vlampunt | 185 °C |
| Oplosbaarheid |
|
| Anders |
|
2. Chemische reacties van antrachinon
2.1. Oxidatie
Antrachinon is stabiel tegen oxidatie onder normale omstandigheden, maar kan worden geoxideerd tot alizarine onder zware omstandigheden met natriumhydroxide en natriumchloraat.
Antrachinon kan worden geoxideerd tot polyhydroxyantrachinonen met geconcentreerd zwavelzuur en boorzuur, persulfaten of metaarseenzuur bij temperaturen boven 200 °C.
Oleum kan ook worden gebruikt om antrachinon te oxideren tot polyhydroxyantrachinonen bij lagere temperaturen, afhankelijk van het SO3-gehalte.
Geconcentreerd salpeterzuur oxideert antrachinon niet, maar nitreert het in plaats daarvan. Sommige mengsels van antrachinon en salpeterzuur kunnen explosief zijn.
2.2. Reductie
Antrachinon kan worden gereduceerd tot antrahydrochinon met gangbare reductiemiddelen of waterstof in aanwezigheid van een katalysator.
Natriumhyposulfiet in een alkalische oplossing reduceert antrachinon tot een bloedrood natriumzout van antrahydrochinon, dat zich in een zure oplossing kan herschikken tot zijn tautomeer oxantron.
Krachtigere reductiemethoden, zoals tin-zoutzuur of katalytische hydrogenering onder hoge druk of temperatuur, leveren anthron op, dat in evenwicht is met zijn tautomeer anthrol (9-hydroxyanthraceen) en vervolgens transformeert in antraceen en hydroantraceen.
Wanneer zink of natriumhydroxide wordt gebruikt, wordt dianthranol geproduceerd via dimerisatie.
Onder bepaalde reactieomstandigheden kan het reductieproces specifiek worden gericht op de twee buitenste kernen, wat leidt tot de vorming van 1,2,3,4-tetrahydroantrachinon of octahydroantrachinon.
2.3. Condensatie
Anthrachinon kan worden gecondenseerd met glycerol, ijzerpoeder en zwavelzuur om benzanthron te produceren.
2.4. Chlorering
Anthrachinon kan worden gechloreerd in oleum, voornamelijk op de alfapositie.
Het verwarmen van anthrachinon met antimoonpentachloride of vergelijkbare chloorafgevende reagentia levert gechloreerde producten op, variërend van monochloorantrachinon tot perchloorantrachinon.
2.5. Sulfonering en hydroxylering
Zwavelzuur of oleum kan antrachinon sulfoneren en/of hydroxyleren. Geconcentreerd zwavelzuur sulfoneert antrachinon voornamelijk boven 200 °C.
Oleum wordt doorgaans gebruikt om antrachinon te sulfoneren bij temperaturen tussen 140 °C en 160 °C, waarbij belangrijke reactieproducten worden verkregen, waaronder β-sulfonzuren zoals antrachinon-2-sulfonzuur, antrachinon-2,6-disulfonzuur en antrachinon-2,7-disulfonzuur.
In aanwezigheid van kwik vindt sulfonering voornamelijk plaats op de alfapositie, waarbij antrachinon-1-sulfonzuur, antrachinon-1,5-disulfonzuur en antrachinon-1,8-disulfonzuur worden geproduceerd.
2.6. Nitratie
Voor het nitreren van antrachinon zijn strenge omstandigheden nodig, wat voornamelijk resulteert in alfa-nitroantracinonen naast wisselende verhoudingen van bèta-nitro- en alfa,bèta-dinitroantracinonen.
Zowel mono- als dinitratieprocessen vinden plaats, wat vaak onzuivere nitratieproducten oplevert die uitgebreide verwerking vereisen voor scheiding in 1-nitroantracinon, 1,5-dinitroantracinon en 1,8-dinitroantracinon.
3. Industriële productie van antrachinon
Er worden verschillende processen gebruikt bij de industriële productie van antrachinon. De meest voorkomende methode is de dampfase-oxidatie van antraceen met behulp van lucht. Het naftaleenproces en de synthese van ftaalzuuranhydride en benzeen winnen echter ook aan populariteit vanwege de schaarste aan antraceen.
1. Oxidatie van antraceen
Antrachinon wordt traditioneel gesynthetiseerd uit antraceen, dat wordt verkregen uit steenkoolteer. Dit proces omvat de oxidatie van antraceen met chroomzuur in een oplossing van 48% zwavelzuur. Het chroom(III)sulfaatbijproduct moet worden verwerkt tot looimiddelen. Deze methode vereist antraceen met een hoge zuiverheid met een minimale zuiverheid van 94%.
2. Oxidatie van antraceen in de dampfase
Ongeveer 85% van de wereldwijde productie van antraceen is afhankelijk van de oxidatie van antraceen in de dampfase met behulp van lucht. De afnemende productie van antraceen heeft echter geleid tot een tekort aan aanbod, waardoor het naftaleenproces werd bevorderd. Naftaleen is gemakkelijk verkrijgbaar in steenkoolteer en kan ook worden gewonnen uit restoliën die worden verkregen bij het reformeren van benzine.
3. Naftaleenproces
Dit proces wordt in Japan door Kawasaki en in Europa door Bayer gebruikt. Het omvat een driestapssynthese van antrachinon:
- Naftochinon wordt bereid door oxidatie van naftaleen in de dampfase met lucht.
- Butadieen wordt geïntroduceerd in een Diels-Alder-reactie met het naftochinon.
- Het resulterende tetrahydroantracinon wordt onderworpen aan oxydehydrogenering.
Dit proces genereert ftaalzuuranhydride als bijproduct.
4. Synthese uit ftaalzuuranhydride en benzeen
In regio’s waar antraceen onvoldoende beschikbaar is uit steenkoolteer, kan antrachinon worden gesynthetiseerd uit ftaalzuuranhydride en benzeen. Dit proces omvat het gebruik van ongeveer 1,4 metrische ton aluminiumchloride en 4-6 metrische ton zwavelzuur per ton antrachinon.
Het heeft hernieuwd belang gekregen vanwege de schaarste aan antraceen. De beschikbaarheid van goedkoop ftaalzuuranhydride in voldoende hoeveelheden, bereikt door de economische oxidatie van naftaleen of o-xyleen met lucht, heeft bijgedragen aan de heropleving van deze syntheseroute.
5. Styreendimerisatieproces
Begin jaren 70 introduceerde BASF een ander intrigerend antrachinonproductieproces. Deze methode begint met de dimerisatie van styreen tot 1-methyl-3-fenylindaan, gefaciliteerd door een zure katalysator. Vervolgens wordt 1-methyl-3-fenylindaan in de dampfase omgezet in antrachinon door oxidatie met lucht.
3.1. Productie van antrachinon door oxidatie van antraceen met chroomzuur
De industriële productie van antrachinon door oxidatie van chroomzuur is een goed ingeburgerd en efficiënt proces. Het is relatief goedkoop en kan in batchbewerkingen worden uitgevoerd.
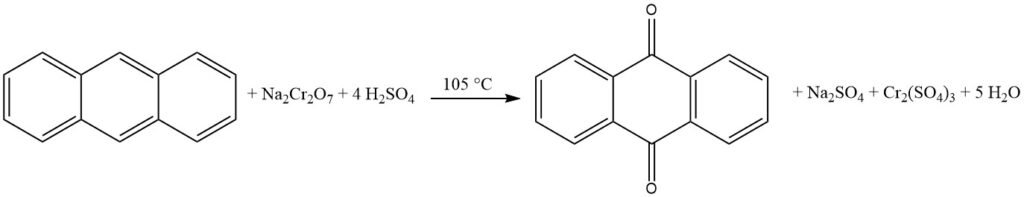
Het proces begint met de bereiding van een antraceenpasta door zuiver antraceen (94-95% zuiverheid) fijn te verpulveren en te mengen met water en een bevochtigingsmiddel in een mengvat. De antraceenpasta wordt vervolgens geoxideerd door afwisselend porties van 48% zwavelzuur en 20% natriumdichromaatoplossing toe te voegen. De reactie wordt gecontroleerd om overmatig schuimen en temperatuurstijging te voorkomen.
Nadat de oxidatie is voltooid, wordt het reactiemengsel gefilterd en wordt het gefilterde materiaal gewassen en gesuspendeerd in water. Het ruwe antrachinonproduct wordt vervolgens gefilterd en heeft een zuiverheid van ongeveer 95%. Het ruwe antrachinon kan verder worden verwerkt door drogen of herkristalliseren om een zuiverheidsniveau van maximaal 99% te bereiken.
Dit proces wordt vaak gecombineerd met de productie van looimiddelen, omdat het minimale kosten voor het oxidatiemiddel met zich meebrengt.
3.2. Productie van antrachinon door dampfase-oxidatie van antraceen met lucht
De dampfase-oxidatie van antraceen met lucht is een efficiënte en goed gecontroleerde methode voor de productie van antrachinon met een hoge zuiverheid.
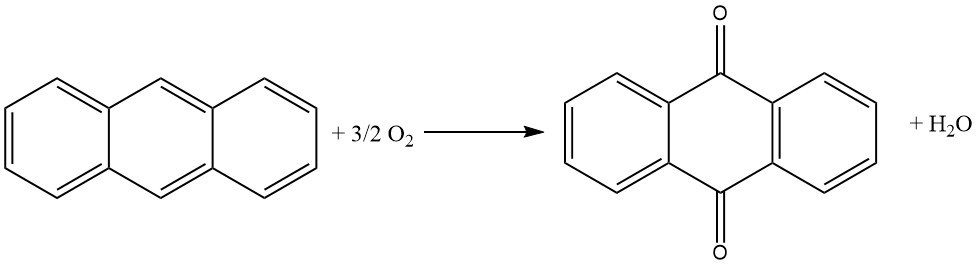
Het is gebaseerd op het gebruik van katalysatoren die vergelijkbaar zijn met die welke worden gebruikt bij de oxidatie van naftaleen of o-xyleen tot ftaalzuuranhydride. Het proces wordt gekenmerkt door een hoge conversie van antraceen, minimale vorming van bijproducten en een hoge productzuiverheid.
Het proces begint met de verdamping van antraceen met behulp van een voorverwarmd mengsel van lucht en waterdamp. De gasstroom wordt vervolgens zorgvuldig gemengd met extra lucht om het risico op explosie te voorkomen. Dit mengsel wordt vervolgens van onderaf naar een katalytische oven geleid, waar de temperatuur wordt geregeld.
De katalytische oven bestaat uit 1400 liter katalysatormateriaal dat in lagen is gerangschikt. Het onderste deel, waar de reactie plaatsvindt, wordt gekoeld tot 390 °C, terwijl het bovenste deel wordt verwarmd tot 339 °C. De katalysator is doorgaans ijzervanadaat, bereid uit ammoniumvanadaat en ijzer(III)chloride.
De gassen die de katalytische oven verlaten, worden onderworpen aan verschillende koel- en filterfasen om het antrachinonproduct van de bijproductgassen te scheiden.
De ijzervanadaatkatalysator die in dit proces wordt gebruikt, wordt bereid door rood ijzer(III)oxide op te lossen in zoutzuur en water. Deze oplossing wordt vervolgens gemengd met ammoniumvanadaat in water en neergeslagen. De resulterende oplossing wordt verdampt op puimsteen in een verwarmbare kogelmolen en vervolgens gecalcineerd. De resulterende katalysator moet een geelbruine kleur hebben.
Na verloop van tijd kan de activiteit van de katalysator afnemen, wat leidt tot een afname van de antrachinonopbrengst en een toename van de ftaalzuuranhydrideproductie. Om de activiteit van de katalysator te behouden of te reactiveren, kan een kleine hoeveelheid ammoniak aan de oxidatielucht worden toegevoegd of kan de uitgeputte katalysator worden gewassen met een verdunde alkali-oplossing.
Dit proces levert antrachinon op met een hoge zuiverheid van 99%.
3.3. Productie van antrachinon door het naftaleenproces
Het naftaleenproces, ontwikkeld door Kawasaki Kasei Chemicals, is een driestappenproces voor de productie van antrachinon uit naftaleen.
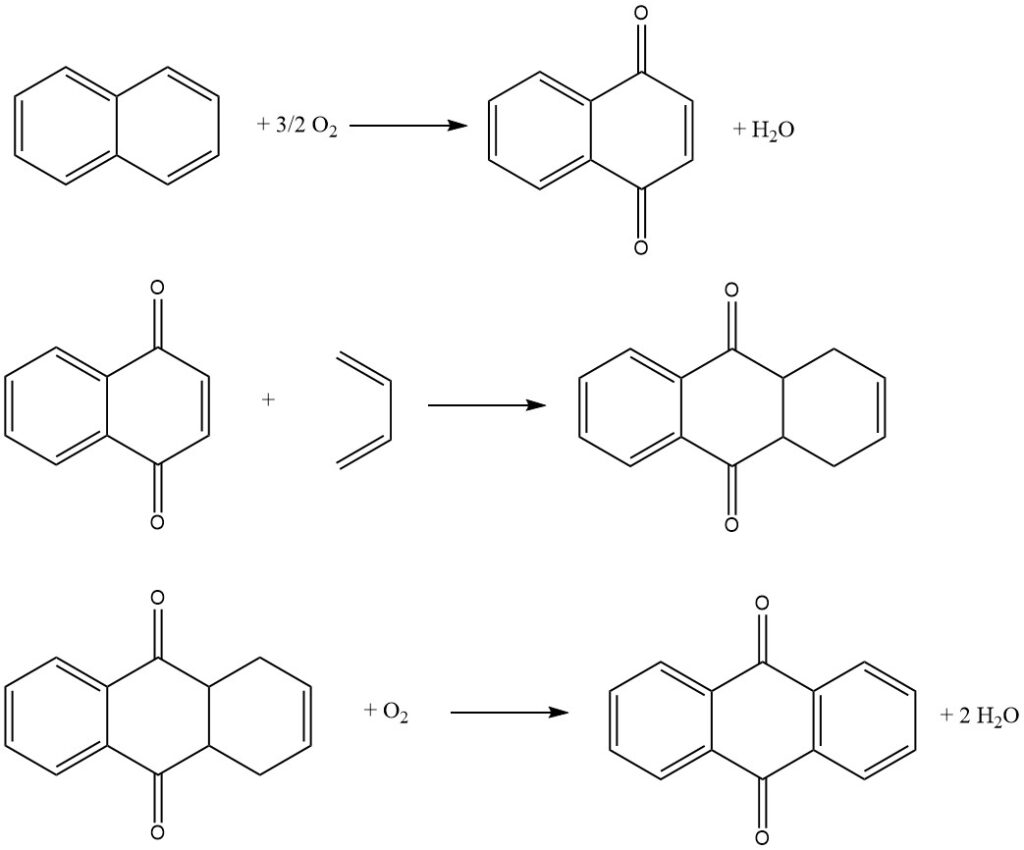
Stap 1: Oxidatie van naftaleen
In de eerste stap wordt naftaleen geoxideerd met lucht over een vanadiumpentoxidekatalysator om naftochinon en ftaalzuuranhydride te produceren. De reactie wordt uitgevoerd in de gasfase bij een hoge temperatuur.
Stap 2: Diels-Alder-reactie met butadieen
In de tweede stap wordt naftochinon omgezet met butadieen in een Diels-Alder-reactie om tetrahydroantrachinon te produceren. De reactie wordt uitgevoerd in een vloeibare fase met behulp van een organisch oplosmiddel zoals xyleen of tetrahydroantrachinon.
Stap 3: Oxydehydrogenering van tetrahydroantrachinon
In de derde stap wordt tetrahydroantrachinon geoxideerd met lucht om anthrachinon te produceren. De reactie wordt uitgevoerd in een waterige fase met behulp van een alkalikatalysator.
Het ftaalzuuranhydride dat in de eerste stap wordt geproduceerd, kan uit de waterige oplossing worden gewonnen door kristallisatie en filtratie.
Bayers variant van het naftaleenproces
Bayer’s variant van het naftaleenproces verschilt van het Kawasaki Kasei-proces op de volgende manieren:
- De naftaleenoxidatie wordt uitgevoerd met een mengsel van lucht en gerecycled reactiegas.
- De Diels-Alder-reactie met butadieen wordt uitgevoerd zonder de naftaleenoxidatieproducten te zuiveren.
- Het tetrahydroantrachinon wordt geoxydehydrogeneerd tot antrachinon in aanwezigheid van naftaleen.
- Het antrachinon en ftaalzuuranhydride worden gescheiden door fractionele destillatie.
3.4. Synthese van antrachinon uit ftaalzuuranhydride en benzeen
De synthese van antrachinon uit ftaalzuuranhydride en benzeen is een proces in twee stappen:
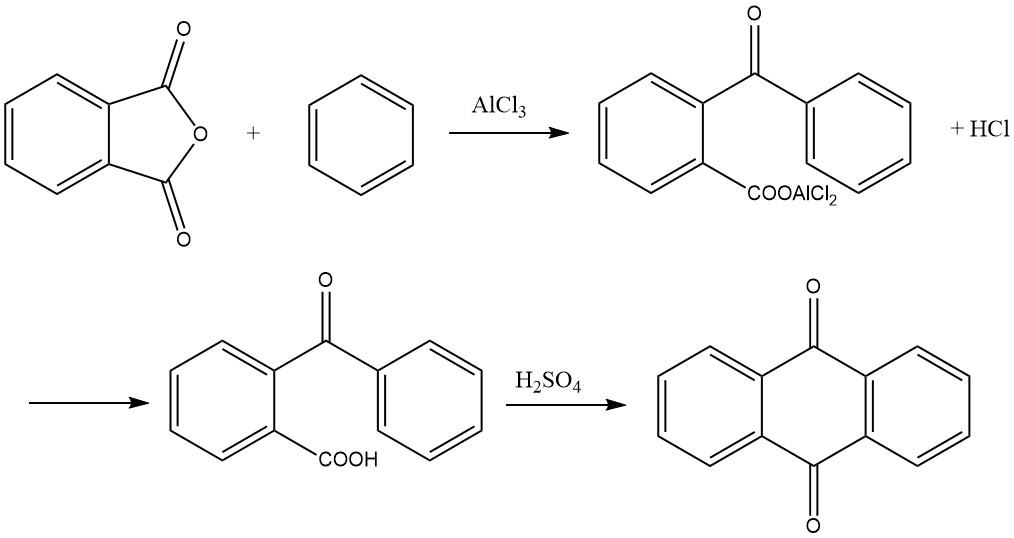
1. Vorming van o-benzoylbenzoëzuur
In de eerste stap wordt o-benzoylbenzoëzuur gevormd door een Friedel-Crafts-acylering met behulp van ftaalzuuranhydride en benzeen als uitgangsmaterialen. Deze reactie levert een aluminiumchloridecomplex van o-benzoylbenzoëzuur op als primair product, dat kan stollen in het reactievat.
Om dit probleem aan te pakken, zijn verschillende methoden voorgesteld, waaronder:
- De reactie uitvoeren met overtollig benzeen om opbrengsten van meer dan 95% te bereiken.
- De reactie uitvoeren in een oplosmiddelvrij proces in kogelmolens, met behulp van ethyleenglycol of 1,4-butaandiol om het stollingsprobleem te verminderen en de vereiste overmaat aan benzeen te verminderen.
De reactie verloopt doorgaans met een molaire verhouding van 1:1:2 voor ftaalzuuranhydride, benzeen en aluminiumchloride. Het vindt plaats bij temperaturen onder de 45 °C en genereert waterstofchloride als bijproduct. Er ontstaat tijdens de reactie veel schuimvorming, waardoor het volume meerdere malen toeneemt. Hier moet rekening mee worden gehouden bij het meten van de beginlading.
De reactie is voltooid wanneer er 1 mol waterstofchloride per mol ftaalzuuranhydride is ontstaan. Het resulterende reactieproduct wordt vervolgens in een verdunde zuuroplossing geplaatst, waarbij o-benzoylbenzoëzuur neerslaat. Dit neerslag wordt gescheiden, gewassen en gedroogd, wat meer dan 95% van het gewenste product oplevert.
2. Cyclisatie tot antrachinon
In de tweede stap kan o-benzoylbenzoëzuur verder worden omgezet in antrachinon. Hoewel het mogelijk is om te beginnen met het aluminiumchloridecomplex dat in de eerste stap is gevormd en 1 mol waterstofchloride te splitsen door verhitting tot 200 °C om antrachinon te verkrijgen, is de voorkeursmethode in de praktijk om het gedroogde o-benzoylbenzoëzuur te condenseren met zwavelzuur.
Het zuur wordt opgelost in ongeveer drie tot vier keer zijn gewicht in 95-98% zwavelzuur en verhit tot een temperatuur van 115 tot 140 °C. De duur van de verhitting is afhankelijk van factoren zoals de hoeveelheid en concentratie van het zwavelzuur en de temperatuur.
Zodra de reactie is voltooid, slaat antrachinon neer bij toevoeging van water en kan het vervolgens worden gefilterd en gedroogd. Als alternatief kan een deel van het product in grof gekristalliseerde vorm worden verkregen door de zwavelzuuroplossing direct te koelen. De opbrengst in deze stap is bijna kwantitatief.
De condensatieoplossing kan ook direct worden gebruikt voor de productie van benzanthron of antrachinonsulfonzuren.
3.5. Productie van antrachinon door middel van het styreenproces
Het styreenproces, ontwikkeld door BASF, is een meerstapsproces voor de productie van antrachinon uit styreen. Het is een efficiënte en veelzijdige methode die antrachinon met een hoge zuiverheid oplevert.
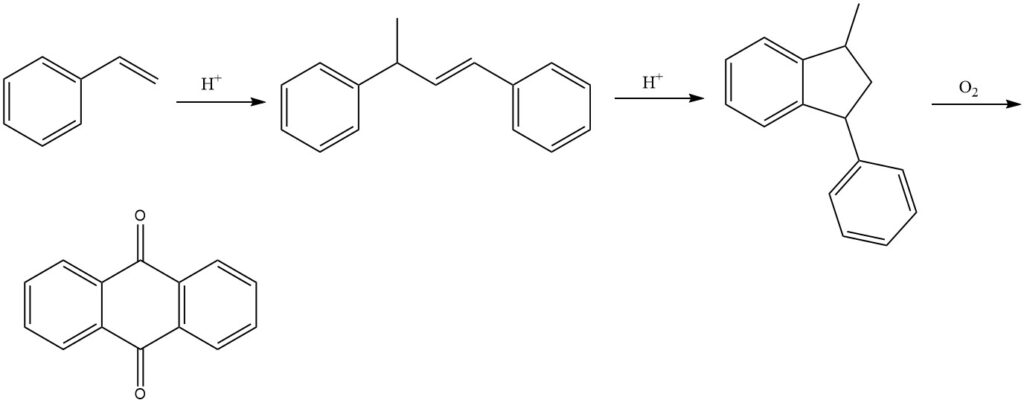
Het proces begint met de dimerisatie van styreen in aanwezigheid van zure katalysatoren om 1,3-difenyl-2-buteen te produceren. Dit wordt gevolgd door de cyclisatie van 1,3-difenyl-2-buteen om 1-methyl-3-fenylindaan te vormen. Ten slotte wordt 1-methyl-3-fenylindaan geoxideerd met lucht in de dampfase om antrachinon te produceren.
Verschillende katalysatoren kunnen worden gebruikt in de oxidatiestap, zoals vanadiumverbindingen (voornamelijk vanadiumpentoxide), vaak in combinatie met andere oxiden zoals thalliumoxide en antimoonoxide.
Het styreenproces resulteert in opbrengsten van ongeveer 77% voor het eindproduct. Het neergeslagen reactieproduct kan echter nog steeds bijproducten bevatten, waardoor verdere zuivering noodzakelijk is voor de uiteindelijke isolatie van zuiver antrachinon.
4. Toepassingen van antrachinon
Antrachinon is een veelzijdige en belangrijke chemische stof die wordt gebruikt bij de productie van een breed scala aan producten, waaronder kleurstoffen, kunststoffen, farmaceutische producten en papier.
Kleurstofproductie
Antrachinon wordt gebruikt om een breed scala aan kleurstoffen te produceren, waaronder zure kleurstoffen, basiskleurstoffen, kuipkleurstoffen, disperse kleurstoffen en reactieve kleurstoffen. Deze kleurstoffen worden gebruikt in verschillende industrieën, waaronder textiel, kunststoffen en drukwerk.
Kunststofproductie
Antrachinon wordt ook gebruikt bij de productie van kunststoffen, zoals polyethyleentereftalaat (PET) en polybutyleentereftalaat (PBT). Deze kunststoffen worden gebruikt in verschillende producten, waaronder voedselverpakkingen, drankflessen en elektrische componenten.
Farmaceutische productie
Antrachinon wordt ook gebruikt bij de productie van farmaceutische producten, zoals laxeermiddelen en ontstekingsremmende medicijnen.
Papierproductie
Antrachinon wordt in de papierindustrie gebruikt als redoxkatalysator om de alkalische hydrolyse van polymere lignine te vergemakkelijken. Dit leidt tot een hogere pulpopbrengst en een kortere kooktijd.
Andere toepassingen
Antrachinon wordt ook gebruikt in een verscheidenheid aan andere toepassingen, zoals de productie van denatureringsmiddelen voor zaadbescherming, de modificatie van standoliën en de verbetering van colofonie.
Recente trends
De laatste jaren is er een verschuiving geweest in de productie van antrachinonkleurstoffen van sulfonzuren naar nitroverbindingen vanwege milieuoverwegingen. Het sulfonzuurproces genereert grote hoeveelheden afvalwater, terwijl het nitroverbindingsproces efficiënter is en minder afval produceert.
5. Toxicologie van antrachinon
Antrachinon is een relatief niet-toxische chemische stof. Het wordt als biologisch inert beschouwd, wat betekent dat het inactief is in biologische systemen. Dit komt waarschijnlijk door de lage oplosbaarheid in zowel water als lipiden.
Er zijn geen toxicologische gegevens beschikbaar voor antrachinon, maar studies hebben aangetoond dat het minder irriterend is voor de ogen dan benzochinon en een vergelijkbaar niveau van inertheid heeft als inert stof.
Een MAK-waarde van 10 mg/m³ is aanbevolen voor antrachinon in beroepsmatige omgevingen. Dit betekent dat antrachinonstof als een laag gezondheidsrisico wordt beschouwd.
Referentie
- Anthraquinone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_347
