Solfato di ammonio: proprietà, produzione e usi
Cos’è il solfato di ammonio?
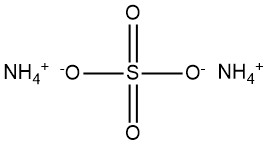
Il solfato di ammonio è un composto chimico con formula (NH4)2SO4. Si presenta comunemente come una polvere bianca cristallina o una sostanza granulare. È emerso come un composto significativo durante il XIX secolo, prodotto dall’ammoniaca presente nel gas di cokeria.
All’inizio del XX secolo, la sintesi industriale dell’ammoniaca ha acquisito importanza, portando all’adozione del solfato di ammonio come agente fertilizzante.
Nel tempo, tuttavia, la sua importanza è diminuita a causa dell’avvento di fertilizzanti a base di azoto più potenti. In particolare, la sua applicazione è persistita su scala minore per applicazioni industriali specifiche.
Dal 1960 circa, il solfato di ammonio ha registrato una produzione crescente come coprodotto nelle procedure di sintesi organica. In alcune regioni, il solfato di ammonio è prodotto dal gesso.
Sommario
1. Proprietà del solfato di ammonio
Il solfato di ammonio, con una massa molare di 132,14 g/mol, mostra una densità di 1,77 g/cm³ a 20 °C, insieme a una capacità termica specifica media di 1,423 J/g·K nell’intervallo di temperatura da 2 a 55 °C.
La sua struttura cristallina è bipiramidale rombica. È degno di nota che le dimensioni e la forma dei cristalli possono essere influenzate dalle sostanze presenti nella soluzione cristallizzante e questo aspetto è significativo nella produzione commerciale.
Il comportamento termico del solfato di ammonio è intricato. A pressione atmosferica, non può essere fuso senza subire decomposizione, portando al rilascio di ammoniaca e alla formazione di bisolfato.
Tuttavia, nel caso del solfato di ammonio anidro puro, la pressione di vapore dell’ammoniaca rimane praticamente zero fino al raggiungimento di 80 °C. Superati i 300 °C, la decomposizione determina la generazione di N2, SO2, SO3 e H2O, a parte l’ammoniaca.
Il solfato di ammonio non forma idrati. La variazione di calore quando si scioglie 1 mole di sale in 400 moli di acqua è di +9,92 kJ a 18 °C, mentre il calore integrale della soluzione è di +6,57 kJ/mol a 30 °C. Il calore differenziale della soluzione per una soluzione satura è di +6,07 kJ/mol a 30 °C.
Il solfato di ammonio mostra deliquescenza solo al di sopra dell’80% di umidità relativa, consentendone lo stoccaggio in aria secca e l’aggiunta di ammoniaca ne riduce significativamente la solubilità.
A 10 °C, la solubilità diminuisce da 73 g (NH4)2SO4 in 100 g di acqua a circa 18 g di sale in 100 g di una soluzione acquosa di ammoniaca al 24,5%.
La solubilità del solfato di calcio in una soluzione di solfato di ammonio è circa il doppio rispetto alla sua solubilità in acqua. Questa proprietà supporta la reazione di gesso o anidrite con soluzioni contenenti carbonato di ammonio – solfato di ammonio.
Il composto rimane insolubile nei tipici solventi organici. La dissoluzione del solfato di ammonio in etanolo, propanolo, butanolo, acetone, piridina e solventi simili determina la formazione di due fasi distinte: una fase acquosa e una fase di solvente organico.
Le soluzioni di solfato di ammonio e le sue soluzioni in acido solforico non corrodono l’acciaio inossidabile speciale Cr-Ni. Il ferro e l’alluminio rimangono non reattivi nelle soluzioni ammoniacali. Nei casi in cui le soluzioni contengano sostanze corrosive per l’acciaio inossidabile (ad esempio, Cl–), i recipienti possono essere protetti rivestendoli con mattoni resistenti agli acidi.
2. Produzione di solfato di ammonio
Il solfato di ammonio viene prodotto industrialmente da:
- Gas di cokeria
- Ammoniaca e acido solforico
- Sintesi organiche, come la produzione di caprolattame
- Gesso, ammoniaca e anidride carbonica
2.1. Produzione di solfato di ammonio dal gas di cokeria
L’utilizzo di gas di cokeria come precursore per la produzione di solfato di ammonio ha subito un calo sostanziale negli ultimi decenni. Questa tendenza può essere attribuita alla chiusura parziale delle acciaierie e ai progressi nei metodi di coking che producono quantità ridotte di solfato di ammonio.
Nel metodo diretto, il gas di cokeria non trattato viene introdotto nell’acido solforico, con conseguente solfato di ammonio contaminato da derivati del catrame pigmentati.
In alternativa, il processo indiretto prevede l’estrazione di ammoniaca dal gas di cokeria mediante lavaggio con acqua, seguito dalla liberazione mediante una sospensione di calce e dalla sua combinazione con acido solforico.
2.2. Produzione di solfato di ammonio da ammoniaca e acido solforico
Il calore generato dalla reazione tra ammoniaca e acido solforico può vaporizzare efficacemente l’acqua se la concentrazione dell’acido supera il 70%. La reazione è rappresentata come segue:
2 NH3(g) + H2SO4(l) → (NH4)2SO4(s) ΔH = -274 kJ/mol
Nella pratica contemporanea, la reazione avviene all’interno di saturatori, dispositivi derivati da cristallizzatori per evaporazione utilizzati in precedenza. Il processo di saturazione integra neutralizzazione e cristallizzazione all’interno di un singolo apparato.
L’acido solforico viene introdotto sul lato di aspirazione, mentre l’ammoniaca viene aggiunta sul lato di pressione di una pompa a circolazione forzata. La soluzione metastabile risultante produce particelle di dimensioni comprese tra 0,5 e 3 mm al momento della cristallizzazione.
I processi di scarico continuo, centrifugazione, essiccazione e raffreddamento facilitano l’isolamento del solfato di ammonio. Per facilitare la crescita dei cristalli, vengono aggiunte piccole quantità di acido fosforico, urea o sali inorganici.
2.3. Solfato di ammonio come coprodotto nelle sintesi organiche
Il solfato di ammonio emerge come sottoprodotto durante la sintesi di intermedi di fibre sintetiche, come caprolattame, acrilonitrile e metilmetacrilato, insieme alla produzione di acido formico e acrilammide.
La fonte importante è la produzione di caprolattame, vitale per la sintesi del nylon 6. I tradizionali processi di caprolattame producono 2,5 – 4,5 tonnellate di solfato di ammonio per tonnellata di lattame. Processi recenti sviluppati da varie entità sono riusciti a ridurre questo intervallo a 1,7-1,8 tonnellate per tonnellata di lattame.
2.4. Produzione di solfato di ammonio dal gesso
Sia l’anidrite che il gesso reagiscono con NH3 e CO2:
CaSO4·2 H2O + (NH4)2CO3 → (NH4)2SO4 + CaCO3·2 H2O
Questo processo, stabilito dalla BASF durante la prima guerra mondiale, rimane significativo nelle regioni con accesso limitato all’acido solforico, tra cui India, Pakistan e Turchia. Il gesso finemente macinato viene esposto a una soluzione di carbonato di ammonio in una cascata di recipienti agitati.
La miscela di reazione, composta da carbonato di calcio e soluzione di solfato di ammonio, viene filtrata utilizzando filtri rotanti sotto vuoto. Il carbonato di calcio lavato risultante viene utilizzato per fertilizzare la calce, la produzione di nitrato di calcio e ammonio, materia prima per il vetro o riempitivo per gomma o PVC.
La soluzione di solfato di ammonio leggermente torbida viene sottoposta a filtrazione utilizzando filtri pressa, seguita da acidificazione con H2SO4 e lavorazione tramite cristallizzatori a evaporazione multistadio per produrre solfato di ammonio a grana grossa.
Una tecnica alternativa, il Continental Engineering Process, introduce direttamente NH3 e CO2 in una poltiglia di gesso all’interno di un recipiente alto e cilindrico agitato.
2.5. Produzione di solfato di ammonio con altri processi
Diversi metodi che utilizzano SO2 e ossigeno atmosferico sono diventati obsoleti.
C’è un crescente interesse nei processi che utilizzano ammoniaca per eliminare SO2 dai gas di scarico delle centrali elettriche, come ad esempio il processo Walther che utilizza un lavaggio in due fasi dei gas di scarico privi di polvere per generare una soluzione concentrata di solfito di ammonio. Questa soluzione viene successivamente ossidata con ossigeno atmosferico e nebulizzata in polvere di solfato di ammonio, che viene poi granulata.
3. Usi del solfato di ammonio
L’applicazione predominante del solfato di ammonio è come fertilizzante, con un utilizzo industriale minimo. Nelle nazioni industrializzate, il solfato di ammonio si presenta in genere come coprodotto o sottoprodotto e viene venduto principalmente come fertilizzante, soprattutto nelle regioni in via di sviluppo.
Il suo limitato contenuto di azoto nelle nazioni industrializzate contribuisce a costi di trasporto più elevati per unità di azoto rispetto ad altri fertilizzanti a base di azoto.
In Africa e Asia, il solfato di ammonio ha una funzione importante nella fertilizzazione di riso, tè e colture di gomma. Tuttavia, in regioni come Europa, Stati Uniti e Brasile, costituisce spesso un costituente di fertilizzanti miscelati e complessi.
Nell’industria, (NH4)2SO4 viene utilizzato per la sintesi di persolfati, agenti ignifughi e polveri estinguenti.
Dimostra utilità nei processi di concia, così come in settori quali fotografia, tessili e produzione di vetro. Inoltre, il solfato di ammonio funge da fonte di nutrienti per colture di lieviti e batteri.
Riferimenti
- Composti di ammonio; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_243
- Chimica inorganica industriale. – https://www.sciencedirect.com/science/article/abs/pii/B9780128498910000035
