Metodi di produzione degli alcoli alifatici
A livello industriale, diversi alcoli vitali hanno un’importanza significativa. Tra questi, metanolo, etanolo, 1-propanolo, 1-butanolo e 2-metil-1-propanolo (noto anche come alcol isobutilico).
Inoltre, gli alcoli plastificanti (da C6 a C11) e gli alcoli grassi (C12–C18) sono ampiamente utilizzati nella produzione di detergenti. Questi alcoli sono ottenuti principalmente tramite diversi processi: gas di sintesi (metanolo), sintesi oxo di olefine o processo Ziegler.
Oltre alle applicazioni menzionate, gli alcoli servono come solventi e diluenti efficaci per vernici, utilizzando principalmente alcoli C1–C6. Agiscono anche come intermedi essenziali nella produzione di esteri e vari composti organici. Gli alcoli trovano applicazioni come agenti di flottazione, lubrificanti e additivi per carburanti, tra cui metanolo, etanolo e alcol terz-butilico.
Per le applicazioni industriali, le miscele isomeriche sono spesso preferite per considerazioni di costo poiché gli alcoli puri possono essere costosi. Inoltre, le miscele con diversi numeri di atomi di carbonio possono offrire vantaggi per scopi specifici. Di conseguenza, la disponibilità sul mercato delle miscele di alcoli è paragonabile a quella degli alcoli singoli puri.
Sommario
Introduzione
La produzione di alcoli alifatici avviene tramite vari processi industriali, alcuni dei quali sono elencati di seguito:
- Sintesi da monossido di carbonio e idrogeno (C1)
- Oxo sintesi, spesso accompagnata da idrogenazione delle aldeidi inizialmente formate (C3 – C20)
- Idrogenazione di aldeidi, acidi carbossilici o esteri
- Condensazione aldolica di aldeidi inferiori seguita da idrogenazione degli alchenali (C3 → C6, C4 → C8, C8 → C16)
- Ossidazione di composti di trialchilalluminio (processo Ziegler)
- Ossidazione di idrocarburi saturi
- Idratazione di olefine (C2–C4)
- Omologazione degli alcoli
- Idrocarbonilazione mediante il processo Reppe
- Idrocarbossimetilazione
- Processi di fermentazione (C2–C5)
- Processo Guerbet
Tra questi processi, la sintesi di metanolo ed etanolo è di fondamentale importanza, con produzioni annuali di circa 49 × 106 t e 99 × 106 t, rispettivamente. La sintesi oxo ha anche una notevole rilevanza industriale, rappresentando circa 6,3 × 106 t di produzione annuale.
Inoltre, l’idratazione di etilene e propene per produrre etanolo e 2-propanolo, così come l’ossidazione di composti di trialchilalluminio (processo Alfol o processo Ziegler), hanno acquisito una notevole importanza commerciale.
Inoltre, i processi di fermentazione, in particolare per la produzione di etanolo, hanno riacquistato importanza in regioni specifiche a causa dell’aumento dei prezzi del petrolio.
1. Sintesi da monossido di carbonio e idrogeno
Solo il metanolo viene prodotto commercialmente dal gas di sintesi. In passato, venivano utilizzati processi come Synol, isobutilolo e oxyl, che portavano a miscele di composti contenenti ossigeno con alcoli come componenti principali. Tuttavia, questi metodi non sono più utilizzati nel mondo occidentale. Sviluppi più recenti generano composti contenenti ossigeno o miscele di alcol.
Uno di questi processi è il metodo IFP (Inst. Français du Pétrole) per gli alcoli superiori. Utilizza catalizzatori altamente attivati in condizioni di sintesi del metanolo a bassa pressione. Il catalizzatore è costituito da ossidi misti di rame e cobalto, combinati con almeno un altro metallo (Al, Ce, Cr, Fe, La, Mn, Pr, Nd, Y o Zn), nonché almeno un composto metallico del gruppo I o II.
Regolando la composizione del catalizzatore, il contenuto di alcol più elevato nel prodotto può variare tra il 20 e il 50% in peso. Tuttavia, questo processo determina la formazione di diversi sottoprodotti, come idrocarburi, esteri e chetoni.
Nonostante questi progressi, nessuno dei nuovi processi sopra menzionati è attualmente impiegato nel settore. Tuttavia, piccole quantità di alcoli superiori vengono prodotte come sottoprodotti nella sintesi Fischer-Tropsch.
2. Sintesi oxo
La sintesi oxo è un metodo utilizzato per preparare alcoli nell’intervallo C3–C20. In questo processo, le olefine (idrocarburi insaturi) reagiscono con il gas di sintesi (una miscela di monossido di carbonio e idrogeno) per formare aldeidi. Successivamente, queste aldeidi vengono idrogenate per produrre gli alcoli desiderati.
Una versione specifica della sintesi oxo è nota come processo Shell, che impiega il catalizzatore HCo(CO)3PR3, che mostra una forte attività idrogenante. Questo catalizzatore facilita l’idrogenazione diretta dell’aldeide inizialmente formata all’interno del reattore oxo.

Il processo Shell è stato applicato per la prima volta commercialmente usando il propene nel 1963 per la produzione di 1-butanolo e 2-etilesanolo. Successivamente, nel 1965, è stato ulteriormente sviluppato per produrre alcoli detergenti. La sua applicazione principale è nella produzione di alcoli superiori.
Un vantaggio significativo del processo Shell è la sua capacità di idroformilare olefine con doppi legami interni. Le condizioni di reazione promuovono l’isomerizzazione del doppio legame, portando alla formazione di α-olefine.
Ad esempio, le frazioni di ω-olefine ottenute dall’etilene tramite il “processo SHOP” di Shell possono essere convertite in alcoli usando gas di sintesi. Le miscele di alcoli risultanti sono costituite fino all’80% da composti lineari e trovano impiego nelle industrie dei plastificanti e dei detergenti.
3. Idrogenazione di aldeidi, acidi carbossilici ed esteri
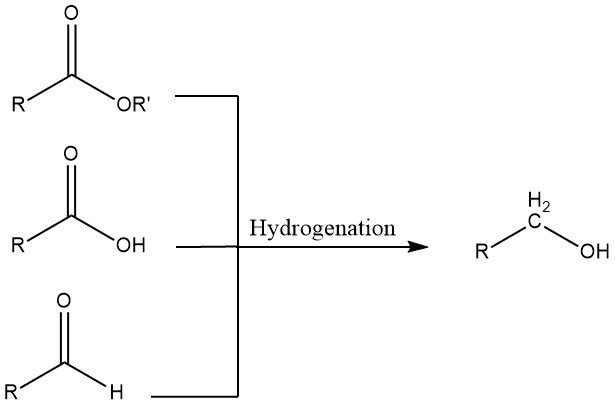
Le aldeidi possono essere sottoposte a idrogenazione utilizzando catalizzatori omogenei o eterogenei. I sistemi omogenei sono vantaggiosi quando i materiali di partenza contengono zolfo, che avvelenerebbe i catalizzatori eterogenei, o quando l’idrogeno utilizzato per l’idrogenazione contiene monossido di carbonio.
Tuttavia, nella maggior parte dei casi, sono preferiti i catalizzatori eterogenei. Questi catalizzatori sono efficaci sia nelle reazioni in fase gassosa a temperature di 90-180 °C e pressioni di 25 bar, sia nelle reazioni in fase liquida a 80-220 °C e pressioni fino a 300 bar. La temperatura di idrogenazione utilizzata nei processi industriali è scelta come compromesso tra un utilizzo ottimale dell’energia e una lunga durata del catalizzatore.
Per i processi continui, sono preferiti i sistemi a letto fisso con catalizzatori. L’aldeide, sia in forma di vapore diluita con idrogeno in eccesso, sia in forma liquida con idrogeno, viene fatta passare attraverso il tubo ad alta pressione contenente il letto del catalizzatore.
Per dissipare il calore generato dalla reazione, l’idrogeno viene fatto circolare attraverso uno scambiatore di calore. L’idrogenazione del 2-etil-2-esenale, una reazione particolarmente importante, viene in genere eseguita in un unico passaggio utilizzando un catalizzatore contenente nichel.
Sono stati proposti processi simili in un unico passaggio. Tuttavia, sono comuni anche processi in due passaggi, in cui l’idrogenazione primaria avviene nella fase gassosa (ad esempio, utilizzando catalizzatori contenenti rame) e l’idrogenazione secondaria avviene nella fase liquida o nel processo a letto gocciolante (ad esempio, con catalizzatori contenenti nichel).
Questi catalizzatori sono in genere supportati su ossido di alluminio o gel di silice. Oltre a nichel e rame, sono stati sviluppati catalizzatori di successo utilizzando zinco, cromo e combinazioni di questi metalli.
Per la produzione di alcoli grassi, i corrispondenti esteri di acidi carbossilici vengono idrogenati. Grassi e oli naturali servono come materiali di partenza, che vengono inizialmente transesterificati per formare esteri metilici e poi ridotti ad alcoli, utilizzando sodio (riduzione di Bouveault-Blanc) o idrogenazione catalitica.
La riduzione di sodio consente la preparazione di alcoli grassi insaturi dagli esteri di acidi grassi insaturi.
L’idrogenazione di acidi grassi ed esteri di acidi grassi richiede condizioni più severe rispetto all’idrogenazione di aldeidi. Il processo può essere condotto in modo continuo o discontinuo utilizzando catalizzatori di ossido di rame-cromo (catalizzatori Adkins), sia in sospensione che a letto fisso.
Temperature di reazione di 240–300 °C e pressioni di 200–300 bar sono tipiche. Modificando i catalizzatori (ad esempio, aggiungendo cadmio), gli esteri di acidi grassi insaturi possono essere convertiti direttamente in alcoli grassi insaturi.
4. Condensazione aldolica di aldeidi inferiori e idrogenazione degli alchenali
Nei processi industriali, la sintesi oxo è l’unica fonte di aldeidi utilizzata per la condensazione aldolica.
Dopo la rimozione di isoaldeidi e sottoprodotti, la reazione di condensazione è catalizzata da acidi o basi. La reattività di ogni aldeide è influenzata dalla lunghezza della sua catena e dal grado di ramificazione, richiedendo condizioni di reazione specifiche su misura per ogni singolo composto.
Gli aldoli formati nella condensazione subiscono disidratazione, con conseguente formazione di alchenali. Questi alchenali vengono successivamente idrogenati utilizzando catalizzatori eterogenei. In genere, per questo processo vengono utilizzati gli stessi catalizzatori impiegati per l’idrogenazione delle oxo aldeidi.
Attraverso questo metodo, è possibile preparare 2-etilesanolo, 2-metilpentanolo e quantità limitate di alcoli isomerici C16 e C18 altamente ramificati.
Tuttavia, il processo aldox, che prevede di sottoporre la miscela di aldeidi formata nella sintesi oxo alla condensazione aldolica all’interno del reattore oxo, non ha ottenuto un’ampia accettazione a causa della presenza di aldoli misti nei prodotti finali. Tuttavia, alcuni aldoli misti, come quelli di acetaldeide con aldeidi superiori, hanno importanza in applicazioni specifiche.
5. Ossidazione di composti di trialchilalluminio
L’etilene ha la capacità di subire l’addizione con trietilalluminio, con conseguente miscela di composti di trialchilalluminio con massa molecolare più elevata. Questi prodotti possono essere sottoposti a ossidazione con aria, portando alla formazione dei corrispondenti alcossidi di alluminio.
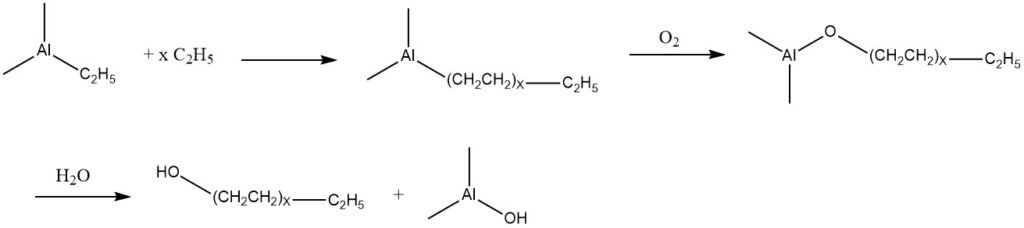
Successivamente, questi alcossidi subiscono idrolisi, producendo una miscela di alcoli primari lineari che possiedono lo stesso numero di atomi di carbonio dei gruppi alchilici presenti nei componenti trialchilalluminio.
Sulla base di questa reazione, nota come processo Ziegler, sono stati sviluppati due processi commerciali. Uno è di Conoco, che è operativo negli Stati Uniti dal 1962 e in Germania da Condea Chemie (Conoco e Deutsche Texaco) dal 1964.
L’altro è di Ethyl Corp., che è operativo dal 1965. Le principali differenze tra i due processi risiedono nella distribuzione della lunghezza della catena e nella linearità degli alcoli risultanti, nonché nelle caratteristiche tecniche coinvolte nella generazione e nel controllo di questa distribuzione.
Nel processo alcolico Alfol (processo Conoco), la reazione di crescita della catena viene condotta alla temperatura più bassa possibile per evitare reazioni di spostamento che potrebbero portare alla formazione di olefine. Gli alcoli risultanti mostrano una distribuzione della lunghezza della catena che ricorda una curva di Poisson e sono praticamente lineari al 100%.
Il processo di alcol Alfol produce in genere un’ampia gamma di alcoli (C2–C28) e, sebbene si possano apportare modifiche per aumentare o diminuire le lunghezze della catena degli alcoli prodotti, il modello di distribuzione rimane coerente.
D’altro canto, la Ethyl Corp. ha sviluppato con successo un processo con crescita controllata della catena lineare, che produce prevalentemente alcoli C12 e C14. Questi alcoli hanno una struttura lineare fino al 95%.
6. Ossidazione di idrocarburi saturi
L’ossidazione di Bashkirov comporta l’ossidazione di idrocarburi alifatici con aria in presenza di acido borico, con conseguenti elevate rese di esteri dell’acido borico.
Questi esteri vengono quindi idrolizzati in una fase successiva, producendo alcoli secondari in cui i gruppi idrossilici sono distribuiti statisticamente lungo la catena molecolare. La reazione procede tramite un idroperossido secondario intermedio.
L’ossidazione viene in genere eseguita in fase liquida a temperature comprese tra 150 e 170 °C, con la presenza del 4-5% in peso di acido metaborico. Una miscela di azoto e ossigeno (circa il 3,5% di O2) viene utilizzata a pressione normale o leggermente elevata.
Alcuni impianti più recenti incorporano ammine come co-catalizzatori. Per ottenere selettività economicamente accettabili dell’80-85%, il livello di conversione viene mantenuto al di sotto del 20%.
L’evaporazione flash viene utilizzata per rimuovere i materiali di partenza e i sottoprodotti dell’ossidazione, seguita dalla pulizia in scrubber alcalini e ad acqua, con n-idrocarburi riciclati.
Gli esteri dell’acido metaborico o le boroxine ottenuti sono resistenti all’ossidazione e termicamente stabili. Dopo la distillazione frazionata, si ottengono alcoli con una purezza superiore al 98%.
Il processo si conclude con “idrofinitura” (idrogenazione su catalizzatori di nichel eterogenei) per eliminare sostanze colorate e odorose.
L’acido ortoborico nella soluzione acquosa viene convertito in acido metaborico tramite disidratazione e il recupero può essere ottenuto anche tramite cristallizzazione.
In alcune recenti varianti del processo, il concentrato di acido borico viene miscelato con gli n-idrocarburi e la miscela viene disidratata per evitare agglomerazioni e arresti. La poltiglia essiccata viene quindi riportata al reattore di ossidazione.
Bashkirov sviluppò originariamente il lavoro tedesco in un processo commerciale negli anni ’50. Il primo impianto iniziò la produzione a Shebekino/Belgorod, URSS, nel 1959. Impianti erano operativi anche in Unione Sovietica e Giappone. Tuttavia, l’impianto Union Carbide (UCC) negli Stati Uniti chiuse i battenti nel 1977.
Gli alcoli secondari prodotti in questo processo vengono solitamente convertiti in etossidi di alchilfenolo e utilizzati come detergenti. Tuttavia, a causa del costoso ricircolo di idrocarburi e acido borico, nonché degli svantaggi nell’applicazione di alcoli secondari, questo processo non ha acquisito un’importanza significativa nel mondo occidentale.
Oltre all’ossidazione di Bashkirov, un altro uso significativo dell’ossidazione catalizzata dall’acido borico è nella preparazione di cicloesanolo e cicloesanone dal cicloesano, come prodotti intermedi nella fabbricazione di caprolattame, acido adipico e fenolo.
Inoltre, viene utilizzato nella sintesi di ciclododecanolo (un prodotto intermedio nella sintesi del nylon 12) e ciclododecanone dal ciclododecano. Il processo prevede l’ossidazione con idroperossidi alchilici, dove le porfirine di ferro fungono da utili catalizzatori.
Gli alcoli possono essere ottenuti dagli acidi grassi tramite l’esterificazione di acidi grezzi frazionati (principalmente nell’intervallo C10–C15) con metanolo o butanolo, seguita da idrogenazione. Quando gli idrocarburi lineari vengono utilizzati come materiali di partenza, possono essere prodotti alcoli lineari.
Tuttavia, a seconda dell’idrocarburo specifico, del catalizzatore e delle condizioni di reazione, la miscela di alcol può contenere il 5-15% di alcol a catena ramificata. A causa delle impurità presenti negli acidi grassi, gli alcol da essi derivati possono contenere sostanze odorose, limitandone la gamma di applicazioni.
7. Idratazione delle olefine
L’idratazione degli alcheni è un metodo comune per la produzione di alcol inferiori. Secondo la regola di Markovnikov, in questa reazione si formano alcol secondari e terziari (tranne nel caso dell’etilene).
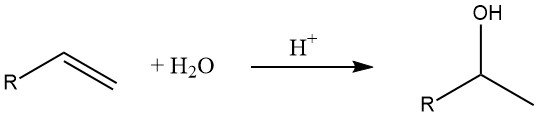
La velocità della reazione di idratazione dipende dalla stabilità dello ione carbenio intermedio, con gli ioni carbenio terziari più stabili di quelli secondari e primari.
Pertanto, l’idratazione dell’isobutene avviene facilmente a temperatura ambiente in presenza di basse concentrazioni di ioni H⁺ a causa della relativa stabilità dello ione carbenio terziario intermedio. D’altro canto, l’idratazione dell’etilene richiede temperature e pressioni elevate.
In contesti industriali, vengono utilizzate due varianti della reazione di idratazione. Nel processo indiretto, la reazione in fase liquida avviene in due fasi. Inizialmente, l’olefina reagisce con l’acido solforico per formare mono- e dialchilsolfati, che vengono poi idrolizzati per produrre l’alcol dopo la diluizione con acqua. Tuttavia, questo processo richiede una costosa fase di riconcentrazione per riciclare l’acido solforico.
Nel processo diretto, l’idratazione avviene nella fase gassosa. Poiché la reazione è esotermica e porta a una riduzione del volume (2 moli di reagente formano 1 mole di prodotto), la formazione di alcol è favorita da alta pressione e bassa temperatura.
A causa della conversione incompleta, in questo processo è necessario un costoso riciclo del gas. I catalizzatori efficienti per la reazione di idratazione diretta includono materiali contenenti acido fosforico come la celite, sebbene anche gli scambiatori ionici siano sempre più utilizzati.
L’idratazione diretta è impiegata principalmente nella produzione di etanolo dall’etilene e alcol isopropilico dal propene. Svolge inoltre un ruolo importante nella produzione di 2-butanolo da una miscela di 1-butene e 2-butene (raffinato II) e alcol terz-butilico dall’isobutene.
8. Omologazione degli alcoli
L’omologazione è una reazione chimica in cui gli alcoli reagiscono con il gas di sintesi in presenza di sistemi catalizzatori complessi e multicomponenti. A seconda delle condizioni specifiche della reazione, i prodotti ottenuti possono essere aldeidi o alcoli con un gruppo CH2 in più rispetto ai materiali di partenza.
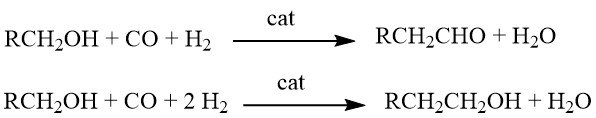
Originariamente, questa reazione è stata sviluppata per la sintesi di etanolo dal metanolo. Tuttavia, le sue applicazioni sono state estese per includere la produzione di aldeidi omologhe (come l’acetaldeide dal metanolo), acidi carbossilici (ad esempio, acido propionico dall’acido acetico), esteri di acidi carbossilici (ad esempio, acetato di etile dall’acetato di metile) e persino la sintesi di stirene (mediante omologazione di alcol benzilico a 2-feniletanolo, seguita da disidratazione).
Nonostante i significativi progressi in quest’area, il processo di omologazione non è stato implementato su scala industriale a causa di diverse sfide. La conversione e la selettività raggiunte finora sono ancora insufficienti per un uso industriale pratico e ci sono difficoltà associate al riciclaggio dei complessi catalizzatori di omologazione. Di conseguenza, l’applicazione su scala industriale della reazione di omologazione rimane limitata.
9. Processo Reppe
Il processo di idrocarbonilazione Reppe comporta la reazione di olefine con monossido di carbonio e acqua, utilizzando sali di ammonio di tetracarbonildiidrato di ferro come catalizzatore, per produrre alcoli. Similmente alla sintesi oxo, questo processo produce anche prodotti a catena ramificata, con un rapporto molare tra alcoli lineari e a catena ramificata di circa 9:1.

Ad esempio, il propene reagisce a temperature di 90-110 °C e pressioni comprese tra 5 e 20 bar per produrre butanoli con un’elevata resa del 90%. Circa il 4% del propene viene idrogenato per formare propano. Tuttavia, la conversione di olefine superiori richiede condizioni di reazione più severe.
Nonostante il suo potenziale, il processo di idrocarbonilazione di Reppe non può competere con l’idroformilazione in termini di importanza industriale. L’unico impianto noto che utilizza questo processo per produrre butanolo dal propene (Japan Butanol Co., con una capacità di 30.000 t/a) ha cessato le operazioni all’inizio degli anni ’80.
10. Idrocarbossimetilazione
L’idrocarbossimetilazione è una variante del processo Reppe in cui le olefine superiori subiscono una reazione con monossido di carbonio e metanolo, impiegando un catalizzatore cobalto-piridina.
I prodotti risultanti sono esteri di acidi carbossilici che hanno un atomo di carbonio in più nella catena madre rispetto alla materia prima olefinica originale. Questi esteri possono essere ulteriormente idrogenati per produrre gli alcoli corrispondenti.
Tuttavia, nonostante il suo potenziale, il processo non ha acquisito un’importanza industriale significativa a causa di considerazioni economiche. Al momento, i prodotti possono essere preparati in modo più conveniente utilizzando materie prime naturali. Di conseguenza, l’idrocarbossimetilazione non ha ancora raggiunto un’importanza diffusa nelle applicazioni industriali.
11. Fermentazione
La fermentazione, che si ritiene sia uno dei metodi più antichi per produrre etanolo, è ancora ampiamente praticata su larga scala. Su scala più piccola, i pentanoli vengono recuperati dagli alcoli fuselici.
Di recente, c’è stata una crescente importanza nella fermentazione butanolo-acetone di materie prime di carboidrati.
Aziende come Gevo e Butamax (una joint venture tra BP e DuPont) hanno intrapreso una ricerca approfondita sulla produzione di butanolo da materie prime rinnovabili. Ciò indica un crescente interesse nell’uso di processi di fermentazione per produrre butanolo da fonti sostenibili.
12. Alcoli di Guerbet
Nel processo Guerbet, gli alcoli primari saturi vengono dimerizzati per produrre alcoli primari α-ramificati. In genere, la reazione viene condotta tramite riflusso dell’alcol in presenza di un agente di condensazione alcalino e di un catalizzatore di idrogenazione-deidrogenazione, come mostrato di seguito:
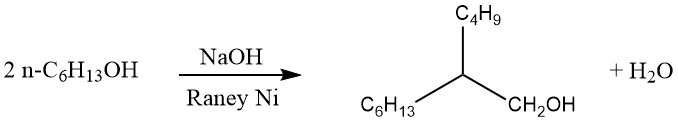
L’acqua e piccole quantità di idrogeno generate durante la reazione vengono continuamente rimosse. Se il riscaldamento è prolungato, possono anche formarsi alcoli primari trimerici α-ramificati.
La resa di alcoli dimerici nel processo Guerbet è di circa l’80%. Questa resa può essere aumentata riciclando i residui e aggiungendo gradualmente nuovo catalizzatore. Mentre varie sostanze, tra cui il sodio metallico, sono state proposte come agenti di condensazione, gli idrossidi di metalli alcalini sono comunemente preferiti per applicazioni industriali.
Gli alcoli a catena corta con lunghezze di catena più corte dell’alcol cetilico (C16) vengono preferibilmente dimerizzati a pressione più elevata. Utilizzando questo processo, è possibile convertire gli alcoli a catena corta in alcoli C10–C20. Ad esempio, vengono prodotti 2-esildecanolo e 2-ottildodecanolo, che trovano applicazione nei cosmetici come componenti oleosi con proprietà solventi benefiche.
Tuttavia, la reazione Guerbet non ha acquisito importanza industriale poiché gli alcoli con tipica α-ramificazione sono più facilmente preparati utilizzando altri metodi. Ad esempio, il 2-etil-1-esanolo può essere ottenuto mediante idroformilazione del propene per produrre butanale, seguita da una fase di condensazione aldolica.
A causa della disponibilità di processi alternativi per la sintesi di alcoli α-ramificati, la reazione di Guerbet non è stata stabilita come processo industriale su larga scala.
13. Altri processi
L’epossidazione di α-olefine lineari seguita da successiva scissione idrogenante è di notevole interesse commerciale. Questo processo porta alla produzione di alcoli plastificanti (C6–C10) o alcoli detergenti (C10–C16).
Per la fase di scissione idrogenante, possono essere utilizzati vari catalizzatori. La selettività verso gli alcoli primari può essere influenzata dalla scelta del catalizzatore, dalle condizioni del processo di idrogenazione e dall’uso di solventi.
Inoltre, l’idrolisi degli esteri di acidi carbossilici ha una certa importanza nelle applicazioni industriali.
Riferimento
- Alcohols, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_279.pub2
