Metilammina: proprietà, reazioni, produzione e usi
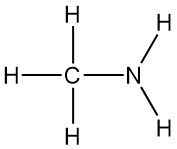
La metilammina è l’ammina primaria più semplice, con formula CH3NH2. È un gas incolore derivato dall’ammoniaca, con un atomo di idrogeno sostituito da un gruppo metilico. Fu sintetizzata per la prima volta nel 1849 da Wurtz insieme a dimetilammina e trimetilammina.
La sintesi industriale di metilammine da metanolo e ammoniaca fu segnalata nel 1884 e fu commercializzata negli anni ’20 per la concia delle pelli.
Sommario
1. Proprietà fisiche della metilammina
La metilammina è un gas che ha un caratteristico odore di pesce a basse concentrazioni ma, a concentrazioni più elevate, presenta un odore simile all’ammoniaca. Le sue soluzioni acquose formano idrati cristallini dopo raffreddamento con la formula CH3NH2·3 H2O.
La metilammina è solubile in vari solventi organici, come metanolo, etanolo, dimetilformammide ed etilenglicole.
La Tabella 1 presenta le proprietà fisiche dettagliate della metilammina.
| Proprietà | Valore |
|---|---|
| Peso molecolare (g/mol) | 31,06 |
| Punto di ebollizione (101,33 kPa), °C | -6,3 |
| Punto di fusione, °C | -93,0 |
| Densità (gas), g/cm3 a 101,33 kPa | 0,0014 |
| Densità (liquido), g/cm3 a 25 °C | 0,6624 |
| pKa (a 25 °C) | 10,62 |
| Tensione superficiale (25 °C), 10-3 N/m | 19,19 |
| Calore di vaporizzazione (25 °C), kJ/mol | 24,249 |
| Calore di vaporizzazione (punto di ebollizione), kJ/mol | 26,0 |
| Calore di fusione, kJ/mol | 6,054 |
| Calore di formazione standard (liquido, 25 °C), kJ/mol | -47,31 |
| Calore di formazione standard (gas, 25 °C), kJ/mol | -22,98 |
| Calore di combustione (liquido, stato standard, 25 °C), kJ/mol | -1061,35 |
| Capacità termica (gas ideale, 25 °C), J K-1 mol-1 | 50,1 |
| Temperatura critica, °C | 156,9 |
| Pressione critica, MPa | 7,46 |
| Costante dielettrica (liquido, 25 °C) | 9,4 |
| Momento di dipolo nel benzene (25 °C), D | 1,47 |
| Punto di infiammabilità (vaso chiuso), °C | -62 |
| Temperatura di accensione nell'aria, °C | 430 |
| Limite inferiore di esplosione nell'aria (vol %) | 4,9 |
| Limite superiore di esplosione nell'aria (vol %) | 20,7 |
2. Reazioni chimiche della metilammina
La metilammina è una base debole che forma facilmente sali con acidi (ad esempio, alogenuri di metilammonio, noti anche come idroalogenuri di metilammina, con i corrispondenti acidi alogenidrici).
La reazione della metilammina con alogenuri alchilici porta a un’ulteriore alchilazione, fino alla formazione di sali di ammonio quaternario. Un esempio è la reazione con alogenuro di etile per formare metiletilammina, metildietilammina e alogenuro di metiltrietilammonio.
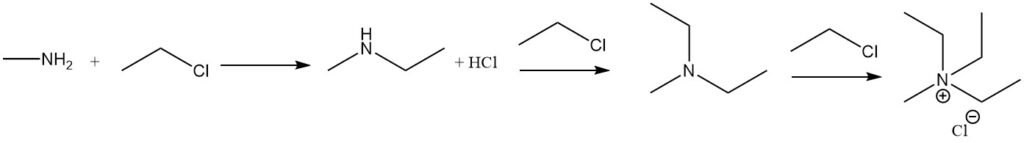
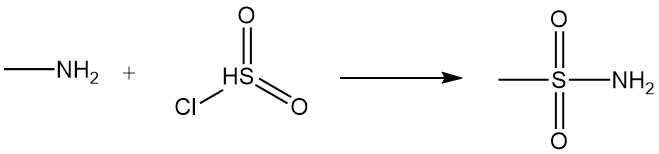
La reazione della metilammina con acidi carbossilici e i loro derivati produce N-metilammidi, mentre la reazione con il cloruro di solfonile produce metilsolfonammide sostituita.
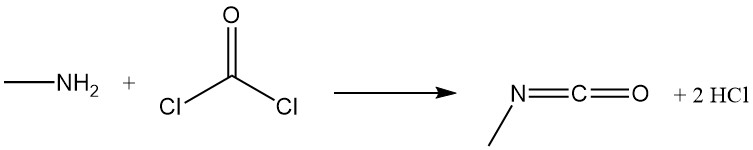
La metilammina reagisce con il fosgene per formare isocianato di metile, un intermedio nella produzione di insetticidi carbammati, e con il disolfuro di carbonio in presenza di idrossido di sodio per produrre metilditiocarbammato di sodio.
L’urea reagisce con la metilammina tramite cianato di ammonio intermedio per produrre N-metilurea.
Gli ipocloriti alcalini portano a una miscela di metil mono- e dicloroammine.
La metilammina viene decomposta in metanolo e azoto mediante trattamento con acido nitroso e in cloruro di metile e azoto mediante l’azione del cloruro di nitrosile.
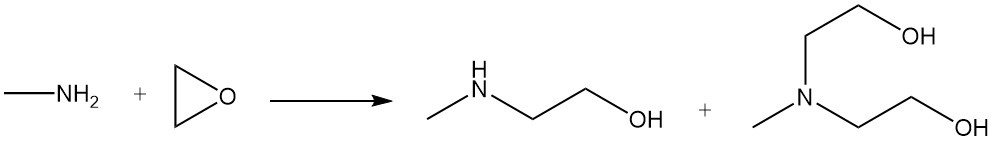
La metiletanolammina e la metildietanolammina sono prodotte dalla reazione della metilammina con l’ossido di etilene.
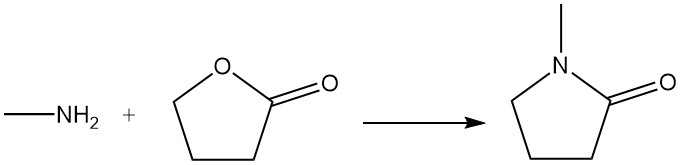
Il γ-butirrolattone reagisce con la metilammina per produrre N-metilpirrolidone, che viene utilizzato come solvente.
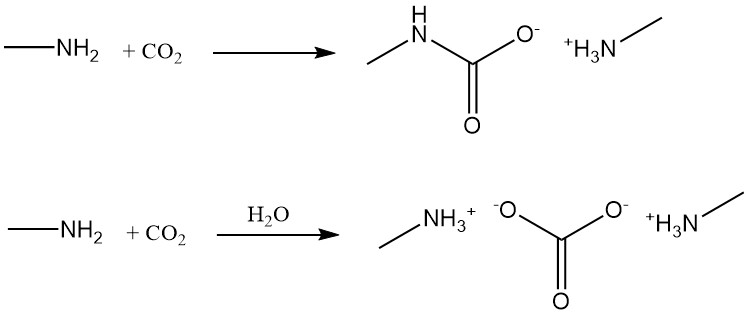
La metilammina reagisce con l’anidride carbonica per formare carbammato di metilammina in condizioni anidre e carbonato di metilammina in presenza di acqua.
La metilammina è corrosiva per alluminio, rame, leghe di rame, metallo zincato, magnesio, zinco e le loro leghe. Tuttavia, l’acciaio dimostra buone prestazioni come materiale da costruzione per la gestione sia della metilammina anidra che delle sue soluzioni acquose.
3. Produzione di metilammina
La metilammina viene prodotta tramite la reazione esotermica tra metanolo e ammoniaca su un catalizzatore di silice-allumina amorfa a 350–450 °C. Questa reazione genera una miscela delle tre varianti di metilammina (mono-, di- e trimetilammina).
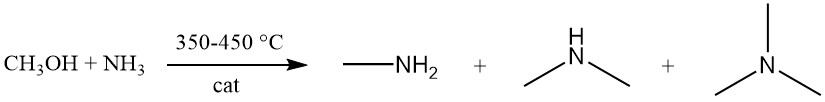
Mentre l’equilibrio favorisce la formazione di trimetilammina, la domanda del mercato dà priorità alla mono- e soprattutto alla dimetilammina. Il processo di sintesi dell’ammina può essere modellato da nove reazioni di equilibrio bimolecolare, tre delle quali coinvolgono specificamente la formazione di ammine:
- NH3 + CH3OH → CH3NH2 + H2O
- CH3NH2 + CH3OH → (CH3)2NH + H2O
- (CH3)2NH + CH3OH → (CH3)3N + H2O
Attualmente vengono utilizzati due sistemi di catalizzatori primari per la reazione metanolo-ammoniaca in fase vapore: catalizzatori acidi solidi amorfi e catalizzatori a base di zeolite selettivi per forma.
La miscela di reazione grezza contenente metilammine, ammoniaca in eccesso, acqua e metanolo non convertito viene purificata utilizzando una serie di colonne di distillazione (tipicamente 4-5). La trimetilammina viene separata dalla miscela utilizzando la distillazione estrattiva.
Questo processo di purificazione raggiunge rese elevate (>98%) di mono-, di- e trimetilammina pura e anidra. Il metanolo recuperato migliora l’efficienza del processo e la durata del catalizzatore.
4. Utilizzi della metilammina
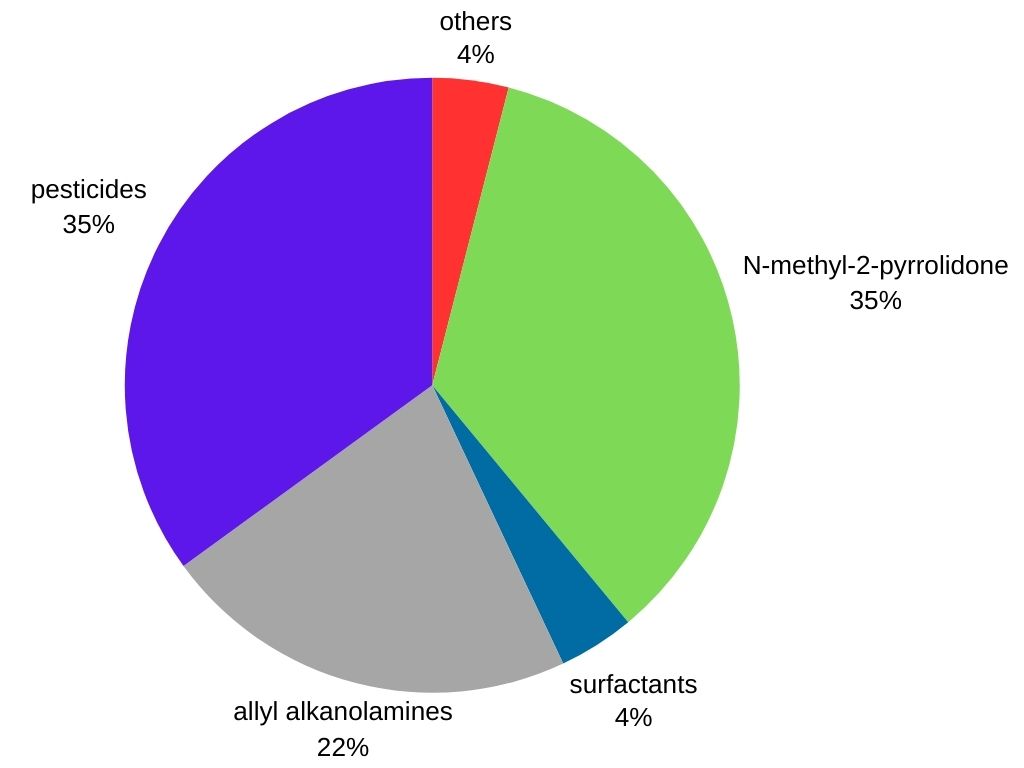
La metilammina è usata principalmente come intermedio nella produzione di diversi prodotti commerciali:
Prodotti agrochimici: la metilammina è un importante intermedio nella produzione di numerosi erbicidi, pesticidi e insetticidi, contribuendo alla protezione delle colture.
Prodotti farmaceutici: è usata nella sintesi di alcuni farmaci, tra cui decongestionanti e antistaminici.
Prodotti chimici per la lavorazione della gomma: la metilammina trova applicazione nella produzione di vari prodotti in gomma come pneumatici e tubi flessibili.
Tensioattivi: è impiegato nella produzione di agenti detergenti e bagnanti presenti in detergenti, shampoo ed emulsionanti.
Altre applicazioni: la metilammina è anche un precursore del Tovex (esplosivo in gel d’acqua), del solvente N-metil-2-pirrolidone, della metildietanolammina (un solvente utilizzato nella lavorazione degli idrocarburi) e del disinfettante per il suolo “Metam sodium”.
5. Tossicologia della metilammina
Sia la metilammina che le sue soluzioni sono estremamente infiammabili e richiedono una corretta manipolazione per prevenire incendi ed esplosioni.
La metilammina e le sue soluzioni acquose sono corrosive e possono causare ustioni e irritazioni agli occhi, alla pelle e all’apparato respiratorio. Se inalata, colpisce le vie respiratorie superiori a basse concentrazioni (75 ppm) e concentrazioni più elevate possono danneggiare il fegato.
L’esposizione alla metilammina può causare effetti simili a quelli dell’ammoniaca, tra cui bronchite, congiuntivite, dermatite e, nei casi gravi, irritazione, ustioni, danni ai polmoni e cicatrizzazione tardiva degli organi.
L’esposizione ripetuta alla metilammina negli animali è stata collegata a tossicità epatica, anomalie della chimica del sangue e problemi polmonari.
Gli studi sulla tossicità genetica non sono conclusivi.
Gli studi esistenti suggeriscono che il feto non è particolarmente suscettibile all’esposizione, sebbene siano necessarie ulteriori ricerche.
L’American Conference of Governmental Industrial Hygienists (ACGIH) ha fissato un valore limite di soglia (TLV) di 5 ppm (parti per milione) come media ponderata nel tempo (TWA) e 15 ppm come limite di esposizione a breve termine (STEL) per la metilammina.
Riferimenti
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamine; Encyclopedia of Toxicology (Third Edition). – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543005182
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
