Idrazina: proprietà, reazioni e usi

Cos’è l’idrazina?
L’idrazina è un composto inorganico con formula N2H4. È un liquido incolore altamente tossico con un forte odore simile all’ammoniaca.
L’idrazina è venduta prevalentemente sotto forma di soluzione acquosa contenente fino al 64% di concentrazione, corrispondente a idrazina idrata N2H4·H2O.
Nel 1875 EMIL FISCHER fece una previsione sulla presenza di idrazina H2N–NH2. Nel 1887, CURTIUS riuscì a isolarla. Poi, nel 1893, DE BRUYN riuscì a isolare l’idrazina anidra.
RASCHIG inventò il processo di produzione commerciale iniziale nel 1907, che è ancora utilizzato in Giappone, Russia, Cina e Corea.
L’uso estensivo di idrazina e dei suoi derivati come agenti espandenti per schiume plastiche ha portato all’emergere di varie applicazioni industriali come il trattamento dell’acqua delle caldaie, gli iniziatori di polimerizzazione, i pesticidi, i prodotti farmaceutici, i prodotti chimici fotografici e i coloranti.
Anche dopo un secolo dalla sua scoperta, la sintesi dell’idrazina rimane una sfida principalmente a causa di vincoli termodinamici. La maggior parte dell’idrazina viene prodotta utilizzando versioni modificate del processo Raschig, che prevede l’ossidazione dell’ammoniaca mediante ipoclorito.
Tuttavia, gli impianti più recenti costruiti dal 1980 impiegano il processo PCUK, che utilizza il perossido di idrogeno come ossidante.
Sommario
1. Proprietà fisiche dell’idrazina
L’idrazina è un liquido incolore con un odore simile all’ammoniaca. Presenta una completa miscibilità con l’acqua e forma soluzioni acquose altamente alcaline.
In particolare, proprietà specifiche come viscosità e densità raggiungono i loro valori massimi quando la composizione è al 64%, indicando la presenza della forma monoidrata, N2H4·H2O, sia nella fase solida che in quella liquida.
L’idrazina forma un azeotropo (punto di ebollizione 120,5 °C) con l’acqua, dove la miscela azeotropica contiene il 58,5% molare di idrazina.
L’idrazina è un composto endotermico, con un calore di formazione di +50,6 kJ/mol. I suoi limiti di esplosività nell’aria vanno dal 4,7% al 100%. Il limite superiore indica che l’idrazina anidra è in grado di autoesplodere.
Tuttavia, diluendolo con un gas inerte come azoto o acqua si riduce notevolmente l’intervallo di infiammabilità aumentando il limite inferiore di esplosività. Di conseguenza, l’idrazina idratata (contenente il 30,9% in volume di idrazina) può essere maneggiata in sicurezza a pressione atmosferica e 120 °C in assenza di aria.
Di seguito è riportata una panoramica di alcune proprietà fisiche dell’idrazina:
- Massa molare = 32,05 g/mol
- Punto di fusione = 2 °C
- Punto di ebollizione = 113,5 °C
- Densità = 1,0045 g/ml
- Indice di rifrazione = 1,4644 a 25 °C
- Viscosità = 0,974 μPa.s
- pH (al 65% di soluzione acquosa) = 12,75
2. Reazioni chimiche dell’idrazina
Le proprietà chimiche dell’idrazina sono fortemente influenzate dalle seguenti caratteristiche: la sua natura endotermica, l’alcalinità e le forti proprietà di agente riducente.
2.1. Decomposizione termica
Una decomposizione significativa dell’idrazina richiede una temperatura relativamente alta (250 °C) in assenza di catalizzatori. Tuttavia, la presenza di alcuni catalizzatori come rame, cobalto, molibdeno e i loro ossidi abbassa la temperatura di decomposizione. Pertanto, è necessaria una manipolazione cauta dell’idrazina.
2.2. Reazioni acido-base
L’idrazina agisce come una base debole e reagisce con l’acqua:

Il catione N2H6+ si osserva solo in soluzioni altamente acide o allo stato solido.
L’idrazina può formare sali con acidi, compresi quelli esplosivi come nitrato, perclorato e azide. D’altro canto, i sali disponibili in commercio come cloridrato, bromidrato e solfato possono essere gestiti in modo simile all’idrato di idrazina.
2.3. Agente riducente
L’idrazina mostra forti proprietà di agente riducente e reagisce esotermicamente con l’ossigeno:

Molte applicazioni dell’idrazina si basano su questa reazione. L’ossidazione dell’idrazina da parte dell’aria in soluzioni alcaline è catalizzata da diversi metalli. Pertanto, le soluzioni di idrazina devono essere distillate in assenza o inattivazione di rame, metalli polivalenti o loro sali. Gli ossidi di cadmio, magnesio, zinco e alluminio forniscono stabilizzazione contro l’ossidazione aerea in soluzioni di idrazina.
In soluzioni acide, l’idrazina reagisce con gli alogeni:

Queste reazioni trovano utilità nella determinazione di N2H4 (utilizzando iodio), nella purificazione di alogenuri di idrogeno grezzi e nella rimozione di tracce di alogeni nelle acque reflue. La stessa procedura può essere impiegata per rimuovere tracce di idrazina stessa. L’ipoclorito di sodio o il perossido di idrogeno, in presenza di sali di ferro (III) o rame (II), sono opzioni convenienti per il trattamento di rifiuti o fuoriuscite.
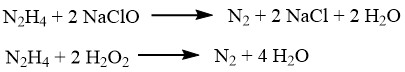
L’idrazina può ridurre vari ioni metallici o ossidi come rame, argento, oro, mercurio, nichel e platino, trasformandoli in metalli polverulenti.
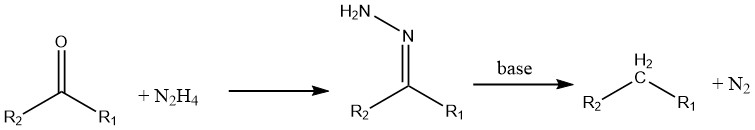
Chetoni e aldeidi subiscono una riduzione in presenza di idrazina (nota come reazione di Wolff-Kishner).
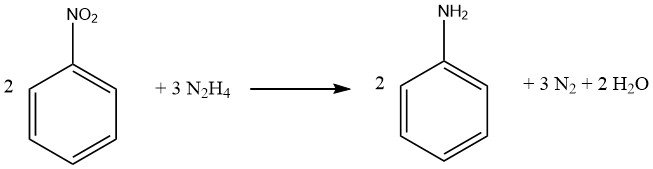
I composti nitro aromatici possono essere ridotti alle corrispondenti ammine utilizzando idrazina e un catalizzatore di idrogenazione come il nichel Raney.
L’idrazina subisce ossidazione a diimmide in presenza di perossido di idrogeno. La diimmide riduce quindi gli acetileni a cis-alcheni e idrogena i doppi legami residui nella gomma acrilonitrile–butadiene.

2.4. Reazioni diamminiche
L’idrazina trova ampio utilizzo nella sintesi e produzione di vari composti azotati a catena aperta ed eterociclici, tra cui idrazo e azo composti, pirazoli, triazoli, urazoli, tetrazoli, piridazine e triazine.
3. Utilizzi dell’idrazina
La maggior parte dell’idrazina disponibile viene venduta come soluzione in acqua. L’idrazina anidra, d’altra parte, viene utilizzata principalmente come carburante per razzi o come mono- o bipropellente per satelliti e veicoli spaziali.
Circa l’80-90% della produzione di idrazina viene convertita in derivati organici. Le sue altre applicazioni si basano sul suo ruolo di agente riducente, composto ricco di energia o sulla sua capacità di stoccaggio dell’idrogeno.
Gli utilizzi significativi dell’idrazina e dei suoi derivati includono il loro utilizzo come iniziatori di polimerizzazione e agenti espandenti per plastiche espanse, nonché nella produzione di pesticidi. Sono anche utilizzati come elementi costitutivi sintetici, prodotti farmaceutici, propellenti e airbag per auto.
3.1. Agenti espandenti
La produzione industriale di agenti espandenti a base di idrazina è sostanziale, con un consumo di idrato di idrazina per questo scopo che ha raggiunto le 50.000 tonnellate all’anno nel 1998. Questi agenti espandenti sono principalmente derivati idrazoici o azoici, con questi ultimi ottenuti tramite ossidazione dei primi utilizzando cloro o perossido di idrogeno.
Quando riscaldati, gli agenti espandenti si decompongono, rilasciando azoto e altri gas, che creano un effetto schiumogeno nei polimeri, con conseguente formazione di pori o cellule. Sono disponibili vari agenti espandenti a base di idrazina prodotti commercialmente e la loro temperatura di decomposizione dipende da fattori quali la dimensione delle particelle, il pH e la presenza di agenti attivanti come sali di bario, cadmio o zinco.
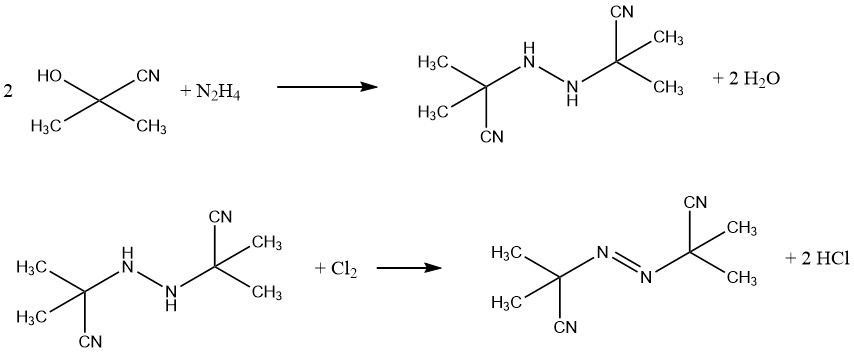
Un esempio di agente espandente commerciale è l’azobis(isobutirronitrile) (AIBN), utilizzato per prodotti in gomma spugnosa e schiume di PVC. Agisce anche come fonte di radicali liberi nell’inizio della polimerizzazione. L’AIBN è sintetizzato da acetone cianidrina e idrazina, seguita da ossidazione con cloro.
Un altro importante agente espandente prodotto dall’urea e dall’idrazina è l’azodicarbonammide.

L’intermedio idrazodicarbonammide può essere ottenuto direttamente da urea e ipoclorito di sodio o tramite ossidazione con cloro o perossido di idrogeno in presenza di una piccola quantità di ioni bromuro in un mezzo acido.
L’azodicarbonammide è l’agente espandente più ampiamente utilizzato a causa del suo grande volume di gas sviluppato durante la decomposizione e delle sue caratteristiche di sicurezza.
Per soddisfare i requisiti di produzione di nuovi materiali in gomma o plastica porosa, negli anni ’50 sono stati introdotti gli idrazidi di acido solfonico.
Questi idrazidi sono superiori agli agenti espandenti inorganici precedentemente utilizzati (ad esempio, nitrito di ammonio, bicarbonato di ammonio, bicarbonato di sodio) in termini di dispersione, maggiore tolleranza alla temperatura e struttura cellulare schiumosa migliorata.
Sono anche incolori, inodori e sicuri, con prodotti di decomposizione che non supportano la combustione. I mono- e i diidrazidi di acido solfonico sono prodotti da idrato di idrazina e dal corrispondente cloruro di acido solfonico.
3.2. Airbag
L’azide di sodio è comunemente utilizzata come precursore di gas nella tecnologia degli airbag. Un processo di produzione per l’azide di sodio prevede idrazina e un nitrito alchilico. Un altro derivato dell’idrazina, il 5-amminotetrazolo, ottenuto da sali di amminoguanidina, è in fase di sviluppo per la stessa applicazione.
3.3. Iniziatori di polimerizzazione a radicali liberi
I composti azoici, in particolare gli azodinitrili simmetrici, sono ampiamente utilizzati come iniziatori di polimerizzazione a radicali liberi.
Questi composti azoici sono sintetizzati da idrazina, un chetone e acido cianidrico (HCN). Il derivato idrazoico viene ossidato utilizzando cloro o perossido di idrogeno in presenza di un catalizzatore bromuro.
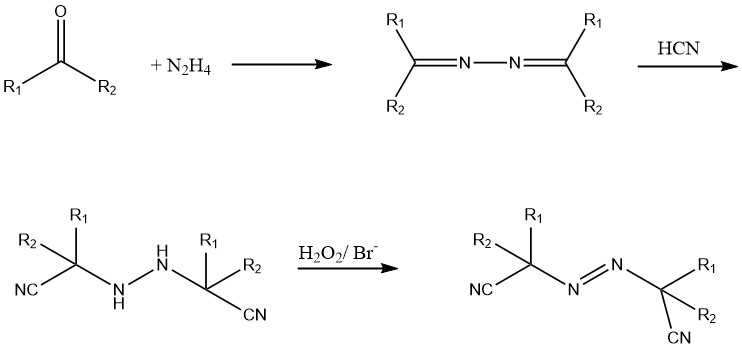
Composti idrosolubili come il 2,2′-azo bis(2-amminopropano) diidrocloruro e composti azoici liquidi come il dietil 2,2′-azobisisobutirrato sono attualmente in fase di sviluppo.
3.4. Pesticidi
I pesticidi a base di idrazina costituiscono una parte significativa del consumo di idrazina. Il primo esempio è l’idrazide maleica, sintetizzata facendo reagire l’anidride maleica con l’idrazina.
Un altro erbicida di uso generale è il 3-ammino-1,2,4-triazolo, ottenuto da cianammide, idrato di idrazina e acido formico. Questo erbicida è utilizzato selettivamente in vigneti e frutteti, con un consumo che raggiunge diverse migliaia di tonnellate all’anno.
Numerosi composti a base di idrazina sono prodotti commercialmente per applicazioni di pesticidi, principalmente composti eterociclici come triazine, ossadiazoli, pirazoli, piridazine e tiadiazoli.
3.5. Prodotti farmaceutici
Sebbene rappresenti una piccola percentuale della produzione totale di idrazina, l’uso di idrazina nei prodotti farmaceutici è significativo. Ad esempio, l’isoniazide, l’idrazide dell’acido isonicotinico, è stata impiegata per la prima volta negli anni ’50 per il trattamento della tubercolosi.
Negli anni ’80 e ’90, sono stati introdotti altri prodotti farmaceutici a base di idrazina contenenti il gruppo 1,2,4-triazolo, che fungono da antidepressivi, antipertensivi e agenti antibatterici o antimicotici.
Gli sviluppi recenti si sono concentrati sui prodotti farmaceutici contenenti il gruppo 4-ammino-1,2,4-triazolo, che dimostrano un’efficienza migliorata.
3.6. Trattamento delle acque
L’idrazina viene utilizzata nel trattamento delle acque per proteggere l’acciaio dalla corrosione nelle caldaie. Quando l’idrazina reagisce con l’ossido di ferro (III), forma magnetite, che funge da strato protettivo contro la corrosione da parte di acqua e ossigeno.
Concentrazioni residue di idrazina inferiori a 0,1 ppm assicurano una protezione completa dalla corrosione. Le formulazioni di idrato di idrazina catalizzata disponibili in commercio, note come idrazina attivata, sono efficaci anche a temperatura ambiente.
3.7. Propellenti
L’uso iniziale su larga scala dell’idrazina era come combustibile per razzi. L’idrazina anidra è un propellente eccellente, con solo l’idrogeno che supera il suo impulso specifico.
Gli attuali propellenti per razzi includono idrazina anidra, monometilidrazina e dimetilidrazina asimmetrica, utilizzati prevalentemente come combustibili bipropellenti in razzi come Titan o Ariane.
L’idrazina anidra funge anche da monopropellente per satelliti e veicoli spaziali. La sua decomposizione su un catalizzatore produce una miscela di gas.
I catalizzatori, spesso basati su iridio o rutenio depositati su allumina, sono classificati come spontanei (funzionanti a temperatura ambiente) o non spontanei (funzionanti a temperature superiori a 100 °C).
3.8. Celle a combustibile
Sono state condotte ricerche approfondite sulle celle a combustibile che utilizzano l’ossidazione dell’idrazina con ossigeno o perossido di idrogeno. Tuttavia, il loro utilizzo è principalmente limitato alle applicazioni militari a causa del costo dell’idrato di idrazina.
Riferimento
- Hydrazine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_177
