Etanolo: proprietà, reazioni, produzione e usi
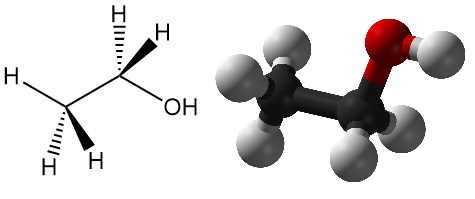
Cos’è l’etanolo?
L’etanolo, noto anche come alcol etilico, è uno degli alcoli più importanti, con la formula chimica CH3CH2OH. È un liquido incolore e volatile con un odore caratteristico ed è ampiamente utilizzato in una vasta gamma di applicazioni. Altri nomi dell’etanolo includono alcol alcolico, spirito di vino, alcol di cereali, alcol assoluto e idrato di etile.
Il termine “alcol” deriva dalle parole arabe “al” e “kohl”, che si riferiscono a una polvere di antimonio finemente macinata utilizzata per scopi cosmetici. Nel tempo, il significato si è evoluto per indicare un alto grado di finezza o purezza, diventando infine specifico per l’etanolo, “spiriti di vino rettificati al massimo grado”.
L’alcol etilico è un componente ben noto delle bevande alcoliche, che vengono prodotte tramite la fermentazione di carboidrati fermentabili. Il brodo di fermentazione stesso può essere consumato come bevanda, come nel caso della birra o del vino, oppure l’alcol può essere concentrato per produrre alcolici con un contenuto alcolico più elevato.
La birra normalmente contiene il 4-6% in volume di etanolo, il vino ne contiene il 12-14% e gli alcolici possono variare dal 30 al 50% in volume. Altre bevande alcoliche contengono quantità diverse di etanolo.
Per usi industriali e commerciali diversi dalle bevande alcoliche, l’etanolo viene denaturato aggiungendo sostanze come metanolo, piridina, formaldeide o sublimato. L’etanolo denaturato viene utilizzato come solvente, materia prima per la produzione chimica e carburante.
La storia dell’etanolo risale a tempi antichi. La birra fermentata veniva consumata a Babilonia, mentre la produzione di vino risale a circa il 3000 a.C. nell’antico Egitto, dove veniva preparato e consumato dai faraoni.
Il processo di distillazione ha probabilmente avuto origine tra il X e il XIV secolo. Durante questo periodo, furono riconosciuti gli effetti “spirituali” dell’etanolo, che portarono al termine “spiritus” per le bevande alcoliche. I primi distillati di vino erano usati principalmente per scopi medicinali.
Fino al XVII secolo, la fermentazione alcolica era considerata un processo di deterioramento. La natura della fermentazione fu inizialmente chiarita nel XIX secolo con la scoperta del microscopio, che rivelò le cellule di lievito come organismi viventi. Tuttavia, ci vollero circa 150 anni per riconoscere il ruolo di questi organismi nel processo di fermentazione.
Sommario
1. Proprietà fisiche dell’etanolo
L’etanolo puro (alcol assoluto) è un liquido volatile, infiammabile, limpido e incolore con un odore gradevole. È miscibile con acqua, etere, acetone, benzene e alcuni altri solventi organici. L’etanolo anidro è igroscopico.
L’etanolo forma una miscela azeotropica con l’acqua, che contiene il 95,57% in peso di etanolo e il 4,43% in peso di acqua. Pertanto, la concentrazione più alta di etanolo che può essere ottenuta per distillazione di una miscela etanolo-acqua è del 95,57%. La distillazione azeotropica, con l’aiuto di un solvente terziario (ad esempio, benzene), deve essere introdotta per produrre etanolo assoluto (anidro).
Le importanti proprietà fisiche dell’etanolo anidro sono elencate nella seguente tabella:
| Proprietà | Valore |
|---|---|
| Numero CAS | [64-17-5] |
| Formula chimica | C2H5OH |
| Peso molecolare | 46,7 g/mol |
| Punto di congelamento | -114,1 °C |
| Punto di ebollizione | 78,32 °C |
| Temperatura critica | 243,1 °C |
| Pressione critica | 6383,48 kPa |
| Volume critico | 0,167 L/mol |
| Densità | 0,7893 g/mL |
| Indice di rifrazione | 1,36143 |
| Tensione superficiale (a 25 °C) | 23,1 mN/m |
| Viscosità (a 20 °C) | 1,17 mPa·s |
| Solubilità in acqua (a 20 °C) | Miscibile |
| Calore di vaporizzazione (a punto di ebollizione normale) | 839,31 J/g |
| Calore di combustione (a 25 °C) | 29676,69 J/g |
| Calore di fusione | 104,6 J/g |
| Limiti di infiammabilità nell'aria | Inferiore: 4,3 vol % Superiore: 19,0 vol % |
| Temperatura di autoaccensione | 423 °C |
| Punto di infiammabilità | 14 °C (vaso chiuso) |
| Calore specifico (a 20 °C) | 2,42 J/(g·°C) |
| Conduttività termica (a 20 °C) | 0,170 W/(m·K) |
| Momento di dipolo (liquido a 25 °C) | 5,67 × 10-30 |
| Suscettività magnetica (a 20 °C) | 0,734 × 10-6 |
| Costante dielettrica (a 20 °C) | 25,7 |
2. Reazioni chimiche dell’etanolo
La reattività chimica dell’etanolo è influenzata principalmente dal suo gruppo idrossilico (-OH), che partecipa a numerose reazioni di importanza industriale come disidratazione, alogenazione, formazione di esteri e ossidazione.
L’atomo di idrogeno del gruppo idrossilico può essere sostituito con un metallo attivo, come sodio, potassio o calcio, per formare etossidi metallici (etilati) con l’evoluzione di idrogeno gassoso.
CH3CH2OH + M → CH3CH2OM + 1/2 H2
L’etossido di sodio, un etossido di metallo comunemente usato, può essere preparato dalla reazione di alcol etilico assoluto con sodio o dal riflusso di alcol etilico assoluto con idrossido di sodio anidro. Commercialmente, l’acqua viene rimossa dalla miscela di reazione usando la distillazione azeotropica con benzene.
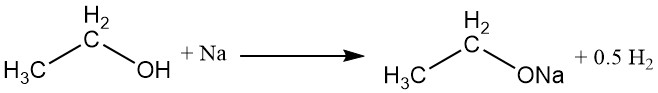
L’etossido di sodio si idrolizza facilmente per produrre alcol etilico, ioni sodio e ioni idrossido.
L’etossido di sodio è utilizzato come agente condensante e riducente nella sintesi organica. Reagisce con il monocloruro di zolfo per produrre dietil tiosolfito. Inoltre, l’etossido di sodio è un reagente per la produzione commerciale di barbiturici, ortoformiato di etile e altre sostanze chimiche.
Anche l’alluminio e il magnesio possono reagire con l’etanolo per formare etossidi, ma questa reazione richiede una catalisi mediante amalgama del metallo.
Le limature di alluminio ben pulite reagiscono con l’etanolo a temperatura ambiente in presenza di cloruro mercurico. Questa reazione può essere eseguita in un’autoclave a temperature elevate senza catalizzatore o con l’aggiunta di etossido di sodio.
Il gruppo idrossilico dell’etanolo può anche partecipare ad altre reazioni, come l’apertura dell’anello degli epossidi per formare idrossieteri e l’aggiunta all’acetilene per formare etil vinil etere. Queste reazioni sono catalizzate sia da condizioni acide che basiche.
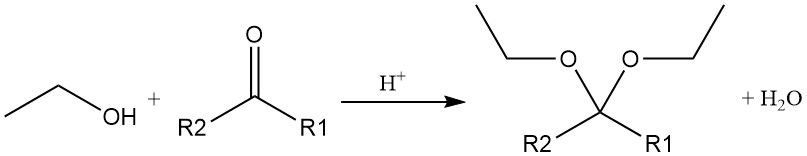
L’aggiunta acido-catalizzata di etanolo ad acetilene o a etere vinilico produce acetali, che sono anche prodotti dalla reazione acido-catalizzata di alcol etilico con un’aldeide o un chetone.
Il gruppo idrossile può essere sostituito da alogeni da alogenuri di acidi inorganici o alogenuri di fosforo, portando alla formazione di esteri etilici dell’acido e di un alogenuro di etile. Il tricloruro di fosforo e il cloruro di tionile sono comunemente usati per produrre cloruro di etile, con trietilfosfito e dietilsolfito come sottoprodotti.
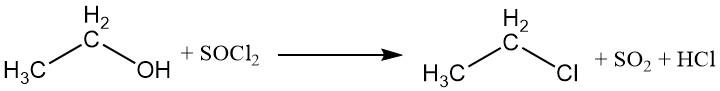
Gli acidi alogenidrici possono anche reagire con l’etanolo per produrre alogenuri alchilici. La reattività degli acidi alogenidrici varia, con l’acido iodidrico che è il più reattivo. Il cloruro di etile può essere preparato dalla reazione tra etanolo e acido cloridrico.
CH3CH2OH + HX → CH3CH2X + H2O
La reazione dell’etanolo con il bromuro di idrogeno produce bromuro di etile, che è un precursore del reagente di Grignard etile e di varie ammine etiliche.
2.1. Esterificazione
L’etanolo reagisce con acidi inorganici e organici, anidridi acide e alogenuri acidi per produrre esteri. Se un acido inorganico contenente ossigeno, come l’acido solforico o l’acido nitrico, viene fatto reagire con l’alcol etilico, l’estere risultante contiene un legame carbonio-ossigeno che può essere idrolizzato.
Gli esteri organici si formano tramite una reazione di disidratazione tra etanolo e un acido organico. Questa reazione è reversibile e raggiunge lentamente l’equilibrio. I catalizzatori acidi come l’acido solforico, l’acido cloridrico, il trifluoruro di boro e l’acido p-toluensolfonico sono comunemente impiegati per accelerare il processo di esterificazione.
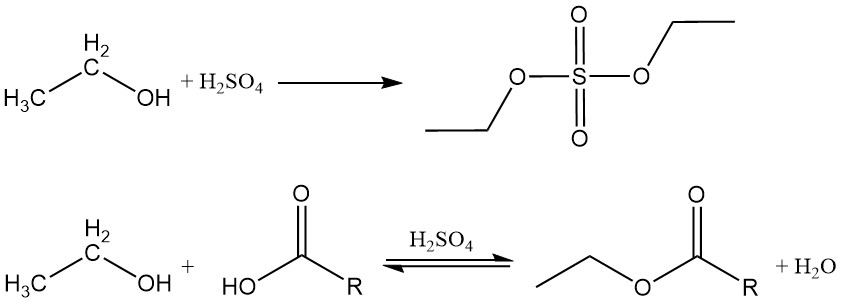
L’etanolo reagisce anche con anidridi acide o alogenuri acidi per formare gli esteri corrispondenti.
Si ritiene che la conversione diretta dell’etanolo in acetato di etile avvenga tramite acetaldeide e la sua successiva condensazione (reazione di Tishchenko). Una resa di acetato di etile di circa il 24% può essere ottenuta utilizzando un catalizzatore di ossido di rame contenente 0,1-0,2% di torio a 350 °C.
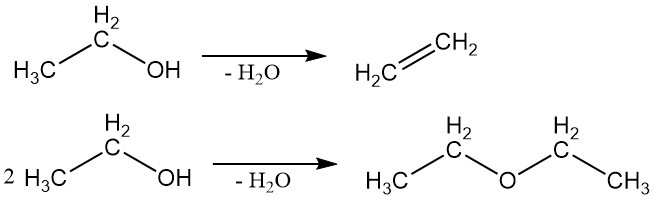
2.2. Disidratazione
L’etanolo può subire disidratazione per produrre etilene o etere etilico. Il prodotto specifico formato dipende dalle condizioni di reazione.
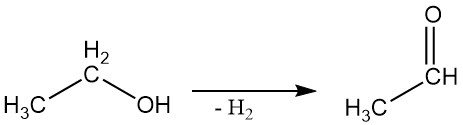
2.3. Deidrogenazione
L’alcol etilico può essere deidrogenato ad acetaldeide in una reazione in fase vapore utilizzando catalizzatori adatti.
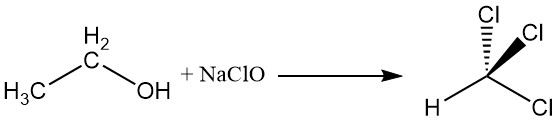
2.4. Reazione dell’aloformio
L’alcol etilico reagisce con l’ipoclorito di sodio per produrre cloroformio, una reazione nota come reazione dell’aloformio.
3. Produzione industriale di etanolo
L’etanolo viene prodotto sia con processi sintetici che di fermentazione. Uno dei primi percorsi di sintesi prevedeva la reazione dell’etilene con l’acido solforico, un processo scoperto oltre un secolo fa.
Tuttavia, la produzione su scala industriale di etanolo sintetico non divenne economicamente fattibile fino agli anni ’30, quando la Carbide and Chemical Corporation sviluppò il processo di idratazione indiretta.
Questo processo, che prevedeva l’assorbimento dell’etilene nell’acido solforico seguito dall’idrolisi, è stato in gran parte sostituito dall’idratazione catalitica diretta dell’etilene, introdotta dalla Shell Chemical Company nel 1948.
Negli ultimi decenni, sono emersi metodi alternativi per la sintesi dell’etanolo, utilizzando materiali di partenza a base di carbone come metanolo o gas di sintesi. Questi processi includono l’omologazione, la carbonilazione e la conversione diretta del gas di sintesi in etanolo.
Tuttavia, la fermentazione di zucchero, amido o cellulosa rimane il metodo predominante per la produzione di etanolo, rappresentando fino al 90% della produzione globale.
3.1. Produzione di etanolo mediante idratazione catalitica diretta dell’etilene
L’idratazione dell’etilene in etanolo è una reazione reversibile. La costante di equilibrio per questa reazione è influenzata da temperatura e pressione. Temperature più elevate favoriscono una maggiore conversione dell’etilene, ma aumentano anche la velocità delle reazioni collaterali, come la formazione di etere dietilico.
Sono stati condotti studi cinetici su vari catalizzatori, tra cui acido fosforico-gel di silice e ossido di tungsteno blu-gel di silice. Questi studi hanno fornito informazioni sull’energia di attivazione e sulla velocità di reazione in diverse condizioni.
Diverse variabili di processo, tra cui pressione, temperatura e rapporto molare acqua-etilene, influenzano la conversione dell’etilene. In condizioni tipiche del reattore (alimentazione di etilene-acqua approssimativamente equimolare, 250–300 °C, 5–8 MPa), la conversione all’equilibrio dell’etilene varia dal 7 al 22%.
Oltre alla reazione di idratazione desiderata, possono verificarsi reazioni collaterali che portano alla formazione di sottoprodotti. A temperature più basse, può essere prodotto etere dietilico, mentre a pressioni più elevate può aver luogo la polimerizzazione dell’etilene in buteni e olefine superiori.
Il meccanismo proposto per l’idratazione dell’etilene prevede quattro fasi:
- Un protone viene aggiunto alla molecola di etilene per formare un complesso π.
- Il complesso π viene convertito in un carbocatione.
- Una molecola d’acqua viene aggiunta al carbocatione.
- Un protone viene rimosso dall’etanolo protonato per produrre etanolo.
Catalizzatori
L’idratazione dell’etilene in etanolo è catalizzata generalmente da catalizzatori acidi. L’acido fosforico supportato su vari materiali, tra cui terra di diatomee (kieselguhr, celite), montmorillonite, bentonite, gel di silice e opoka, è tra i catalizzatori più ampiamente utilizzati per questa reazione.
Oltre ai catalizzatori a base di acido fosforico, sono stati studiati altri catalizzatori, come ossidi acidi, eteropoliacidi, zeoliti e sali. Questi materiali offrono potenziali vantaggi in termini di attività, selettività e stabilità.
In condizioni di reazione, il supporto deve essere resistente all’acido fosforico ma in grado di trattenerlo in grandi quantità; deve anche avere un’adeguata resistenza meccanica e una durata sufficientemente lunga; e, infine, deve fornire un catalizzatore attivo e selettivo per l’idratazione.
Per ottimizzare le prestazioni del catalizzatore, il supporto viene pretrattato con acidi minerali, come acido cloridrico o solforico, per rimuovere impurità come ferro e alluminio, e impregnato con acido fosforico al 50-77%.
Il trattamento termico a temperature elevate (700-1100 °C) viene spesso utilizzato per migliorare il legame dell’acido fosforico al supporto. Mentre questo trattamento può ridurre leggermente l’attività iniziale e la selettività del catalizzatore, può migliorare significativamente la sua stabilità e durata a lungo termine.
Processo di produzione
L’idratazione catalitica dell’etilene in etanolo comporta una serie di passaggi, come illustrato nella Figura 1.
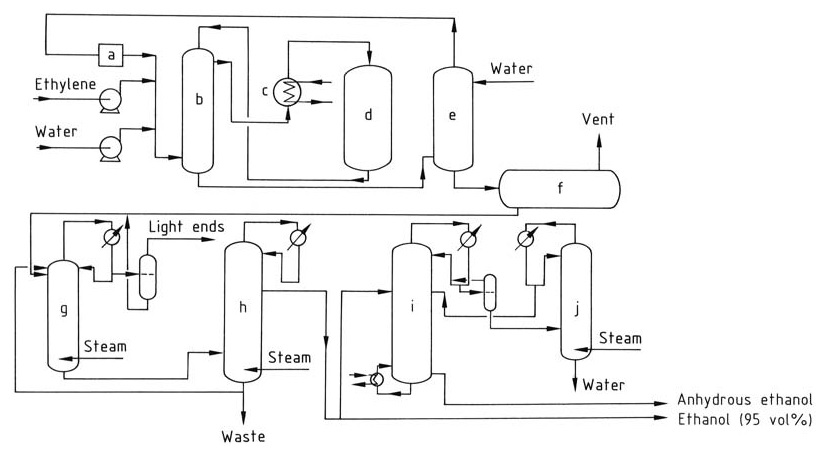
a) Compressore di circolazione; b) Scambiatore di calore; c) Surriscaldatore; d) Reattore; e) Lavatrice; f) Serbatoio di etanolo grezzo; g) Colonna di distillazione estrattiva; h) Colonna di concentrazione; i) Disidratazione; j) Colonna di concentrazione
L’etilene e l’acqua deionizzata, in un rapporto molare compreso tra 1:0,3 e 1:0,8, vengono riscaldati a 250-300 °C a 6-8 MPa passando attraverso uno scambiatore di calore e un surriscaldatore. La reazione è esotermica, rilasciando calore che può essere recuperato e utilizzato per preriscaldare il flusso di alimentazione.
Il flusso di gas viene lavato con acqua per rimuovere qualsiasi residuo di etanolo. Il gas purificato viene quindi ricompresso e riciclato nel reattore per mantenere la concentrazione di etilene desiderata.
I prodotti della reazione vengono raffreddati e condensati per separare le fasi liquida e gassosa. Il prodotto di etanolo grezzo raccolto nella vasca di lavaggio contiene circa il 10-25% di etanolo in peso e viene ulteriormente purificato tramite distillazione per ottenere un azeotropo etanolo-acqua al 95%.
Per produrre etanolo anidro, l’etanolo al 95% può essere disidratato utilizzando la distillazione azeotropica.
Durante l’idratazione catalitica dell’etilene, una parte del catalizzatore di acido fosforico può essere trascinata dal flusso di gas. Per evitare l’accumulo di acido nell’apparecchiatura a valle, viene iniettata una soluzione diluita di idrossido di sodio per neutralizzarlo.
L’acido fosforico perso a causa del trascinamento e dell’evaporazione viene ripristinato spruzzandolo periodicamente sul letto del catalizzatore per garantire una concentrazione costante del catalizzatore durante tutto il processo di reazione.
L’etere dietilico, circa il 2%, è un sottoprodotto comune della reazione e può essere recuperato e purificato per un uso separato o riciclato nel reattore. L’acetaldeide, una potenziale impurità, viene convertita in etanolo tramite idrogenazione per evitare la formazione di composti indesiderati come la crotonaldeide.
L’apparecchiatura di processo è composta da reattori, scambiatori di calore, colonne di distillazione e tubazioni associate. I reattori sono solitamente realizzati in acciaio con un rivestimento in rame o carbonio per proteggerli dalla corrosione causata dall’acido fosforico. Anche gli scambiatori di calore e le tubazioni esposte all’acido fosforico sono realizzati in rame o leghe di rame.
Il processo genera rifiuti minimi. L’etilene sfiatato, che rappresenta meno del 15% dell’alimentazione totale, può essere restituito all’impianto di etilene o incenerito. Le acque reflue della distillazione sono povere di composti organici e fosfati (circa 0,3 kg di Na2HPO4 per metro cubo) e possono essere facilmente smaltite.
3.2. Produzione di etanolo mediante idratazione indiretta dell’etilene
L’idratazione indiretta dell’etilene mediante acido solforico comporta due fasi principali: l’assorbimento dell’etilene e l’idrolisi del solfato prodotto.
L’etilene reagisce con l’acido solforico concentrato per formare etil idrogenosolfato e dietil solfato, che vengono poi idrolizzati con acqua per produrre etanolo ed etere dietilico.
Studi cinetici hanno dimostrato che le fasi di assorbimento e idrolisi seguono un meccanismo di reazione simile al processo di idratazione diretta, ma sono influenzate dalla solubilità dell’etilene nell’acido solforico.
I prodotti finali del processo di idratazione indiretta sono etanolo ed etere dietilico (5-10%). La resa di etere dietilico può essere controllata regolando le condizioni di reazione, come il rapporto tra etilene e acido solforico e le condizioni di idrolisi.
Gli etil solfati possono essere transesterificati con acido acetico a 104 °C per produrre acetato di etile. L’acetato di etile viene poi recuperato per distillazione e idrolizzato in etanolo e acido acetico. Questo processo offre un vantaggio rispetto al metodo tradizionale di idrolisi evitando la necessità di riconcentrazione dell’acido solforico.
Processo di produzione
La figura 2 mostra lo schema di flusso per la produzione di etanolo mediante idratazione indiretta dell’etilene.
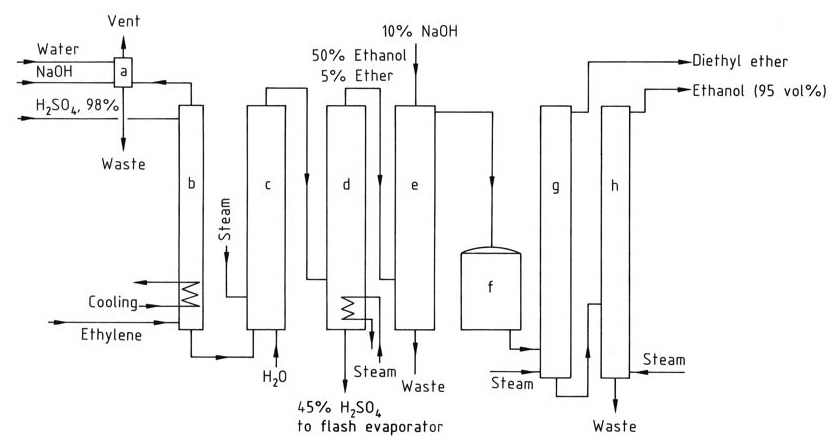
a) Colonna di lavaggio per gas residuo; b) Assorbitore; c) Idrolizzatore; d) Colonna di stripping; e) Colonna di lavaggio per etanolo grezzo; f) Serbatoio del prodotto grezzo; g) Colonna di distillazione dell'etere dietilico; h) Colonna di distillazione dell'etanolo
Il gas di alimentazione per il processo di idratazione indiretta deve contenere almeno il 35% di etilene e deve essere privo di omologhi superiori che possono causare la formazione di resina. Possono essere aggiunti gas inerti come metano ed etano.
L’assorbimento di etilene aumenta con la pressione, che è generalmente compresa tra 1 e 3,5 MPa. Ogni mole di acido solforico può assorbire fino a 1,4 moli di etilene. L’assorbimento viene condotto in torri di lavaggio a 65-85 °C e temperature superiori a 90 °C devono essere evitate per prevenire la formazione di resina.
L’etilene assorbito reagisce con l’acido solforico per formare solfati etilici dopo agitazione per diverse ore. L’idrolisi di questi solfati viene eseguita in due fasi: un’idrolisi a bassa temperatura (70 °C) per convertire il dietil solfato e una successiva idrolisi ad alta temperatura (100 °C) per circa 1 ora per completare la reazione.
L’acido solforico viene diluito al 40-55% in peso e l’etanolo e l’etere dietilico vengono recuperati dalla miscela di reazione tramite una colonna di stripping. La miscela di prodotto viene quindi neutralizzata con idrossido di sodio e l’etere dietilico viene rimosso in una colonna di distillazione separata.
L’etanolo viene ulteriormente purificato tramite distillazione per ottenere un azeotropo etanolo-acqua al 95%.
La riconcentrazione dell’acido solforico diluito è una fase costosa del processo di idratazione indiretta, caratterizzata da elevato consumo di energia, problemi di corrosione e ossidazione dei composti organici (formazione di catrame).
Per superare queste sfide, operare a pressioni inferiori a 0,5 MPa e aggiungere solfato d’argento fino al 7% all’acido solforico può migliorare l’efficienza del processo e ridurre i requisiti di riconcentrazione.
La scelta dei materiali di costruzione dipende dalle fasi specifiche del processo. L’acciaio è comunemente utilizzato per le apparecchiature di assorbimento e distillazione. Piombo e materiali resistenti agli acidi sono adatti all’idrolisi, mentre silumin, tantalio, ghisa e piombo sono usati per la riconcentrazione dell’acido solforico.
3.3. Altri metodi
Sono stati sviluppati altri metodi per sintetizzare l’etanolo dal metanolo e dal gas di sintesi. È probabile che questi processi siano di importanza industriale in futuro perché utilizzano materiali di partenza disponibili dal carbone e non derivati dal petrolio.
3.3.1. Omologazione del metanolo
L’omologazione, un processo che estende la catena di carbonio di un alcol di un atomo di carbonio, è stata esplorata come una via alternativa per la sintesi dell’etanolo. Il metanolo può reagire con il gas di sintesi (CO + H2) in presenza di un catalizzatore carbonilico di cobalto per produrre etanolo.
I primi tentativi di omologazione del metanolo hanno prodotto basse rese di etanolo e miscele di prodotti complesse. Tuttavia, i progressi nella progettazione del catalizzatore e nelle condizioni di reazione hanno migliorato la selettività per l’etanolo.
Studi hanno dimostrato che l’uso di tetraidrofurano come solvente o l’aggiunta di iodio o ioduro con fosfine organiche può migliorare la selettività dell’etanolo.
3.3.2. Carbonilazione di metanolo e acetato di metile
Un altro approccio alla produzione di etanolo è la carbonilazione del metanolo in acido acetico, seguita dall’idrogenazione. Questo metodo si basa sul processo Monsanto per la sintesi dell’acido acetico, che utilizza un catalizzatore di rodio carbonile-iodio.
Sebbene sia possibile l’idrogenazione diretta dell’acido acetico in etanolo, richiede apparecchiature ad alta pressione e può essere corrosiva. Un metodo più pratico è l’esterificazione dell’acido acetico con etanolo per formare acetato di etile, seguita dall’idrogenolisi dell’acetato di etile in etanolo.
Sono state sviluppate diverse varianti del processo di carbonilazione, tra cui l’uso dell’acetato di metile come materiale di partenza. L’acetato di metile può essere carbonilato in anidride acetica, che viene poi fatta reagire con etanolo e metanolo per produrre acetati di etile e di metile. L’acetato di etile può essere successivamente idrogenato in etanolo.
3.3.3. Conversione del gas di sintesi in etanolo
Sintesi mediante catalisi eterogenea
Gli sforzi per convertire il gas di sintesi (CO + H2) in etanolo si sono concentrati sulla modifica dei catalizzatori esistenti utilizzati per la sintesi del metanolo. Gli studi hanno dimostrato che l’incorporazione di metalli alcalini, cobalto o altri elementi può migliorare le rese di etanolo.
Istituti di ricerca come l’Institut Français du Pétrole hanno sviluppato catalizzatori complessi contenenti più elementi, tra cui rame, cobalto, cromo, potassio, lantanio e altri. Questi catalizzatori possono produrre miscele di alcol contenenti una quantità significativa di etanolo, metanolo e alcoli superiori.
Anche i catalizzatori metallici del gruppo del platino, come il rodio e il triossido di lantanio, hanno mostrato risultati promettenti nella conversione del gas di sintesi in etanolo. Questi catalizzatori possono raggiungere elevate selettività dell’etanolo a 200-240 °C e in condizioni di pressione atmosferica.
Sintesi mediante catalisi omogenea
La catalisi omogenea mediante complessi di rutenio è stata esplorata per la conversione del gas di sintesi in etanolo. I catalizzatori al rutenio, in combinazione con composti organici di fosforo, possono raggiungere selettività dell’etanolo superiori al 50%.
Vari solventi e additivi, come l’ossido di tripropilfosfina, il bromuro di tetrabutilfosfonio e i bromuri di alchiltrifenilfosfonio, sono stati studiati per ottimizzare la produzione di etanolo.
3.4. Produzione di etanolo mediante fermentazione
La fermentazione, un processo di biosintesi, è stata impiegata per secoli per produrre vari prodotti, tra cui l’etanolo. Mentre il mais è stata la materia prima principale negli ultimi decenni, possono essere utilizzati anche altri materiali agricoli, come melassa, cereali, canna da zucchero, barbabietole, frutta, siero di latte e liquori di scarto di solfito.
Sono in corso ricerche per esplorare la fattibilità della fermentazione di materiali di scarto come la spazzatura.
L’idoneità di diverse materie prime per la produzione di etanolo dipende da fattori quali disponibilità, costo, contenuto di zucchero e resa di etanolo. Alcuni prodotti agricoli, come le patate, potrebbero essere economicamente meno attraenti a causa della bassa resa di etanolo e degli elevati costi di trasporto.
I materiali fermentabili possono essere ampiamente classificati in tre tipi:
- Zuccheri: è possibile la fermentazione diretta degli zuccheri ottenuti da canna da zucchero, barbabietole da zucchero, melassa o frutta.
- Amidi: gli amidi di cereali, patate o radici richiedono l’idrolisi in zuccheri fermentabili utilizzando enzimi di malto o muffe.
- Cellulosa: i materiali ricchi di cellulosa, tra cui legno, residui agricoli e liquori di scarto di solfito, devono essere convertiti in zuccheri utilizzando acidi minerali prima della fermentazione.
La fermentazione è la conversione degli zuccheri in etanolo e anidride carbonica in condizioni anaerobiche. Mentre vari microrganismi possono fermentare gli zuccheri, i lieviti, in particolare Saccharomyces cerevisiae, sono comunemente utilizzati per la loro elevata tolleranza all’etanolo e la loro efficienza.
La fermentazione del glucosio avviene attraverso il percorso della glicolisi, che è una serie di reazioni enzimatiche che scompongono il glucosio in piruvato, producendo ATP (adenosina trifosfato) come energia. In condizioni anaerobiche, il piruvato viene convertito in acetaldeide, che viene poi ridotta in etanolo dall’alcol deidrogenasi.
Le condizioni di fermentazione ottimali variano a seconda del ceppo di lievito, della materia prima e delle specifiche del prodotto desiderato. I fattori chiave che influenzano la fermentazione sono:
- Temperatura: la maggior parte dei lieviti preferisce un intervallo di temperatura di 25-30 °C per una crescita ottimale e una produzione di etanolo.
- pH: il pH deve essere mantenuto entro un intervallo specifico, in genere tra 4,5 e 5,5, per garantire un’attività ottimale del lievito e prevenire la contaminazione batterica.
- Disponibilità di nutrienti: i lieviti richiedono un apporto bilanciato di nutrienti, tra cui azoto, fosforo e micronutrienti, per la crescita e una fermentazione efficiente.
- Concentrazione di zucchero: la concentrazione di zucchero deve essere mantenuta entro un intervallo adeguato per prevenire l’inibizione della crescita del lievito e della produzione di etanolo. Concentrazioni eccessive di zucchero possono portare a stress osmotico e a una riduzione dell’efficienza della fermentazione.
La fermentazione può essere condotta in processi batch o continui. Nella fermentazione in batch, un volume definito di terreno contenente zucchero e nutrienti viene inoculato con lievito e lasciato fermentare fino al raggiungimento della concentrazione di etanolo desiderata.
Nella fermentazione continua, un flusso costante di terreno viene immesso in un fermentatore mentre il brodo fermentato viene continuamente rimosso, consentendo una produzione di etanolo più efficiente e costante.
Durante la fermentazione possono sorgere diverse sfide, tra cui contaminazione batterica o fungina e inibizione dell’attività del lievito da alte concentrazioni di etanolo, accumulo di sottoprodotti e limitazione dei nutrienti.
4. Usi dell’etanolo
Fin dall’antichità, l’etanolo è stato utilizzato per un’ampia gamma di applicazioni. È utilizzato come componente di bevande alcoliche, solvente, materia prima per la sintesi chimica e combustibile.
Storicamente, l’etanolo derivato dalla fermentazione è stato utilizzato principalmente per bevande e prodotti chimici speciali, mentre l’etanolo sintetizzato chimicamente è stato utilizzato per l’industria. Tuttavia, alcuni paesi, come Brasile e India, utilizzano l’etanolo da fermentazione per applicazioni industriali.
Per facilitare l’uso dell’etanolo nei processi industriali a un costo inferiore, molti paesi hanno implementato politiche esenti da imposte per l’etanolo industriale e denaturato. Queste politiche spesso includono controlli finanziari, amministrativi e chimici per prevenire l’uso improprio di etanolo esente da imposte per le bevande.
Sulla base di queste normative, l’etanolo industriale è classificato in quattro tipi: alcol completamente denaturato, solventi proprietari e solventi industriali speciali, alcol appositamente denaturato ed etanolo puro (assoluto).
L’etanolo viene spesso aggiunto alla benzina come additivo per carburante, solitamente in rapporti che vanno dal 5% all’85% di etanolo (noto come E5 a E85) o come estensore per benzina. Grazie alla sua capacità di essere prodotto da una serie di risorse, come mais, canna da zucchero e materiali cellulosici, l’etanolo sta diventando sempre più popolare come fonte di carburante.
Oltre al suo utilizzo nelle bevande alcoliche tradizionali, l’etanolo è anche utilizzato nella produzione di vari liquori aromatizzati e come base per molti cocktail.
L’etanolo è un solvente ampiamente utilizzato, secondo solo all’acqua, principalmente nella produzione di articoli da toeletta, cosmetici, detergenti, disinfettanti, prodotti farmaceutici, rivestimenti superficiali e prodotti alimentari e farmaceutici.
Sebbene sia l’etanolo sintetico che quello di fermentazione possano essere utilizzati come solventi, l’etanolo di fermentazione è generalmente preferito, soprattutto in Europa, per applicazioni che coinvolgono il consumo umano o l’uso corporeo.
L’etanolo è un potente disinfettante comunemente utilizzato in ospedali, laboratori e altri contesti sanitari per uccidere batteri, virus e altri microrganismi dannosi. È anche utilizzato nella produzione di disinfettanti per le mani e spray disinfettanti.
L’etanolo viene utilizzato come materia prima per la produzione di vari prodotti chimici, tra cui acetaldeide, butadiene, etere dietilico, acetato di etile, etilammine, etilene, eteri glicolici e altri prodotti formati da reazioni con ossido di etilene o epossidi e aceto.
Alcuni paesi, come il Brasile, hanno creato industrie chimiche a base di etanolo per la produzione di prodotti chimici come l’acetaldeide, tradizionalmente derivati da prodotti petrolchimici in paesi con abbondanti risorse di petrolio greggio.
Il Brasile è stato il più grande produttore mondiale di etanolo dallo zucchero, con oltre il 95% della produzione totale nel 1985-1986. La maggior parte dell’etanolo prodotto in Brasile viene utilizzato come combustibile, mentre una frazione minore viene impiegata come materia prima chimica.
Nel 1978, l’India ha utilizzato oltre il 50% della sua produzione totale di etanolo per la produzione chimica di prodotti quali acetaldeide, acido acetico, anidride acetica, DDT, acetati organici, acetone, butanolo, polietilene, cloruro di polivinile e stirene.
5. Tossicologia dell’etanolo
L’etanolo presenta una tossicità orale acuta nei ratti, con valori di LD50 compresi tra 11,5 e 13,7 g/kg. Valori di LD50 simili di 9,5, 9,6, 9,9 e 6 g/kg sono stati segnalati rispettivamente nei topi, nelle cavie, nei conigli e nei cani.
L’etanolo può causare irritazioni da lievi a gravi all’occhio del coniglio, a seconda della concentrazione e della quantità utilizzata. Tuttavia, non è significativamente irritante per la pelle intatta.
L’inalazione di etanolo può causare irritazione delle mucose, eccitazione, atassia, sonnolenza, narcosi e, infine, morte per insufficienza respiratoria. Le concentrazioni letali per topi, porcellini d’India e ratti variano da 20.000 a 40.000 ppm dopo diverse ore di esposizione. Concentrazioni inferiori a 6.000 ppm possono essere generalmente tollerate senza sintomi di intossicazione.
La somministrazione orale ripetuta di etanolo a ratti giovani a una dose di 10 g/kg/giorno per 12 settimane ha determinato un basso aumento di peso e degenerazione del fegato grasso. Nelle scimmie alimentate con una dieta contenente il 40% delle calorie totali sotto forma di etanolo, sono stati osservati disturbi nel metabolismo dei trigliceridi, del colesterolo e dei fosfolipidi, insieme a degenerazione grassa nel fegato e nel miocardio.
La somministrazione di etanolo a ratti gravidi a livelli di 5 mL/kg ha aumentato l’embrioletalità e ha ritardato lo sviluppo fetale. Tuttavia, non sono state indotte gravi malformazioni nel feto.
Dosi di etanolo di 1–1,5 g/kg hanno causato mutazioni letali dominanti nei topi maschi, ma non nelle femmine. Nel test di Ames, l’etanolo non ha mostrato attività mutagena. Tuttavia, è stato osservato un aumento della rottura dei cromatidi nelle colture di fibroblasti umani, che è probabilmente un effetto citotossico piuttosto che un segno di mutagenicità.
L’etanolo viene metabolizzato principalmente nel fegato attraverso tre sistemi enzimatici:
- Alcol deidrogenasi
- Catalasi che agisce come perossidasi e accoppiata a un sistema che fornisce acqua ossigenata
- Un sistema microsomiale di ossidazione dell’etanolo che richiede NADPH come coenzima
Circa l’80% dell’etanolo assorbito viene inizialmente metabolizzato in acetaldeide, seguito da un’ulteriore ossidazione in acido acetico. L’acido acetico viene quindi degradato in anidride carbonica e acqua. L’ossidazione dell’acetaldeide in acido acetico è generalmente più rapida dell’ossidazione dell’etanolo in acetaldeide.
L’assunzione di etanolo negli esseri umani può produrre vari sintomi a seconda della concentrazione, come elencato nella Tabella 2. Tuttavia, le risposte individuali all’etanolo possono variare in modo significativo.
| Sintomo | Concentrazione di etanolo nel sangue, % |
|---|---|
| Inizio dell'incertezza | 0,06 - 0,08 |
| Comprensione lenta | 0,10 |
| Stupore | 0,11 - 0,15 |
| Ubriachezza | 0,16 |
| Intossicazione grave | 0,2 - 0,4 |
| Morte | 0,4 - 0,5 |
Negli individui affetti da alcolismo, la degenerazione del fegato grasso è spesso attribuita all’aumento della sintesi di acidi grassi dall’acetato, all’aumento del trasporto di lipidi dai depositi di grasso periferici al fegato e alla diminuzione dell’ossidazione degli acidi grassi.
L’infiltrazione grassa del miocardio e la leptomeningite cronica sono segnalate anche nell’alcolismo cronico e sono associate a sintomi specifici.
I limiti di esposizione ACGIH, OSHA e MAK per l’etanolo sono tutti fissati a 1000 ppm (1900 mg/m³).
Riferimenti
- Ethanol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a09_587.pub2
- Ethanol; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0520080112150719.a01.pub2
