Dicloroacetaldeide: proprietà, produzione e usi

La dicloroacetaldeide [79-02-7], o 2,2-dicloroetanale, è un’acetaldeide clorurata con formula chimica Cl2CHCHO. È un liquido incolore dall’odore pungente e irritante che è stato prodotto per la prima volta nel 1868 da F. Paterno mediante distillazione di diclorodietile acetale, CHCl2CH(OC2H5)2, con acido solforico.
Sommario
1. Proprietà fisiche della dicloroacetaldeide
La dicloroacetaldeide, nota anche come 2,2-dicloroetanale, è un liquido incolore con un caratteristico odore pungente. Ha diverse proprietà fisiche chiave:
- Peso molecolare: 112,94 g/mol
- Punto di fusione: da -37,6 a -37,4 °C
- Punto di ebollizione: 89,2 °C
- Densità (25 °C): 1,4113 g/cm³
- Momento di dipolo (30 °C): 2,36 D
- Solubilità: miscibile in acqua, formando un idrato, e facilmente solubile nei comuni solventi organici.
La dicloroacetaldeide reagisce facilmente con l’acqua per formare un monoidrato (CAS: 16086-14-9), noto come 2,2-dicloro-1,1-etandiolo. Questo solido cristallino presenta proprietà distinte:
- Peso molecolare: 130,96 g/mol
- Punto di fusione: 35–50 °C
- Punto di ebollizione: 85–95 °C a 101,3 kPa
- Densità (20 °C): 1,53–1,54 g/cm³
- Vapore pressione: 6,5 kPa a 20 °C, 25 kPa a 50 °C
- Solubilità: solubile in solventi organici polari, insolubile in solventi non polari.
- Punto di infiammabilità: circa 95 °C
- Temperatura di accensione: circa 605 °C
2. Reazioni chimiche della dicloroacetaldeide
La dicloroacetaldeide subisce una polimerizzazione spontanea durante lo stoccaggio, formando un polimero solido e incolore. Questo polimero viene riconvertito nella sua forma monomerica riscaldandolo a 120 °C.
La dicloroacetaldeide presenta le reazioni caratteristiche delle aldeidi, come ossidazione, riduzione e condensazione.
La reazione di ossidazione con acido cromico produce acido dicloroacetico.
La riduzione della dicloroacetaldeide con etilalluminio produce 2,2-dicloroetanolo.

L’autocondensazione porta alla formazione di 2,2,4,4-tetracloroacetaldolo.
La reazione di condensazione della dicloroacetaldeide con l’etilbenzene produce p,p’-dietil-1,1-difenil-2,2-dicloroetano, un insetticida noto come Pertano.

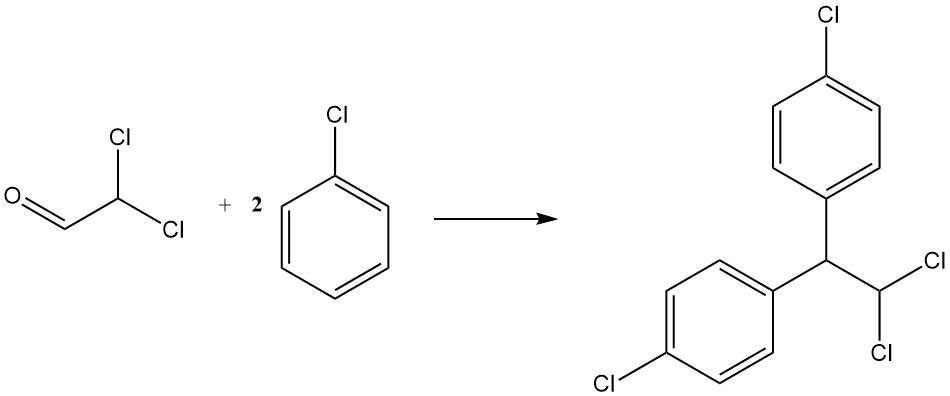
La condensazione con clorobenzene produce p,p’-dicloro-1,1-difenil-2,2-dicloroetano, un altro insetticida noto come TDE o DDD. È rappresentato dalla seguente equazione:
CHCl2CHO + 2 C6H5Cl → CHCl2CH(C6H4Cl)2 + H2O
3. Produzione di dicloroacetaldeide
Il processo di produzione industriale più importante per la dicloroacetaldeide è la clorurazione dell’acetaldeide o della paraldeide. Un altro metodo per produrre dicloroacetaldeide pura è l’ipoclorurazione del 1,2-dicloroetilene.
3.1. Clorurazione dell’acetaldeide o della paraldeide
Questo metodo genera dicloroacetaldeide insieme a cloroacetaldeide e tricloroacetaldeide. Alte rese sono ottenibili con catalizzatori come tricloruro di antimonio (83%) o acido fosforico (>90%). L’ossiclorurazione durante il processo Wacker per la produzione di acetaldeide può anche produrre dicloroacetaldeide come sottoprodotto.
3.2. Ipoclorurazione di 1,2-dicloroetilene
Questo processo offre dicloroacetaldeide pura, priva di impurità come cloralio e monocloroacetaldeide. Comporta il trattamento di 1,2-dicloroetilene con una mole di cloro a specifiche condizioni di temperatura e solvente.
3.3. Clorazione di etanolo
La clorazione controllata di etanolo in presenza di cloruro di nichel(II) può produrre principalmente dicloroacetaldeide, insieme a un po’ di cloralio e monocloroacetaldeide. L’emiacetale risultante può essere utilizzato direttamente senza isolare dicloroacetaldeide pura o il suo idrato.

4. Usi della dicloroacetaldeide
La dicloroacetaldeide e i suoi acetali sono utilizzati nell’industria farmaceutica per la produzione di triclorometiazide, un diuretico utilizzato per trattare condizioni come ipertensione ed edema, e mitotano (1,1-dicloro-2-(o-clorofenil)-2-(p-clorofenil)etano), un agente citostatico utilizzato nel trattamento di specifici tumori delle ghiandole surrenali.
Viene inoltre utilizzato nella produzione di insetticidi come Perthane e TDE o DDD.
5. Tossicologia della dicloroacetaldeide
La dicloroacetaldeide presenta potenziali irritazioni respiratorie, sebbene siano assenti dati formali sui test di tossicità. Come misura precauzionale, deve essere maneggiata con cura.
6. Polimeri di dicloroacetaldeide
6.1. Esacloroparaldeide
- Formula: C6H6Cl6O3
- Massa molare: 338,83 g/mol
- Aspetto: Cristalli incolori
- Punto di fusione: 131-132 °C
- Punto di ebollizione: 210–220 °C (decomposizione)
L’esacloroparaldeide è prodotta dalla reazione di dicloroacetaldeide con acidi di Lewis come tricloruro di antimonio, cloruro di ferro (III) o trifluoruro di boro o mediante clorurazione diretta della paraldeide con 6-7 moli di cloro a 35 °C in condizioni anidre.
Forma idrato di dicloroacetaldeide in presenza di acidi acquosi e si decompone in dicloroacetaldeide a temperature elevate.
6.2. Polidicloroacetaldeidi
- Formula: (C2H2Cl2O)n
- Solubilità: variabile a seconda del grado di polimerizzazione, generalmente solubile nei comuni solventi organici.
Le forme cristalline delle polidicloroacetaldeidi sono prodotte trattando la dicloroacetaldeide a -78 °C con composti organometallici come il trietilalluminio, mentre le forme amorfe sono preparate utilizzando acidi di Lewis a temperature inferiori a 0 °C.
Questi polimeri sono solubili in acido solforico concentrato a 100 °C con scolorimento e in dimetilformammide. Possono formare copolimeri con altre aldeidi.
Riferimento
- Chloroacetaldehydes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
