Cumene: proprietà, reazioni, produzione, usi e tossicologia
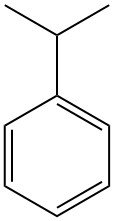
Cos’è il cumene?
Il cumene, noto anche come isopropilbenzene o 2-fenilpropano, è un idrocarburo aromatico con formula chimica C9H12. È un liquido incolore e infiammabile con un caratteristico odore simile alla benzina.
Il cumene è presente come costituente minore del petrolio greggio e dei combustibili derivati dal petrolio. Viene utilizzato principalmente come intermedio nell’industria chimica, in particolare nella produzione di fenolo e acetone.
Sommario
1. Proprietà fisiche del cumene
Il cumene è un liquido incolore e volatile con un caratteristico odore aromatico. È miscibile con molti solventi organici, tra cui etanolo, etere dietilico, acetone, benzene, etere di petrolio e tetracloruro di carbonio. La sua solubilità in acqua è bassa, circa 61,3 mg/L a 25 °C.
Il cumene forma azeotropi con acqua, acidi carbossilici alifatici, eteri di glicole etilenico, cicloesanolo e cicloesanone.
Il cumene ha una soglia di odore variabile, con valori riportati compresi tra 0,008 e 0,13 ppm. Mentre alcuni studi riportano una percezione olfattiva umana pari a 0,0032 ppm, altri citano valori più vicini a 0,012 ppm. Il rilevamento degli odori non è un metodo affidabile per valutare l’esposizione pericolosa al cumene.
I limiti di esplosività per le miscele cumene-aria sono compresi tra lo 0,8% e il 6,0% in volume. Ciò corrisponde a una concentrazione di cumene di 40-300 g/m³.
La Tabella 1 elenca tutte le principali proprietà fisiche del cumene.
| Proprietà | Valore |
|---|---|
| Numero CAS | 98-82-8 |
| Formula chimica | C9H12 |
| Massa molare | 120,2 |
| Punto di congelamento, °C | −96,03 |
| Punto di ebollizione, °C | 152,39 |
| Densità, g/cm3 (0 °C) | 0,8797 |
| Densità, g/cm3 (20 °C) | 0,8633 |
| Densità, g/cm3 (40 °C) | 0,8465 |
| Indice di rifrazione, n20D | 1,4915 |
| Conduttività termica a 25 °C, W/(m·K) | 0,124 |
| Viscosità, mPa·s (0 °C) | 1,073 |
| Viscosità, mPa·s (20 °C) | 0,790 |
| Viscosità, mPa·s (40 °C) | 0,610 |
| Tensione superficiale a 20 °C, mN/m | 28,2 |
| Pressione di vapore a 35 °C, kPa | 1 |
| Pressione di vapore a 100 °C, kPa | 21 |
| Pressione di vapore a 120 °C, kPa | 40 |
| Pressione di vapore a 140 °C, kPa | 73 |
| Pressione di vapore a 180 °C, kPa | 196 |
| Punto di infiammabilità, °C | 33 |
| Temperatura di autoaccensione, °C | 425 |
| Limiti di infiammabilità in aria, vol % (inferiore) | 0,9 |
| Limiti di infiammabilità in aria, vol % (superiore) | 6,5 |
| Temperatura critica, °C | 358,0 |
| Pressione critica, kPa | 3220 |
| Densità critica, g/cm3 | 0,280 |
| Calore di vaporizzazione al punto di ebollizione, J/g | 312 |
| Calore di vaporizzazione a 25 °C, J/g | 367 |
| Calore di formazione (liquido) a 25 °C, J/mol | −44.150 |
| Energia libera (vapore) a 25 °C, J/mol | 137.000 |
| Calore di combustione (lordo, acqua liquida), J/g | 43.370 |
| Calore di combustione (netto, vapore acqueo), J/g | 41.170 |
| Capacità termica (liquido) a 25 °C, J/(mol·K) | 197 |
| Capacità termica (vapore ideale) a 25 °C, J/(mol·K) | 153 |
2. Reazioni chimiche del cumene
L’ossidazione del cumene a cumene idroperossido è la reazione industriale più importante del cumene. Altre reazioni includono la tipica sostituzione aromatica (nitrazione, solfonazione, alogenazione, alchilazione e acilazione), alogenazione della catena laterale, idrogenazione e combustione.
2.1. Il processo del cumene
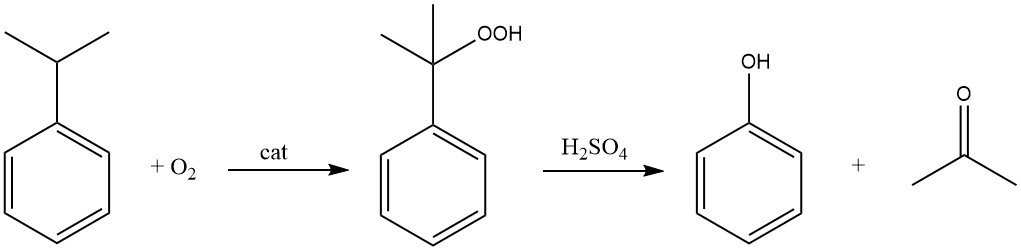
Il processo del cumene, noto anche come processo Hock, inizia con la sintesi del cumene stesso, seguita da una conversione in due fasi in fenolo e acetone.
Il cumene viene ossidato dall’aria (ossigeno) in presenza di un iniziatore radicalico per formare cumene idroperossido. Questa reazione ha come bersaglio l’atomo di idrogeno terziario sul carbonio legato all’anello benzenico.
Utilizzando un catalizzatore acido come l’acido solforico, il cumene idroperossido viene quindi scisso per produrre fenolo e acetone.
2.2. Reazioni sull’anello aromatico
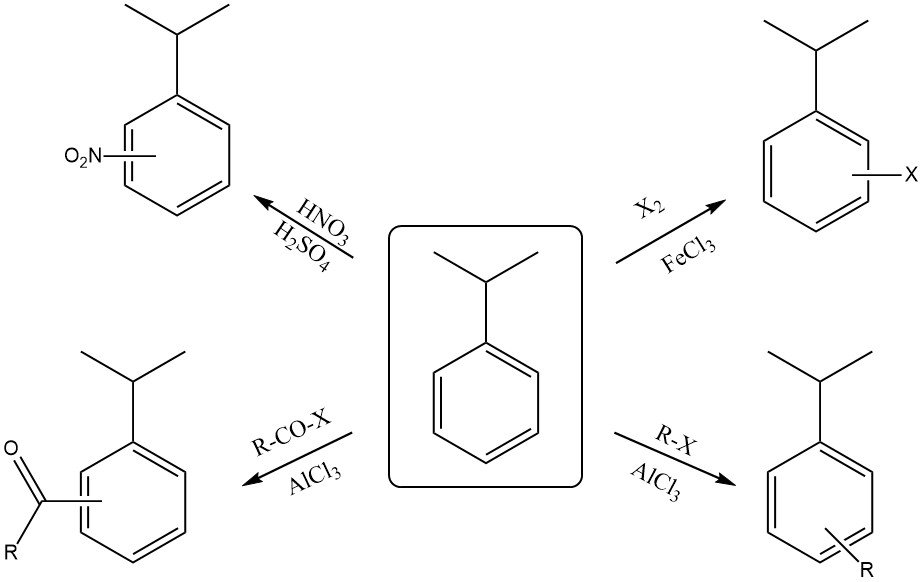
Il cumene reagisce con una miscela di acido nitrico concentrato e acido solforico per formare una miscela di orto-nitrocumene e para-nitrocumene. L’isomero para è tipicamente il prodotto principale a causa dell’ingombro sterico dovuto al gruppo isopropilico voluminoso.
L’alogenazione dell’anello con reagenti come cloro o bromo in presenza di un catalizzatore acido di Lewis (FeCl3 o FeBr3) produce anche la sostituzione orto e para.
La reazione con acido solforico fumante produce acido cumensulfonico.
Il cumene può reagire con un alogenuro alchilico e un catalizzatore acido di Lewis (AlCl3 ) per formare alchilcumene.
La reazione del cumene con un alogenuro acilico in presenza di un catalizzatore acido di Lewis (AlCl3) produce un orto- e un para-acilcumene.
2.3. Reazioni sulla catena laterale alchilica
L’idrogeno benzilico (l’idrogeno sul carbonio direttamente legato all’anello benzenico) è particolarmente suscettibile alle reazioni radicaliche a causa della stabilità del radicale benzilico risultante.
Il cumene può essere ossidato da agenti ossidanti forti come il permanganato di potassio o l’acido cromico. Questa reazione ossida completamente il carbonio benzilico a un gruppo acido carbossilico per produrre acido benzoico e non fenolo.
In condizioni di alta temperatura, luce UV o in presenza di iniziatori radicalici, alogeni come cloro o bromo reagiranno esclusivamente in posizione benzilica per sostituire l’atomo di idrogeno.
L’idrogenazione dell’anello aromatico produce isopropilcicloesano utilizzando catalizzatori come Ni, Pt o Pd.
Come altri idrocarburi, il cumene brucia in presenza di ossigeno per produrre anidride carbonica e acqua.
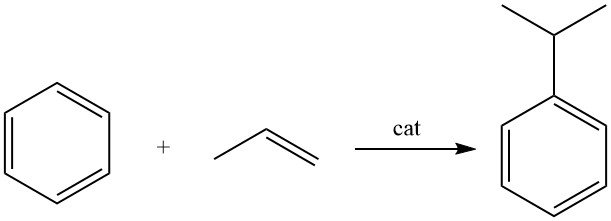
3. Produzione industriale del cumene
Il cumene viene prodotto mediante alchilazione del benzene con propene in presenza di un catalizzatore acido.
Storicamente, il cumene veniva sintetizzato in grandi quantità per essere utilizzato come componente della benzina per aviazione durante la Seconda Guerra Mondiale. Pur avendo un elevato potere calorifico e un elevato numero di ottano, non è più competitivo come carburante. La sua presenza nella benzina moderna è un sottoprodotto minore di processi di raffinazione come il reforming catalitico e lo steam cracking.
La produzione di cumene ha visto progressi significativi con lo sviluppo di nuove tecnologie catalitiche, in particolare sistemi a base di zeolite, che hanno sostituito i vecchi metodi che utilizzavano acido fosforico solido e cloruro di alluminio. Questo cambiamento tecnologico, iniziato a metà degli anni ’90, ha rivoluzionato il settore.
Oltre alla produzione sintetica, il cumene è naturalmente presente nel petrolio greggio e nei prodotti petroliferi raffinati.
3.1. Reazioni di alchilazione e transalchilazione
Il cumene viene prodotto attraverso l’alchilazione del benzene con propilene in fase liquida utilizzando un catalizzatore acido.
Questa reazione diretta è termodinamicamente favorevole. Tuttavia, la conversione del propilene può essere limitata dall’attività del catalizzatore e dal trasferimento di massa. Sebbene l’n-propilbenzene sia termodinamicamente più stabile del cumene, viene prodotto solo in quantità minori perché il carbonio secondario della molecola di propilene è più reattivo.
Il carbonio secondario diventa un carbocatione sul sito acido del catalizzatore, che poi reagisce con il benzene per formare cumene. Un’elevata selettività per il cumene rispetto all’n-propilbenzene, con un rapporto fino a 10.000:1, è importante poiché questi isomeri non sono facilmente separabili tramite distillazione.
Può verificarsi anche un’ulteriore alchilazione, in cui il cumene reagisce con altro propilene per produrre poliisopropilbenzeni, inclusi diisopropilbenzeni, triisopropilbenzeni e tetraisopropilbenzeni.
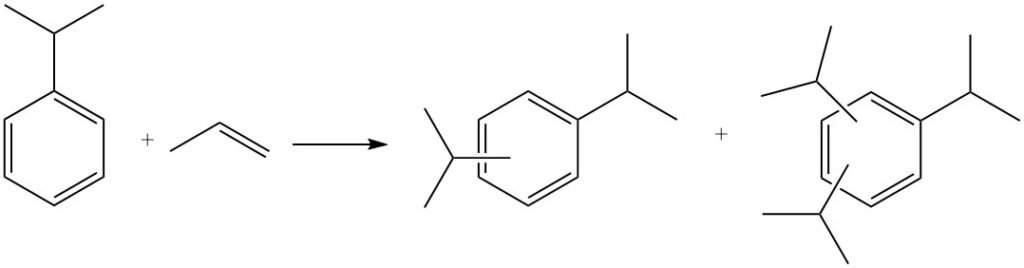
I poliisopropilbenzeni possono essere riconvertiti in cumene reagendo con il benzene in un processo chiamato transalchilazione.
L’alchilazione è una reazione esotermica, mentre la transalchilazione è essenzialmente isotermica. Durante l’alchilazione si utilizza tipicamente un eccesso di benzene per gestire la temperatura, ridurre al minimo la formazione di poliisopropilbenzeni e prevenire l’oligomerizzazione del propilene.
Sebbene un elevato rapporto benzene/propilene favorisca la selettività del cumene, aumenta anche i costi e l’energia necessari per recuperare il benzene in eccesso mediante distillazione.
3.2. Produzione di cumene mediante processo con acido fosforico solido (SPA)
Prima del 1996, il processo SPA era il metodo più comune per la produzione di cumene, rappresentando oltre l’80% della produzione globale. Questo processo utilizzava acido fosforico supportato su allumina come catalizzatore.
In questo metodo, brevettato a livello mondiale da UOP, una miscela di propilene liquido (spesso una miscela propano-propilene) e benzene, insieme a una piccola quantità di acqua per mantenere l’attività del catalizzatore, veniva preriscaldata e immessa in un reattore a letto fisso operante a 180-200 °C e circa 550 psig.
Il rapporto molare tipico benzene/propilene variava da 5:1 a 8:1. I reattori funzionavano in modo adiabatico e il calore rilasciato dalla reazione veniva parzialmente utilizzato per vaporizzare il propano riciclato.
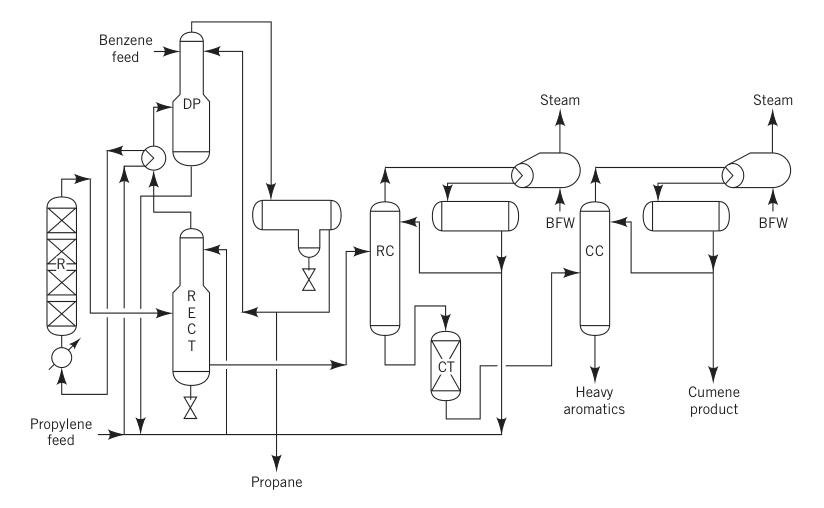
R = reattore; RECT = raddrizzatore; DP = depropanizzatore; RC = colonna di riciclo; CT = dispositivo di trattamento dell'argilla; CC = colonna di cumene; e BFW = acqua di alimentazione della caldaia.
Il processo SPA era popolare per il suo investimento iniziale ridotto e per la flessibilità delle materie prime, poiché poteva utilizzare propilene di grado raffineria e benzene a bassa purezza. I sottoprodotti, come gli aromatici pesanti, potevano essere utilizzati per la miscelazione della benzina, il che rappresentava un vantaggio fondamentale per le raffinerie.
Tuttavia, questo processo aveva una resa relativamente bassa (circa il 5% di perdita) e produceva impurità. I tentativi di recuperare e transalchilare gli aromatici pesanti non ebbero successo a causa delle elevate concentrazioni di impurità come gli esilbenzeni.
3.3. Produzione di cumene mediante il processo del cloruro di alluminio
Un altro metodo più vecchio per la produzione di cumene utilizzava un complesso di cloruro di alluminio come catalizzatore e operava a temperature inferiori a 100 °C e a bassa pressione. Questo processo richiedeva materie prime di purezza più elevata e un’attenta disidratazione del benzene per mantenere l’attività del catalizzatore e ridurre la corrosione.
Il processo al cloruro di alluminio offriva il vantaggio di poter transalchilare i poliisopropilbenzeni a cumene, con conseguenti rese più elevate, ma richiedeva costosi reattori resistenti alla corrosione, come quelli in Hastelloy o con rivestimento in vetro, un lavaggio intensivo degli effluenti e creava problemi ambientali associati allo smaltimento del catalizzatore.
3.4. Produzione di cumene con moderni processi a base di zeolite
Dalla metà degli anni ’90, l’industria del cumene si è rapidamente spostata verso tecnologie di alchilazione a base di zeolite. Questi catalizzatori hanno eliminato i problemi di corrosione e smaltimento dei rifiuti associati ai processi precedenti, garantendo al contempo rese elevate, elevata selettività e un’elevatissima purezza del prodotto.
I moderni catalizzatori a zeolite possono essere rigenerati ripetutamente, riducendo gli sprechi e i costi operativi. Consentono inoltre di ridurre il rapporto di alimentazione benzene/propilene, riducendo le dimensioni del sistema di distillazione e il consumo energetico.
Un esempio degno di nota è il processo ExxonMobil/Badger, che utilizza un catalizzatore proprietario MCM-22. In questo processo in fase liquida, propilene e benzene vengono premiscelati e immessi in un reattore di alchilazione a letto fisso, dove il propilene viene completamente consumato. L’effluente viene quindi purificato attraverso una serie di colonne di distillazione.
Il benzene in eccesso viene riciclato e i poliisopropilbenzeni vengono recuperati e inviati a un reattore di transalchilazione separato, dove reagiscono con il benzene per formare altro cumene.
Questo processo raggiunge rese quasi stechiometriche e un prodotto di elevata purezza. Gli impianti SPA o di cloruro di alluminio esistenti possono essere convertiti a questa tecnologia con aumenti di capacità che vanno dal 30 a oltre il 100% con investimenti relativamente modesti.
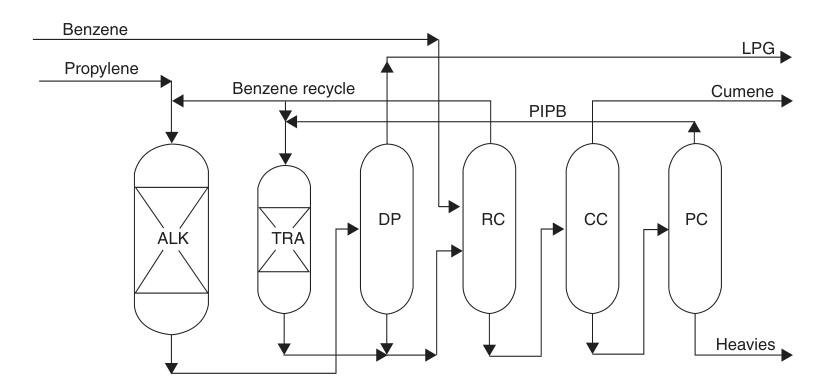
ALK = reattore di alchilazione; TRA = reattore di transalchilazione; DP = propanizzatore; RC = colonna di riciclo; CC = colonna cumene; e PC = colonna di poliisopropilbenzeni.
Anche altre aziende, tra cui CDTech, Dow/Kellogg e UOP, hanno sviluppato tecnologie proprietarie basate sulla zeolite. Ad esempio, il processo Q-Max di UOP utilizza una nuova generazione di catalizzatori che possono essere rigenerati ripetutamente, eliminando la necessità di smaltimento.
Questa tecnologia può anche espandere la capacità degli impianti esistenti con un investimento di capitale minimo. Il passaggio a questi processi avanzati ha permesso a molti impianti di cumene di aumentare significativamente la propria capacità produttiva.
4. Usi del cumene
Il cumene ha un numero di ottano di 109, paragonabile a quello del toluene. Negli anni ’40 questa proprietà lo rese prezioso come additivo per la benzina avio.
Il cumene è ora utilizzato quasi interamente (95% della produzione totale) come intermedio per la produzione di fenolo e acetone. In presenza di ossigeno, il cumene subisce un’ossidazione a idroperossido di cumene, che, mediante scissione catalizzata da acidi, produce fenolo e acetone.
La produzione globale di cumene ha raggiunto circa 18 milioni di tonnellate nel 2020 e si prevede un aumento, trainata principalmente dalla crescente domanda di bisfenolo A nella produzione di policarbonato e resine epossidiche.
Tra i sottoprodotti minori formati durante il processo di ossidazione del cumene figurano α-metilstirene, acetofenone, alcoli cumilici e diisopropilbenzene.
L’α-metilstirene viene utilizzato nella produzione di resine acrilonitrile-butadiene-stirene (ABS), p-cumilfenolo e altri intermedi.
L’idroperossido di cumene viene utilizzato anche come iniziatore radicalico nella copolimerizzazione dello stirene con butadiene e acrilati e nella reticolazione di resine poliestere insature. La reazione dell’idroperossido di cumene con l’α-metilstirene produce il dicumilperossido, un iniziatore per la reticolazione radicalica delle poliolefine.
L’idrogenazione del cumene produce isopropilcicloesano (idrocumene), un solvente cicloalifatico altobollente (154,5 °C) e bassocongelante (-90 °C).
Il cumene viene utilizzato anche in piccole quantità come diluente per vernici, smalti e lacche, e come solvente per grassi e resine, talvolta sostituendo il benzene nelle applicazioni industriali.
Secondo il Consumer Product Information Database (2022), il cumene è presente in oltre cento prodotti di consumo e per la casa, inclusi pesticidi e detergenti.
5. Tossicologia del cumene
L’esposizione al cumene avviene principalmente attraverso l’inalazione di aria contaminata in ambienti lavorativi e dall’evaporazione di prodotti petroliferi. Ulteriori fonti includono fumo di sigaretta, cibo e acqua contaminati e ingestione accidentale o assorbimento cutaneo.
L’inalazione è la via più significativa, poiché il cumene viene prontamente assorbito attraverso i polmoni, metabolizzato nel fegato in composti idrosolubili ed escreto efficacemente, principalmente nelle urine, senza evidenza di accumulo a lungo termine.
Studi tossicocinetici sull’uomo confermano che il cumene e il suo metabolita 2-fenil-2-propanolo vengono eliminati entro 40 ore dall’esposizione.
L’esposizione acuta ad alte concentrazioni di cumene induce depressione del sistema nervoso centrale, che si manifesta con mal di testa, vertigini, narcosi, nausea e perdita di coscienza a livelli ben al di sopra dei limiti di esposizione professionale.
Il cumene è anche un irritante primario per la pelle, gli occhi e le vie respiratorie. Il contatto ripetuto o prolungato con la pelle può causare dermatiti ed eruzioni cutanee, mentre l’ingestione comporta un alto rischio di polmonite ab ingestis.
In studi su animali, l’inalazione a breve termine a concentrazioni superiori a 1000 ppm ha indotto effetti neurotossici reversibili, mentre l’esposizione a dosi molto elevate ha portato a grave tossicità del sistema nervoso centrale e morte.
La DL50 orale nei ratti è di circa 1400 mg/kg, mentre i valori della CL50 inalatoria variano tra 2000 e 8000 ppm a seconda della specie.
| Via di esposizione | Sintomi | Interventi di primo soccorso |
|---|---|---|
| Inalazione e olfatto |
Vertigini Incoordinazione Sonnolenza Mal di testa |
Portare il soggetto all'aria aperta e riposare Consultare un medico se necessario |
| Contatto con la pelle |
Pelle secca Eruzioni cutanee Prurito Arrossamento cutaneo |
Rimuovere immediatamente gli indumenti contaminati e lavare la pelle con acqua. Alcuni riferimenti suggeriscono di lavare la pelle con acqua e sapone dopo il risciacquo. Se l'irritazione persiste dopo il lavaggio, consultare un medico. |
| Contatto con gli occhi |
Irritazione oculare Arrossamento |
Sciacquare immediatamente gli occhi con abbondante acqua, sollevando occasionalmente le palpebre inferiori e superiori, in caso di contatto con la sostanza chimica. Consultare immediatamente un medico. |
| Deglutizione e ingestione |
Vertigini Incoordinazione Sonnolenza Mal di testa |
Rischio di aspirazione. Si raccomandano collutori e collutori. Evitare di indurre il vomito. Consultare immediatamente un medico. |
I dati cronici sull’uomo sono limitati, ma studi sugli animali indicano lievi effetti ematologici e organici a seguito di esposizione subcronica per inalazione, come congestione passiva di polmoni, fegato, reni e milza. Non sono stati segnalati effetti immunotossici consistenti.
Le prove di tossicità riproduttiva e dello sviluppo sono deboli, con studi che suggeriscono un rapido metabolismo ed escrezione senza effetti significativi sulla fertilità o sullo sviluppo della prole.
I test di genotossicità hanno prodotto risultati per lo più negativi in sistemi batterici, in vitro e in vivo, sebbene alcuni studi su animali ad alte dosi abbiano riportato deboli effetti citogenetici.
I dati sulla cancerogenicità nell’uomo sono inadeguati, ma studi a lungo termine sull’inalazione nei roditori hanno dimostrato un aumento dell’incidenza di tumori al fegato, ai reni e ai polmoni, portando il National Toxicology Program statunitense a classificare il cumene come “ragionevolmente prevedibile come cancerogeno per l’uomo”.
Anche l’Agenzia Internazionale per la Ricerca sul Cancro (IARC) ha elencato il cumene come possibile cancerogeno per l’uomo (Gruppo 2B).
L’Amministrazione per la Sicurezza e la Salute sul Lavoro (OSHA) e l’American Conference of Governmental Industrial Hygienists (ACGIH) hanno stabilito un limite di esposizione medio ponderato su 8 ore e un valore limite di soglia di 50 ppm (245 mg/m³).
Sebbene gli effetti acuti siano generalmente reversibili, la lenta induzione ed eliminazione della sua azione deprimente sul sistema nervoso centrale suggerisce potenziali rischi cumulativi.
Riferimenti
1. Hwang, S.Y. and Chen, S.S. (2010). Cumene. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0321130519030821.a01.pub3
2. Abdolmaleki, G.; Bayrami, Z. Cumene. In Encyclopedia of Toxicology, 4th ed.; Wexler, P., Ed.; Academic Press, 2024; pp 337–343. DOI: 10.1016/B978-0-12-824315-2.00295-5
3. Dimian, A.C. and Bildea, C.S. (2008). Alkylation of Benzene by Propylene to Cumene. In Chemical Process Design (eds A.C. Dimian and C.S. Bildea). https://doi.org/10.1002/9783527621583.ch6
4. Gollapudi, B. B.; Williams, A. L.; Bus, J. S. “A review of the genotoxicity of the industrial chemical cumene.” Mutat. Res./Rev. Mutat. Res., 2021, 787, 108364. DOI: 10.1016/j.mrrev.2021.108364
5. Schmidt, R., Griesbaum, K., Behr, A., Biedenkapp, D., Voges, H.-W., Garbe, D., Paetz, C., Collin, G., Mayer, D. and Höke, H. (2014). Hydrocarbons. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a13_227.pub3
