Cloruro di acetile: proprietà, reazioni, produzione e usi
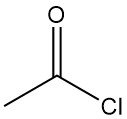
Cos’è il cloruro di acetile?
Il cloruro di acetile, noto anche come cloruro di etanoile, è un composto organico con formula molecolare CH3COCl. È un liquido incolore, corrosivo e fortemente irritante, dall’odore soffocante.
Concentrazioni di cloruro di acetile anche solo di 0,5 ppm inducono lacrimazione e causano bruciore agli occhi, alle vie nasali e alla gola. Il cloruro di acetile è tossico perché reagisce facilmente con i gruppi idrossilici, solfidrilici e amminici, producendo modificazioni che inibiscono l’attività di enzimi essenziali nei tessuti viventi.
Sommario
1. Proprietà fisiche del cloruro di acetile
Il cloruro di acetile è un liquido incolore e corrosivo. Le principali proprietà fisiche del cloruro di acetile sono riassunte nella Tabella 1.
| Proprietà | Valore |
|---|---|
| Numero di registro CAS | 75-36-5 |
| Formula molecolare | C2H3OCl |
| Massa molare (g/mol) | 78,50 |
| Punto di congelamento (°C) | -112,0 |
| Punto di ebollizione (°C, 101,3 kPa) | 50,2 |
| Densità (g/mL) a 4 °C | 1,1358 |
| Densità (g/mL) a 20 °C | 1,1051 |
| Densità (g/mL) a 25 °C | 1,0982 |
| Entalpia standard di formazione (ΔHf, kJ/mol) | -243,93 |
| Entalpia di vaporizzazione al punto di ebollizione (ΔHv, kJ/g) | 0,36459 |
| Indice di rifrazione (nD20) | 1,38976 |
2. Reazioni chimiche del cloruro di acetile
Il cloruro di acetile subisce un’ampia gamma di reazioni chimiche ed è utilizzato nella sintesi organica per:
- Acetilazione elettrofila di areni, alcheni, alchini, alcani saturi, composti organometallici ed enolati (su C o O)
- Scissione di eteri
- Esterificazione di alcoli stericamente non impediti o sensibili agli acidi
- Generazione di soluzioni di cloruro di idrogeno anidro in metanolo
- Come agente disidratante
- Come Solvente per reazioni organometalliche
- Per la deossigenazione dei solfossidi
- Come scavenger di cloro e bromo
- Come fonte di chetene
- Per l’acetilazione nucleofila
In solventi inerti come il disolfuro di carbonio o l’etere di petrolio, il cloruro di acetile reagisce con idrocarburi aromatici e olefine per produrre chetoni. Queste reazioni sono catalizzate da acidi di Lewis, con attività catalitica crescente nell’ordine:
ZnCl2 < BiCl3 < TeCl4 < TiCl4 < SnCl4 < TeCl2 < FeCl3 < SbCl5 < AlCl3
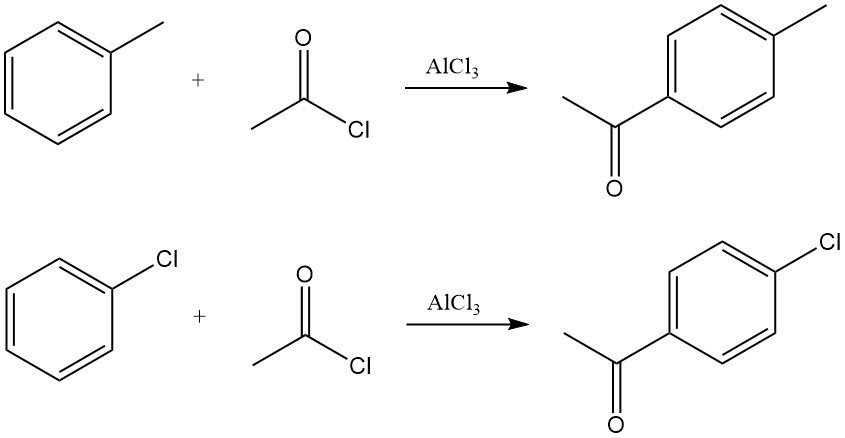
Gli areni reagiscono con il cloruro di acetile in presenza di acidi di Lewis, tipicamente cloruro di alluminio, per produrre aril metil chetoni. La reazione procede attraverso la generazione dello ione acilio, che subisce una sostituzione elettrofila aromatica.
Ad esempio, l’acetilazione del toluene produce prevalentemente p-metilacetofenone, mentre l’acetilazione del clorobenzene produce p-cloroacetofenone con elevata selettività.
Gli alcheni reagiscono con il cloruro di acetile in condizioni di Friedel-Crafts per formare miscele di cloroalchilmetilchetoni e prodotti correlati. Gli alcheni elettron-deficienti come l’etilene e il cloruro di allile danno buone rese, mentre gli alcheni superiori spesso subiscono riarrangiamenti.
Ad esempio, la reazione del cloruro di acetile con cicloesene utilizzando AlCl3 come catalizzatore produce 2-clorocicloesilmetilchetone e 4-clorocicloesilmetilchetone.

Gli alchini subiscono acetilazione elettrofila in condizioni simili. L’acetilene trattato con cloruro di acetile e cloruro di alluminio produce β-clorovinil metil chetone, mentre gli alchini superiori danno prodotti chetonici con rese da moderate ad alte.
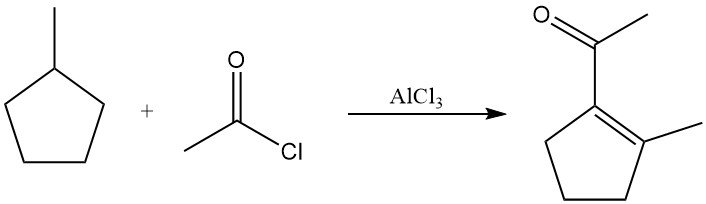
In presenza di cloruro di acetile e cloruro di alluminio a temperatura elevata, gli alcani saturi subiscono deidrogenazione ad alcheni, seguita da acetilazione. I prodotti sono tipicamente vinilmetil chetoni o alchilmetil chetoni saturi. Il metilciclopentano, ad esempio, produce 1-acetil-2-metilciclopentene con rese significative.
Il cloruro di acetile reagisce con un’ampia gamma di composti organometallici, tra cui i reagenti di Grignard, organolitio, organozinco e organocuprato, per dare metilchetoni. Catalizzatori a base di metalli di transizione come sali di palladio o rame vengono spesso impiegati per migliorare la selettività e le rese.
Gli enolati metallici reagiscono con il cloruro di acetile per formare β-dichetoni. La reazione può anche dare prodotti O-acetilati competitivi a seconda del controione metallico. L’uso di enolati di zinco o rame migliora la selettività per la C-acetilazione. Trasformazioni correlate includono l’acetilazione di acetali ed enammine di sililchetene, fornendo accesso a esteri e chetoni funzionalizzati.
Chetoni e β-cheto esteri possono essere convertiti in enol acetati utilizzando il cloruro di acetile. La reazione può procedere attraverso enolati preformati o eteri di silil enol. Ad esempio, i chetoni steroidei possono essere convertiti in enol acetati coniugati mediante trattamento con cloruro di acetile in presenza di basi amminiche.
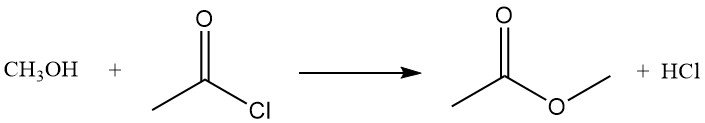
Il cloruro di acetile reagisce con gli alcoli per dare esteri o cloruri alchilici. Gli alcoli primari solitamente formano esteri, mentre gli alcoli secondari e terziari spesso danno cloruri per sostituzione. La reazione del metanolo con il cloruro di acetile produce acetato di metile e acido cloridrico, ed è utilizzata come metodo per preparare soluzioni di acido cloridrico anidro in metanolo.
Gli eteri ciclici e aciclici possono essere scissi dal cloruro di acetile in presenza di sali alogenuri o acidi di Lewis. Ad esempio, il tetraidrofurano reagisce con il cloruro di acetile e lo ioduro di sodio per formare acetato di 4-iodobutile e, in presenza di un acido di Lewis come ZnCl2, per formare acetato di clorobutile con una resa di circa il 76%.
Questa proprietà rende il cloruro di acetile utile nella deprotezione dei gruppi protettivi degli etere.

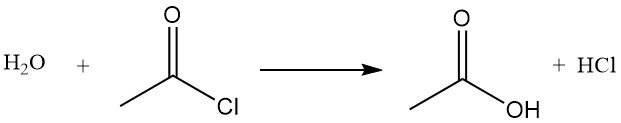
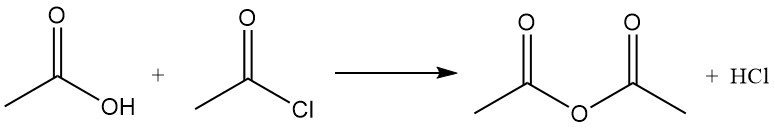
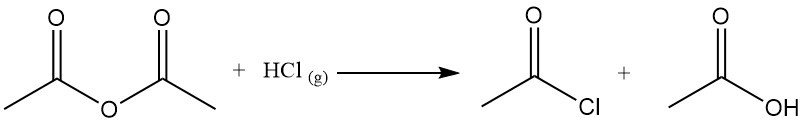
Il cloruro di acetile agisce come agente disidratante reagendo con l’acqua per formare acido acetico e acido cloridrico. Promuove la ciclizzazione degli acidi dicarbossilici in anidridi, dei chetoacidi in lattoni e dei nitrocomposti in ossidi di nitrile. Viene anche utilizzato nella conversione degli idroperossidi in chetoni insaturi. Ad esempio, reagisce con l’acido acetico per produrre anidride acetica.
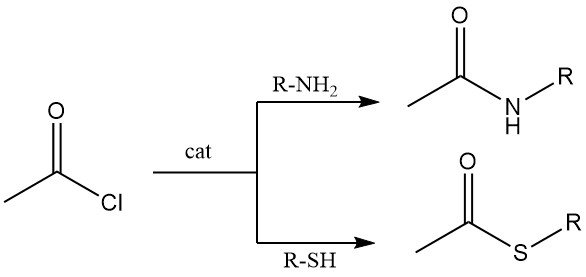
Le ammine primarie e secondarie reagiscono con il cloruro di acetile per produrre acetammidi. In condizioni di Schotten-Baumann (base acquosa), la N-acetilazione è efficiente, sebbene l’idrolisi del cloruro di acetile possa competere.
Le ammine terziarie producono sali di acetilammonio, che possono decomporsi in cheteni o subire la frammentazione di von Braun. Reazioni correlate includono la N-acetilazione delle immine in enamidi e la conversione degli uretani in immidi.
I tioli reagiscono con il cloruro di acetile per dare tioesteri. Sia i tioli alifatici che quelli aromatici subiscono questa trasformazione, tipicamente in presenza di cloruro di cobalto come catalizzatore.
Il cloruro di acetile forma addotti reversibili con aldeidi e chetoni in presenza di acidi di Lewis, producendo α-cloroalchil acetati. Ad esempio, l’acetone reagisce con il cloruro di acetile e il cloruro di zinco a bassa temperatura per formare l’addotto corrispondente con buona resa.
I solfossidi vengono ridotti a solfuri dal cloruro di acetile in presenza di cloruro di stagno(II). La reazione procede in condizioni blande ed è compatibile con gruppi funzionali sensibili, inclusi i derivati delle cefalosporine.
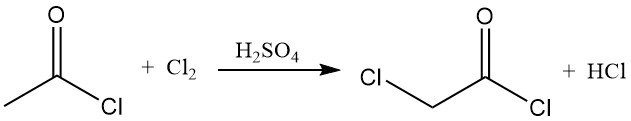
Il cloruro di acetile reagisce con cloro e bromo per formare cloruri di aloacetile. In presenza di acido solforico, il cloro viene convertito efficacemente in cloruro di cloroacetile, che è un importante intermedio di sintesi.
Le reazioni del cloruro di acetile con ammine terziarie come la trietilammina generano chetene in situ. Il chetene può essere intrappolato da enolati, enammine o immine per formare esteri acetoacetici, ciclobutanoni o addotti dichetenici.
In presenza di ioduro di samario(II), il cloruro di acetile si comporta come un equivalente nucleofilo dell’anione acetile, dando origine a prodotti aciloinici dai chetoni.
La reazione del cloruro di acetile con perossido di idrogeno produce acido perossiacetico e perossido di acetile, quest’ultimo un composto altamente esplosivo.
In presenza di acidi grassi, forma anidridi miste acetico-alchilcarbossiliche o cloruri acilici, entrambi utilizzabili nelle reazioni di esterificazione. Ad esempio, l’acido laurico reagisce con il cloruro di acetile per formare i derivati corrispondenti.
Il cloruro di acetile subisce una riduzione con reagenti organometallici come l’idruro di litio e alluminio (LiAlH4). In presenza di alcol terz-butilico, LiAlH4 viene convertito in idruro di litio tri-terz-butossialluminio, che riduce selettivamente il cloruro di acetile ad acetaldeide. Anche l’idruro di trifenilstagno riduce il cloruro di acetile.
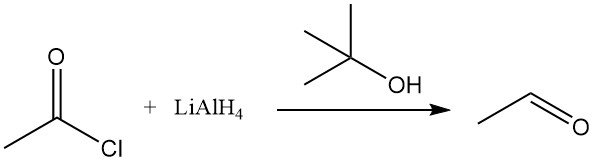
L’idrogenazione catalitica del cloruro di acetile con il metodo Rosenmund è inefficiente, ma la riduzione dell’anidride acetica a diacetato di etilidene è possibile in presenza di cloruro di acetile su complessi di palladio. Il tricloruro di rodio, lo ioduro di metile e la trifenilfosfina formano un complesso che è attivo nella riduzione del cloruro di acetile.
3. Produzione del cloruro di acetile
Il cloruro di acetile viene prodotto commercialmente in Europa e in Estremo Oriente. Negli Stati Uniti, la produzione è limitata e destinata principalmente all’uso in loco, in particolare per l’acetilazione farmaceutica.
Il cloruro di acetile fu descritto per la prima volta negli anni ’50 del XIX secolo. Si otteneva distillando acetato di sodio anidro con ossicloruro di fosforo.
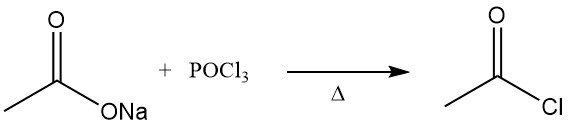
Il precedente metodo di produzione del cloruro di acetile era la reazione del cloruro di tionile, SOCl2, con acetato grigio di calce. Questo processo è stato ampiamente sostituito dalla reazione dell’acetato di sodio o dell’acido acetico con il tricloruro di fosforo, PCl3. Un metodo simile ha continuato a essere applicato nell’Unione Sovietica. Entrambi i metodi sono relativamente costosi.
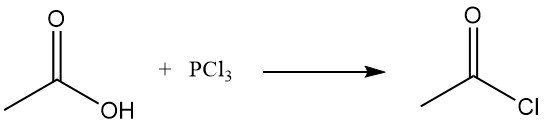
La carbonilazione del cloruro di metile con monossido di carbonio per produrre cloruro di acetile è stata descritta in diversi brevetti. Questi processi utilizzano catalizzatori a base di complessi di rodio, palladio o iridio in combinazione con composti iodici e ioduri di fosfonio o ossidi di fosfina.
Ad esempio, una reazione riportata ha prodotto una conversione del 56% in cloruro di acetile a una temperatura di 453 K e una pressione di 8360 kPa. Queste reazioni sono possibili grazie alla disponibilità di leghe resistenti alla corrosione. L’applicazione industriale di questo metodo non è stata confermata.
Preparazioni alternative includono la reazione dell’acido acetico con etileni clorurati in presenza di cloruro ferrico, la combinazione di cloruro di benzile con acido acetico (resa dell’85%), la conversione di dicloruro di etilidene (resa del 91%) e la decomposizione dell’acetato di etile mediante fosgene per formare cloruro di acetile e cloruro di etile. L’elevato costo delle materie prime e delle attrezzature rende la via del fosgene impraticabile.
Anche la clorurazione dell’acido acetico ad acido monocloroacetico produce cloruro di acetile come sottoprodotto. Poiché il recupero è costoso, il cloruro di acetile viene solitamente riciclato in acido monocloroacetico. Un metodo brevettato descrive il lavaggio di miscele di cloruro di acetile e cloruro di idrogeno con acido solforico per formare acetilsolfato.
Un brevetto statunitense riporta un miglioramento della resa di cloruro di acetile dalla reazione di anidride acetica con cloruro di idrogeno. In questo processo, il cloruro di acetile e parte del sottoprodotto dell’acido acetico vengono continuamente rimossi dalla miscela, mentre i componenti rimanenti vengono riciclati nel reattore per un’ulteriore reazione.
4. Usi del cloruro di acetile
Una piccola quantità di cloruro di acetile viene consumata durante la fase di avvio della clorurazione dell’acido acetico ad acido monocloroacetico. Una volta iniziata, il cloruro di acetile formato come sottoprodotto mantiene l’effetto catalitico.
Il cloruro di acetile è un efficace agente acetilante. Viene utilizzato nella sintesi di aspirina, paracetamolo, acetanilide e acetofenone. Viene anche utilizzato nella preparazione di composizioni a cristalli liquidi necessarie per display ottici e dispositivi di memoria.
Il cloruro di acetile può essere utilizzato in sostituzione dell’anidride acetica o dell’acido acetico come reagente di acetilazione altamente reattivo quando le reazioni sono difficili o lente. Questo rende il cloruro di acetile particolarmente utile per la preparazione di polimeri specializzati che possono chelare con ioni metallici, come il rame, con conseguente miglioramento delle proprietà elettriche e magnetiche.
L’antralina viene acetilata con cloruro di acetile in toluene utilizzando la piridina come catalizzatore per produrre 1,8-diidrossi-10-acetilantrone, un intermedio utilizzato in farmaci per il trattamento di patologie cutanee, tra cui verruche, psoriasi e acne. Gli esteri di zucchero possono essere sintetizzati in condizioni anidre con cloruro di acetile in modo simile.
Il cloruro di acetile è stato utilizzato in chimica analitica per la determinazione del gruppo ossidrilico, ma questo metodo è stato ampiamente sostituito da tecniche spettroscopiche. È ancora utilizzato per la preparazione di derivati fenolici senza catalizzatori acidi forti e per l’acetilazione di ammine primarie e secondarie.
Il cloruro di acetile può sostituire l’anidride acetica in molte reazioni di acetilazione. A differenza dell’anidride, non richiede un catalizzatore acido minerale. Nonostante il suo costo più elevato, il cloruro di acetile è ampiamente utilizzato quando la praticità supera la spesa. La riduzione dei costi di produzione renderebbe il cloruro di acetile una valida alternativa all’anidride acetica nei processi su larga scala.
5. Tossicologia e sicurezza
Il cloruro di acetile produce fumi soffocanti dall’odore pungente e irritante. È altamente tossico. La sua infiammabilità e la forte reattività con acqua e alcali richiedono rigorose precauzioni durante la manipolazione.
È necessaria un’adeguata ventilazione per rimuovere i vapori dalle aree di lavoro. Il personale deve indossare indumenti protettivi impermeabili per prevenire l’esposizione. I contenitori per il trasporto alla rinfusa devono essere conservati in luoghi freschi e asciutti, isolati da sostanze infiammabili e non corrosive.
Riferimenti
1. Wagner, F.S., Jr. (2002). Acetyl Chloride. In Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc (Ed.). https://doi.org/10.1002/0471238961.0103052023010714.a04.pub2
2. Pearlman, B.A. (2001). Acetyl Chloride. In Encyclopedia of Reagents for Organic Synthesis, (Ed.). https://doi.org/10.1002/047084289X.ra025
3. Le Berre, C., Serp, P., Kalck, P. and Torrence, G.P. (2014). Acetic Acid. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a01_045.pub3
