Biossido di titanio: una panoramica completa

Cos’è il biossido di titanio?
Il biossido di titanio è un composto inorganico con formula chimica TiO2. È un solido bianco insolubile in acqua. Il biossido di titanio si trova in natura sotto forma di polimorfi di rutilo, anatasio e brookite.
Rutilo e anatasio sono utilizzati industrialmente per produrre pigmenti, catalizzatori, ceramiche e vari altri materiali tecnici.
Il biossido di titanio è il pigmento bianco più importante grazie alle sue eccezionali proprietà di dispersione, all’elevata stabilità chimica e alla non tossicità. Nel 2007, sono state prodotte circa 5 milioni di tonnellate di pigmenti di biossido di titanio.
Il biossido di titanio è tra i primi cinque prodotti chimici inorganici in termini di importanza economica, con un fatturato annuo globale superiore a 12 miliardi di dollari.
La produzione di biossido di titanio è aumentata da 1,389 milioni di tonnellate nel 1965 a 3,220 milioni di tonnellate nel 1995. Il processo al solfato ha dominato la produzione iniziale (90,3% nel 1965), ma è sceso al 46,0% entro il 1995, mentre il processo al cloruro è aumentato dal 9,7% al 54,0%. La capacità produttiva ha raggiunto 5,915 milioni di tonnellate entro il 2008, con il processo al cloruro che ha mantenuto una leggera predominanza al 53,2% rispetto al processo al solfato al 46,8%.
Sommario
1. Proprietà fisiche del biossido di titanio
Il biossido di titanio esiste in tre forme cristalline: rutilo, anatasio e brookite. Il rutilo è il più stabile dal punto di vista termodinamico. Ciononostante, anatasio e brookite possiedono energie reticolari simili, che contribuiscono alla loro stabilità a lungo termine. L’anatasio si converte irreversibilmente in rutilo sopra i 700 °C. La brookite ha usi industriali limitati a causa della sua difficoltà di produzione.
In tutte e tre le forme di biossido di titanio, ogni atomo di titanio è coordinato ottaedricamente da sei atomi di ossigeno, e ogni atomo di ossigeno è coordinato trigonalmente da tre atomi di titanio. Le tre strutture cristalline corrispondono a diversi modi di collegare gli ottaedri ai loro angoli e spigoli.
La Tabella 1 fornisce le costanti e le densità del reticolo cristallino di queste modificazioni del TiO2.
Rutilo e anatasio cristallizzano nel sistema tetragonale, mentre la brookite cristallizza nel sistema rombico. Il biossido di titanio fonde a circa 1800 °C. Oltre i 1000 °C, la pressione parziale di ossigeno aumenta a causa della liberazione di ossigeno e della formazione di ossidi di titanio inferiori. Questo processo induce variazioni di colore e altera la conduttività elettrica. Una colorazione gialla reversibile appare sopra i 400 °C a causa dell’espansione termica del reticolo.
Il rutilo presenta la densità e l’impacchettamento atomico più elevati, il che si traduce in una durezza superiore (Mohs 6,5–7,0) rispetto all’anatasio (Mohs 5,5–6,0). Gli additivi possono influenzare significativamente la durezza di questi materiali nelle applicazioni pratiche.
L’elevato indice di rifrazione, combinato con un assorbimento minimo nello spettro visibile, rende il biossido di titanio un pigmento bianco eccezionale. Gli indici di rifrazione medi sono 2,55 per l’anatasio e 2,80 per il rutilo, che dipendono dalla lunghezza d’onda.
Il biossido di titanio è un semiconduttore fotosensibile che assorbe la radiazione elettromagnetica nel vicino UV. L’energia del band gap, che rappresenta la differenza di energia tra la banda di valenza e quella di conduzione, è di 3,03 eV per il rutilo e di 3,15 eV per l’anatasio, che corrispondono rispettivamente ai limiti di assorbimento a 415 nm e 385 nm.
In base al punto di flesso della curva di assorbimento, questi valori sono 3,13 eV (397 nm) per il rutilo e 3,29 eV (377 nm) per l’anatasio. Tracce di impurità, come parti per milione di ferro, possono causare l’assorbimento della luce visibile e portare a una deviazione dal bianco puro.
L’assorbimento dell’energia luminosa eccita un elettrone dalla banda di valenza a quella di conduzione. L’elettrone mobile e la lacuna elettronica risultanti possono migrare sulla superficie del solido, dove possono partecipare a reazioni redox.
| Fase | Numero di registro CAS | Sistema cristallino | Costanti reticolari, nm | Densità, g/cm3 |
|---|---|---|---|---|
| Rutilo | [1317-80-2] | tetragonale | a = 0,4594, c = 0,2958 | 4,21 |
| Anatasio | [1317-70-0] | tetragonale | a = 0,3785, c = 0,9514 | 4,06 |
| Brookite | [12188-41-9] | rombico | a = 0,9184, b = 0,5447, c = 0,5145 | 4,13 |
2. Proprietà chimiche del biossido di titanio
Il biossido di titanio presenta proprietà anfotere con caratteristiche acide e basiche deboli. Pertanto, i titanati di metalli alcalini e gli acidi titanici liberi sono instabili in ambienti acquosi e subiscono idrolisi per formare idrossidi di ossido di titanio amorfi.
Il biossido di titanio è chimicamente molto stabile e non reagisce con la maggior parte dei reagenti organici e inorganici. La dissoluzione avviene in acido solforico concentrato dopo riscaldamento prolungato e in acido fluoridrico. Anche sostanze alcaline e acide fuse lo attaccano e lo dissolvono.
A temperature elevate, il TiO2 reagisce con agenti riducenti come monossido di carbonio, idrogeno e ammoniaca per produrre ossidi di titanio a bassa valenza senza formazione di titanio metallico. Oltre i 500 °C, il biossido di titanio reagisce con il cloro in presenza di carbonio per generare tetracloruro di titanio.
3. Proprietà superficiali dei pigmenti di biossido di titanio
Le aree superficiali specifiche del biossido di titanio commerciale variano da 0,5 a >300 m²/g a seconda delle applicazioni. I pigmenti standard presentano aree superficiali da 5 a 30 m²/g.
Una superficie di biossido di titanio è naturalmente ricoperta da acqua legata in modo coordinativo per formare gruppi ossidrilici, rendendo polare la superficie del biossido di titanio non rivestito. La copertura superficiale degli ossidrilici influenza le caratteristiche del pigmento come la disperdibilità e la resistenza agli agenti atmosferici.
La presenza di questi gruppi ossidrilici superficiali rende possibili diverse reazioni fotochimiche, come la decomposizione fotocatalitica dell’acqua in idrogeno e ossigeno e la riduzione dell’azoto ad ammoniaca e idrazina.
4. Produzione industriale di biossido di titanio
Il biossido di titanio commerciale viene prodotto principalmente utilizzando due distinti metodi industriali: il processo al solfato e il processo al cloruro. Entrambi i metodi sono progettati per formare pigmenti di biossido di titanio.
Il processo al solfato è una tecnica più vecchia che inizia con la reazione di materie prime ricche di titanio, come l’ilmenite, con acido solforico concentrato ad alte temperature (150-220 °C). Questa reazione crea una soluzione contenente titanio, ferro e altre impurità. Attraverso fasi successive di idrolisi e purificazione, si precipita un idrato di ossido di titanio. Questo idrato viene quindi calcinato (riscaldato ad alte temperature), macinato e spesso rivestito per ottenere il pigmento finale.
Il processo al cloruro prevede la clorurazione di materie prime contenenti titanio, come ilmenite o rutilo, a temperature ancora più elevate (700-1200 °C). Questo processo produce tetracloruro di titanio (TiCl4), che viene poi ossidato a 900-1400 °C per formare biossido di titanio. Analogamente al processo al solfato, il TiO2 risultante viene poi macinato e rivestito.
È importante notare che, sebbene questi due processi siano predominanti nella produzione di pigmenti, esistono altri metodi specializzati per produrre biossido di titanio senza proprietà pigmentarie, in particolare per la sintesi di nanoparticelle. Questi metodi alternativi includono tecniche come l’idrolisi degli alcolati di titanio o la reazione pirolitica del tetracloruro di titanio con acqua.
Per informazioni dettagliate sui processi di produzione del biossido di titanio, visitare il seguente articolo.
4.1. Produzione di biossido di titanio mediante processo al solfato
Il processo al solfato per la produzione di biossido di titanio prevede una serie di fasi che iniziano con la macinazione delle materie prime contenenti titanio fino a ottenere una polvere fine (inferiore a 40 μm) dopo l’essiccazione. Segue la digestione, in cui il materiale macinato viene miscelato con acido solforico concentrato (80-98%) ad alte temperature (fino a 220 °C), ottenendo una massa solida di digestione.
Questa massa solida viene quindi sciolta e ridotta in acqua fredda o acido diluito per formare una soluzione di biossido di titanio, con il ferro trivalente ridotto a ferro bivalente per prevenire la contaminazione. Successivamente, la soluzione viene sottoposta a chiarificazione per rimuovere tutti i solidi non disciolti tramite sedimentazione e filtrazione. Per le soluzioni derivate dall’ilmenite, il solfato di ferro viene cristallizzato mediante raffreddamento per ridurne la concentrazione.
Il passaggio chiave è l’idrolisi, in cui l’idrato di ossido di titanio viene precipitato dalla soluzione a 94-110 °C, spesso utilizzando nuclei per controllare le proprietà delle particelle. Questo idrolizzato viene quindi purificato mediante riduzione (sbiancamento) con agenti come polvere di zinco o alluminio per rimuovere le impurità colorate rimanenti, seguita da una seconda filtrazione e lavaggio.
Prima della fase di riscaldamento finale, l’idrato viene drogato con composti di metalli alcalini e acido fosforico, e talvolta nuclei di rutilo e stabilizzanti, per ottenere specifiche caratteristiche del pigmento.
Infine, l’idrato drogato viene calcinato in forni rotativi a 800-1100 °C per rimuovere l’acqua e l’acido solforico residuo e convertire l’idrato in biossido di titanio cristallino. Il clinker risultante viene quindi macinato (a umido o a secco) per ottenere la finezza desiderata del pigmento.
4.2. Produzione del biossido di titanio mediante il processo del cloruro
Il processo del cloruro per la produzione del pigmento di biossido di titanio inizia con la clorurazione, dove materie prime contenenti titanio e coke di petrolio vengono fatte reagire con cloro e ossigeno in un reattore a letto fluido ad alte temperature (800-1200 °C) per produrre tetracloruro di titanio (TiCl4).
I gas di reazione caldi risultanti vengono raffreddati, prima per separare altri cloruri solidi e polvere dal TiCl4, e poi per condensare la maggior parte del tetracloruro di titanio raffreddandolo a temperature inferiori a 0 °C.
Il TiCl4 condensato viene quindi purificato mediante distillazione per rimuovere i cloruri solidi e le impurità disciolte come cloro, tetracloruro di vanadio e fosgene, garantendo un prodotto di tetracloruro di titanio ad elevata purezza.
Infine, il vapore di TiCl4 purificato viene riscaldato e fatto reagire con ossigeno preriscaldato a temperature molto elevate (900-1400 °C) in un reattore appositamente progettato. Questa reazione produce pigmento di biossido di titanio e cloro gassoso.
Il pigmento di TiO2 viene quindi separato dal flusso gassoso e il cloro gassoso viene spesso riciclato nella fase di clorurazione. La qualità del pigmento (dimensione e distribuzione delle particelle) è attentamente controllata da fattori quali la temperatura di reazione e l’aggiunta di composti specifici.
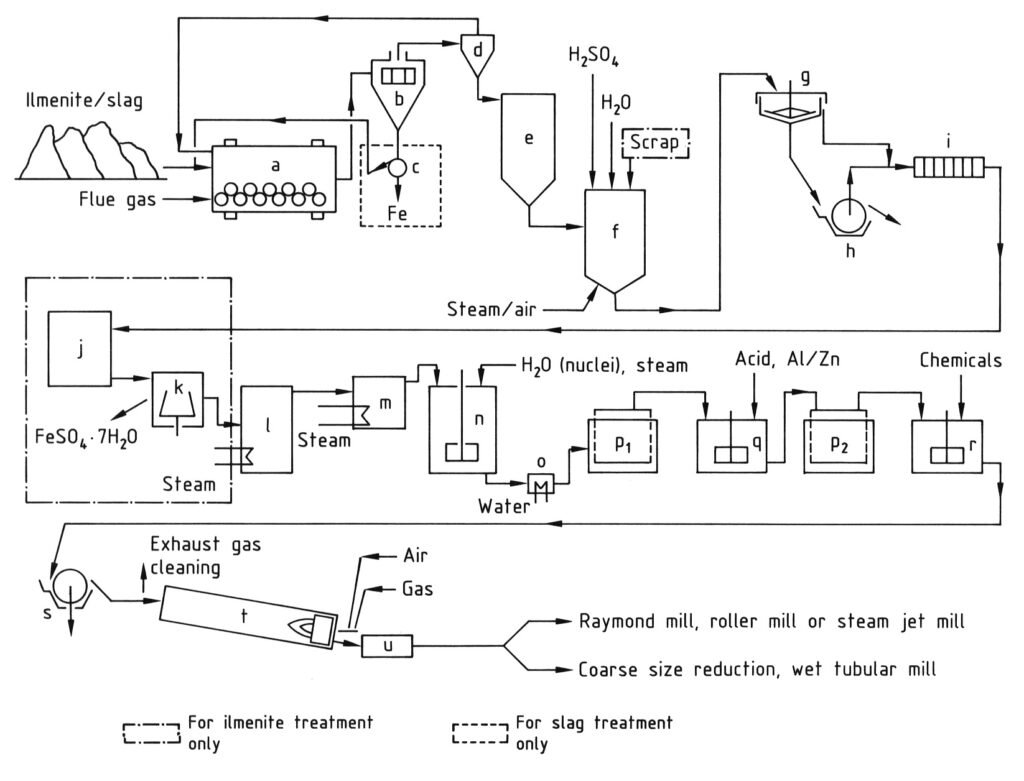
a) Mulino a sfere/essiccatore; b) Setaccio; c) Separatore magnetico; d) Ciclone; e) Silo; f) Recipiente di digestione; g) Addensatore; h) Filtro rotante; i) Filtropressa; j) Cristallizzatore; k) Centrifuga; l) Evaporatore sotto vuoto; m) Preriscaldatore; n) Vasca agitata per idrolisi; o) Refrigeratore; p) Filtri Moore; q) Vasca agitata per sbiancamento; r) Vasca agitata per drogaggio; s) Filtro rotante per disidratazione; t) Forno rotante; u) Refrigeratore
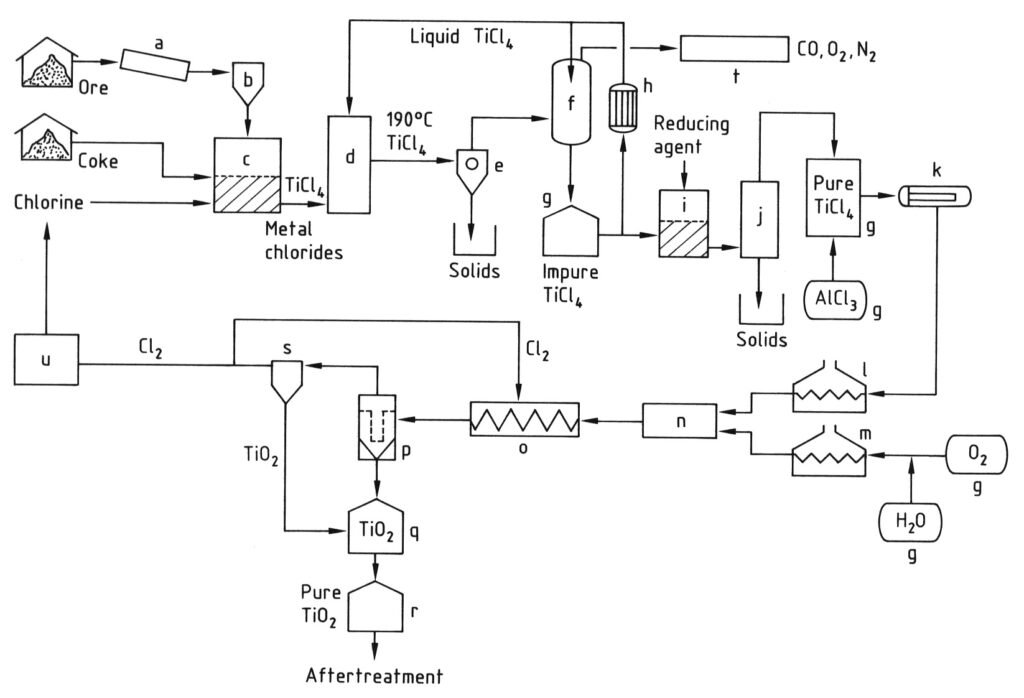
a) Mulino; b) Silo; c) Reattore a letto fluido; d) Torre di raffreddamento; e) Separazione dei cloruri metallici; f) Condensazione di TiCl4; g) Serbatoio; h) Refrigeratore; i) Riduzione del vanadio; j) Distillazione; k) Evaporatore; l) Surriscaldatore di TiCl4; m) Surriscaldatore di O2; n) Bruciatore; o) Serpentina di raffreddamento; p) Filtro; q) Purificazione di TiO2; r) Silo; s) Purificazione del gas; t) Purificazione dei gas di scarico; u) Liquefazione di Cl2
5. Proprietà dei pigmenti del biossido di titanio
Le caratteristiche principali dei pigmenti del biossido di titanio includono potere di diffusione, potere coprente, brillantezza, massa, formazione di lucentezza, opacità, disperdibilità, solidità alla luce e resistenza agli agenti atmosferici. Queste proprietà dipendono dalla purezza chimica, dalla stabilizzazione del reticolo, dalla distribuzione granulometrica e dai rivestimenti superficiali. La valutazione delle proprietà richiede la considerazione delle interazioni pigmento-matrice.
5.1. Potere di diffusione
Gli indici di rifrazione del rutilo (n = 2,80) e dell’anatasio (n = 2,55) sono persino superiori a quelli del diamante (n = 2,42). I coefficienti di rifrazione relativi variano tipicamente da 1,5 a 2,0 nei vari sistemi leganti.
Secondo la teoria di Mie, la diffusione ottimale si verifica a particelle di 0,2 μm. Il potere di diffusione dipende dalla lunghezza d’onda; Le particelle più piccole di biossido di titanio diffondono sfumature blu, mentre le particelle più grandi diffondono sfumature gialle.
5.2. Massa e colore
Il bianco del biossido di titanio dipende dalla purezza, dalla modificazione cristallina e dalla dimensione delle particelle. I pigmenti di anatasio hanno una sfumatura gialla minore rispetto al rutilo perché la loro banda di assorbimento (385 nm) è spostata nella regione UV.
La presenza di impurità di elementi di transizione influisce sul bianco, motivo per cui i pigmenti ottenuti con il processo al cloruro hanno una purezza del colore superiore, poiché il TiCl4 viene purificato per distillazione prima dell’ossidazione.
5.3. Dispersione
Un’efficace disintegrazione e dispersione dei pigmenti di biossido di titanio sono essenziali per ottenere un’elevata lucentezza e ridurre al minimo l’opacità. Si ottengono mediante macinazione intensiva e rivestimento superficiale organico. La scelta del trattamento superficiale dipende dai requisiti dell’applicazione.
5.4. Solidità alla luce e resistenza agli agenti atmosferici
L’esposizione agli agenti atmosferici di vernici e rivestimenti contenenti biossido di titanio porta allo sfarinamento dei pigmenti. L’assenza di ossigeno o la bassa permeabilità all’ossigeno nei leganti (ad esempio, resine melammina-formaldeide) previene lo sfarinamento, ma causa un ingrigimento reversibile. L’ingrigimento è significativamente ridotto in assenza di acqua.
L’anatasio mostra una maggiore suscettibilità a entrambi gli effetti. I produttori di pigmenti utilizzano metodi di stabilizzazione, come il drogaggio con zinco o alluminio prima della calcinazione o durante l’ossidazione.
In presenza di un legante stabile, i pigmenti di biossido di titanio agiscono come fotocatalizzatori, inducendo la degradazione del legante e, con leganti a bassa stabilità, lo proteggono dalla degradazione. Di conseguenza, i test di durabilità richiedono sistemi leganti altamente stabili.
Il meccanismo di degradazione segue un ciclo in cinque fasi:
- L’adsorbimento di acqua forma gruppi ossidrilici superficiali.
- L’assorbimento di luce a lunghezza d’onda corta (anatasio <385 nm, rutilo <415 nm) genera un elettrone e una lacuna elettronica (eccitone) all’interno del reticolo cristallino, che migrano verso la superficie del pigmento.
- In superficie, uno ione OH– viene ossidato a un radicale OH• dalla lacuna elettronica. Questo radicale OH• desorbe e può degradare ossidativamente il legante. Contemporaneamente, Ti4+ viene ridotto a Ti3+ dall’elettrone rimanente.
- Lo ione Ti3+ viene ossidato dall’ossigeno adsorbito per formare uno ione O2–, che reagisce con H+ per produrre un radicale HO2•.
- Il ciclo termina con il legame dell’acqua alla superficie di TiO2 rigenerata.
In sintesi, il processo di sfarinamento è la reazione di acqua e ossigeno per formare radicali OH• e HO2• sotto l’influenza della radiazione a onde corte e dell’attività catalitica della superficie del biossido di titanio.
Questo ciclo può essere interrotto dall’esclusione di aria o acqua. L’esclusione dell’ossigeno o la diffusione dell’ossigeno limitante nel legante porta all’accumulo di ioni Ti3+ e all’ingrigimento, che si inverte con l’esposizione graduale all’ossigeno. L’esclusione dell’acqua previene la reidratazione e la formazione di idrossili superficiali.
Nonostante questa attività fotochimica, i pigmenti rutilici trattati stabilizzano molti leganti impedendo la penetrazione della luce negli strati di rivestimento. I pigmenti TiO2 di alta qualità devono dimostrare un’eccellente resistenza agli agenti atmosferici, ad esempio resistendo a un significativo sfarinamento o a un deterioramento della lucentezza dopo un’esposizione di due anni al test della Florida.
5.5. Abrasività
L’abrasività è una proprietà indesiderabile dei pigmenti di biossido di titanio. L’anatasio ha un’abrasività inferiore (Mohs 5.5-6.0) rispetto al rutilo (Mohs 6.5-7.0). Sebbene questi valori di durezza intrinseca appaiano simili, gli additivi droganti influenzano significativamente la durezza pratica.
Ad esempio, i pigmenti rutilici drogati con allumina presentano un’abrasività notevolmente superiore rispetto ai pigmenti anatasio privi di allumina. I pigmenti ottenuti con il processo al cloruro, che in genere contengono più allumina, mostrano spesso un’abrasività superiore rispetto ai pigmenti solforati.
Questo fenomeno è attribuito alla segregazione di ioni accettori come Al2O3 sulla superficie durante la calcinazione, anche a basse concentrazioni (<0,4%). Pertanto, gli studi sulla topologia superficiale e sui parametri reticolari del biossido di titanio richiedono materiali ad altissima purezza per evitare interpretazioni errate.
6. Usi del biossido di titanio pigmentario
Il biossido di titanio ha raggiunto un’adozione universale, sostituendo quasi completamente altri pigmenti bianchi. Nel 2007, l’Asia era al primo posto nel consumo globale, seguita da Europa e Nord America. Il rutilo rappresenta circa il 90% del consumo totale e l’anatasio il 10%.
6.1. Usi in vernici e rivestimenti
Vernici e rivestimenti sono i principali consumatori di biossido di titanio. Il pigmento TiO2 migliora le capacità protettive dei materiali di rivestimento. I moderni pigmenti TiO2 possono formare rivestimenti sottili (pochi micrometri) per una copertura completa del substrato. Le concentrazioni in volume di pigmento variano dal 10% al 35% nelle vernici lucide e possono superare l’80% nelle vernici opache a emulsione.
I pigmenti commerciali consentono la produzione di vernici utilizzando apparecchiature di dispersione di base come i dissolutori a disco. Il trattamento organico prima della micronizzazione a getto di vapore migliora le proprietà di lucentezza e riduce l’opacità negli smalti a forno. Questi prodotti non presentano sedimentazione durante lo stoccaggio e presentano una buona resistenza alla luce e agli agenti atmosferici.
6.2. Usi negli inchiostri da stampa
La stampa moderna utilizza spessori di rivestimento inferiori a 10 μm, richiedendo i pigmenti di biossido di titanio più fini possibili. Questi film ultrasottili sono possibili solo con pigmenti di TiO2 che hanno un potere schiarente (riducente) sette volte superiore a quello del litopone.
L’eccezionale disperdibilità si rivela essenziale per ottenere la brillantezza. La massa neutra del biossido di titanio lo rende particolarmente adatto per schiarire i pigmenti colorati.
6.3. Usi nelle materie plastiche
Il biossido di titanio è ampiamente utilizzato per colorare prodotti in plastica durevoli e non durevoli, inclusi giocattoli, elettrodomestici, automobili, mobili e pellicole per imballaggio. I pigmenti di TiO2 assorbono le radiazioni UV inferiori a 415 nm; pertanto, vengono utilizzati per proteggere le materie plastiche pigmentate dai raggi nocivi.
Anche una minima quantità di biossido di titanio conferisce opacità alle materie plastiche, pertanto viene aggiunto ai prodotti di colore scuro per evitare un aspetto traslucido e “sgradevole”.
6.4. Usi nelle fibre
I pigmenti di biossido di titanio conferiscono un aspetto solido alle fibre sintetiche, eliminando le proprietà traslucide e il conseguente aspetto untuoso. I pigmenti di anatasio sono preferiti in questa applicazione per il loro minore effetto abrasivo sulle attrezzature di filatura rispetto al rutilo. Un rivestimento appropriato può aumentare la scarsa resistenza alla luce dei pigmenti di anatasio nelle fibre di poliammide.
6.5. Usi nella carta
In Europa, cariche come caolino, gesso o talco sono comunemente utilizzate per schiarire e opacizzare la carta. I pigmenti di biossido di titanio sono ideali per carta ad alto punto di bianco che richiede opacità a spessori molto sottili (ad esempio, carta per posta aerea o carta da stampa sottile).
Il TiO2 può essere aggiunto alla pasta di carta o applicato come rivestimento per una qualità superiore della carta “artistica”. Le carte laminate vengono solitamente colorate con pigmenti rutilici estremamente resistenti alla luce prima dell’impregnazione con resina melamminica-ureica per strati o pellicole decorative.
6.6. Ulteriori applicazioni
I pigmenti di biossido di titanio sono utilizzati nell’industria dello smalto e della ceramica, nella produzione di cemento bianco e nella colorazione di gomma e linoleum. Inoltre, vengono utilizzati come assorbitori UV in creme solari, saponi, polveri cosmetiche, creme, dentifrici e involucri per sigari.
Il biossido di titanio è utilizzato anche come colorante alimentare e nell’industria cosmetica in generale grazie alle sue proprietà quali la non tossicità (assunzione orale), la compatibilità con la pelle e le mucose e la buona disperdibilità in varie soluzioni e leganti.
Pigmenti di TiO2 elettricamente conduttivi sono stati prodotti mediante trattamenti superficiali con rivestimenti misti di ossidi di indio-stagno o antimonio-stagno. Questi pigmenti sono utilizzati nelle fibre per carte elettrofotografiche e nella produzione di materie plastiche antistatiche.
7. Usi del biossido di titanio non pigmentario

Il TiO2 non pigmentario viene utilizzato in smalti vetrosi, vetro e vetroceramica, elettroceramica, catalizzatori e supporti per catalizzatori, flussi di saldatura, pigmenti colorati, conduttori elettrici, intermedi chimici (ad esempio, fluorotitanato di potassio), ceramiche strutturali, assorbitori UV e rivestimenti refrattari.
7.1. Elettroceramica
I titanati (ad esempio, titanato di bario, stronzio, calcio e piombo), sintetizzati da substrati di biossido di titanio ad alta purezza, vengono utilizzati nella produzione di condensatori, resistori PTC e materiali piezoelettrici.
I requisiti per i materiali di partenza in TiO2 in termini di purezza, reattività e caratteristiche di sinterizzazione stanno diventando più rigorosi a causa della tendenza alla miniaturizzazione dei componenti elettronici, che richiede strati ceramici più sottili e particelle più piccole.
I recenti progressi nell’utilizzo dell’idrato di ossido di titanio (ottenuto con processo al solfato) hanno consentito la produzione allo stato solido di BaTiO3 ultrapuro e ultrafine a temperature inferiori a 500 °C.
I componenti multistrato piezoceramici, come gli attuatori per i sistemi di iniezione del carburante, richiedono ceramiche a bassa sinterizzazione. I componenti altamente reattivi in TiO2 e ZrO2 per il titanato di zirconio di piombo (PZT) facilitano la formazione della struttura perovskite e la successiva sinterizzazione a temperature sufficientemente basse da ridurre significativamente il costoso contenuto di palladio negli elettrodi di questi attuatori.
Il consumo globale di biossido di titanio per elettroceramica supera le 10.000 tonnellate/anno. Nonostante l’effetto della miniaturizzazione dei componenti elettroceramici, che comporta una minore quantità di materia prima necessaria per componente elettronico, si prevede una continua crescita annuale.
7.2. Catalizzatori
Il biossido di titanio viene utilizzato come catalizzatore attivo per diverse reazioni termiche e fotochimiche, che coinvolgono composti sia inorganici che organici. Può essere autosupportato o depositato su altri materiali. Il drogaggio con elementi aggiuntivi ne potenzia tipicamente l’effetto catalitico desiderato.
La principale applicazione catalitica del biossido di titanio è la rimozione dell’ossido di azoto dai gas di scarico industriali (centrali elettriche, inceneritori e motori diesel). In questo processo, chiamato riduzione catalitica selettiva (SCR), gli ossidi di azoto reagiscono con l’ammoniaca in presenza di ossigeno sul catalizzatore per produrre azoto e acqua.
Il consumo globale di biossido di titanio per i catalizzatori SCR è di circa 25.000 t/a. Questi catalizzatori contengono tipicamente fino al 15% di ossido di tungsteno e circa l’1% di V2O5 insieme a TiO2. I metodi di produzione dei catalizzatori includono l’estrusione in forme a nido d’ape, il rivestimento su substrati (ad esempio, cordierite) o la stratificazione su lamiere metalliche.
Esistono requisiti rigorosi in termini di purezza, granulometria e porosità per garantire un’attività catalitica duratura nel tempo. Si prevede una crescente domanda di rimozione degli ossidi di azoto dai motori diesel fissi e mobili.
Numerose altre applicazioni catalitiche utilizzano TiO2 puro, TiO2 con additivi incorporati o TiO2 con metalli depositati in superficie (ad esempio, Rh, Pt, Pd, Au, Ag).
7.3. Fotocatalizzatori
Un’ampia ricerca globale si concentra sullo sfruttamento della fotoattività delle nanoparticelle di biossido di titanio, trattate o non trattate. Il biossido di titanio può essere utilizzato per la decomposizione catalitica di composti organici nelle acque reflue o per la purificazione fotocatalitica dell’aria.
La fotocatalisi con TiO2 puro richiede radiazioni UV a causa del suo bandgap di circa 3,1 eV, quindi viene utilizzato solo per applicazioni esterne. Tuttavia, il drogaggio del biossido di titanio con metalli, carbonio o azoto consente reazioni fotocatalitiche utilizzando la parte visibile dello spettro. Ciononostante, l’intensità della radiazione può essere un fattore limitante anche per le applicazioni a luce visibile.
Esempi di recenti applicazioni fotocatalitiche sono i rivestimenti architettonici autopulenti (per esterni), i rivestimenti interni per la decomposizione degli inquinanti atmosferici negli edifici e le piastrelle per pavimenti, i rivestimenti o il calcestruzzo che incorporano biossido di titanio nanostrutturato per la decomposizione dell’ossido di azoto urbano.
Queste tecnologie sono limitate ad applicazioni specializzate, come ospedali o luoghi di specifico interesse pubblico.
7.4. Pigmenti di ossidi metallici misti
I pigmenti di anatasio, o idrolizzati di biossido di titanio, vengono calcinati con ossidi di metalli di transizione per formare pigmenti di cromo rutilo o nichel rutilo (pigmenti di ossidi metallici misti).
7.5. Assorbimento UV
Le particelle nanostrutturate di TiO2 (5–50 nm) vengono incorporate nelle creme solari per l’industria cosmetica e nei rivestimenti protettivi UV (ad esempio, per il legno). Solitamente, vengono utilizzate particelle nanostrutturate di rutilo con rivestimenti inorganici e, facoltativamente, organici.
Il biossido di titanio nanostrutturato appare trasparente; assorbe efficacemente le radiazioni UV-B (280–320 nm) e UV-A (320–400 nm). A causa delle loro piccole dimensioni, queste particelle nanostrutturate di biossido di titanio richiedono una maggiore quantità di rivestimento inorganico o organico rispetto al TiO2 pigmentato.
7.6. Altre applicazioni
Il biossido di titanio non pigmentario viene utilizzato anche in batterie, celle a combustibile, sistemi di scissione dell’acqua e sistemi fotovoltaici. Le batterie a base di titanato di litio stanno riscuotendo interesse come sistemi di accumulo di energia ricaricabili per varie applicazioni.
Sebbene i sistemi fotovoltaici a base di TiO2 (celle di Grätzel) siano ben noti, l’applicazione del biossido di titanio nelle celle a combustibile e per la generazione fotocatalitica di idrogeno dall’acqua utilizzando la luce solare richiede ancora ricerche approfondite.
8. Tossicologia del biossido di titanio
Il biossido di titanio presenta una buona stabilità e una completa atossicità dopo somministrazione orale. Studi a lungo termine su animali con TiO2 alimentare non mostrano alcuna evidenza di assorbimento di titanio.
Storicamente, l’assorbimento di pigmenti di biossido di titanio finemente suddivisi nei polmoni non è stato associato a specifici effetti cancerogeni. Di conseguenza, l’Agenzia Internazionale per la Ricerca sul Cancro (IARC) ha inizialmente classificato il biossido di titanio come sostanza di Classe 3, il che significa che “non era classificabile in termini di cancerogenicità per l’uomo”.
Tuttavia, nel 2007, l’IARC ha riclassificato il TiO2 come sostanza di Classe 2B, indicandolo come “possibilmente cancerogeno per l’uomo”. Questa classificazione si applica sia al biossido di titanio di grado pigmentario (dimensione delle particelle primarie 200-300 nm) sia a quello ultrafine (dimensione delle particelle primarie inferiore a 50 nm).
Nonostante questa riclassificazione, gli studi epidemiologici sull’esposizione alla polvere di biossido di titanio nei lavoratori non hanno mostrato un aumento della mortalità o dell’incidenza del cancro ai polmoni.
Riferimenti
- Auer, G., Woditsch, P., Westerhaus, A., Kischkewitz, J., Griebler, W.-d., Rohe, M. and Liedekerke, M. (2017). Pigments, Inorganic, 2. White Pigments. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.n20_n01.pub2
- Kang, X.; Liu, S.; Dai, Z.; He, Y.; Song, X.; Tan, Z. “Titanium Dioxide: From Engineering to Applications.” Catalysts, 2019, 9 (2), 191. DOI: 10.3390/catal9020191.
- Haider, A. J.; Jameel, Z. N.; Al-Hussaini, I. H. M. “Review on: Titanium Dioxide Applications.” Energy Procedia, 2019, 157, 17-29. DOI: 10.1016/j.egypro.2018.11.159.
- Fujishima, A.; Rao, T. N.; Tryk, D. A. “Titanium dioxide photocatalysis.” Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2000, 1 (1), 1-21. DOI: 10.1016/S1389-5567(00)00002-2.
- Diebold, U. “The surface science of titanium dioxide.” Surface Science Reports, 2003, 48 (5–8), 53-229. DOI: 10.1016/S0167-5729(02)00100-0.
- Chen, X.; Mao, S. S. “Titanium Dioxide Nanomaterials: Synthesis, Properties, Modifications, and Applications.” Chem. Rev., 2007, 107 (7), 2891–2959. DOI: 10.1021/cr0500535.
- Racovita, A. D. “Titanium Dioxide: Structure, Impact, and Toxicity.” Int. J. Environ. Res. Public Health, 2022, 19 (9), 5681. DOI: 10.3390/ijerph19095681.
- Weir, A.; Westerhoff, P.; Fabricius, L.; Hristovski, K.; von Goetz, N. “Titanium Dioxide Nanoparticles in Food and Personal Care Products.” Environ. Sci. Technol., 2012, 46 (4), 2242–2250. DOI: 10.1021/es204168d.
- Ghamarpoor, R.; Fallah, A.; Jamshidi, M. “Investigating the use of titanium dioxide (TiO2) nanoparticles on the amount of protection against UV irradiation.” Sci Rep, 2023, 13, 9793. DOI: 10.1038/s41598-023-37057-5.
- Middlemas, S.; Fang, Z. Z.; Fan, P. “A new method for production of titanium dioxide pigment.” Hydrometallurgy, 2013, 131–132, 107-113. DOI: 10.1016/j.hydromet.2012.11.002.
- Gázquez, M.; Bolívar, J.; Garcia-Tenorio, R.; Vaca, F. “A Review of the Production Cycle of Titanium Dioxide Pigment.” Materials Sciences and Applications, 2014, 5, 441-458. DOI: 10.4236/msa.2014.57048.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. “Titanium Dioxide.” In Some Organic Solvents, Resin Monomers and Related Compounds, Pigments and Occupational Exposures in Paint Manufacture and Painting; IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 47; International Agency for Research on Cancer: Lyon (FR), 1989. Available from: https://www.ncbi.nlm.nih.gov/books/NBK524874/.
- Goparaju, V. R. R.; Marshall, D. F.; Kazerooni, V. “Process for manufacturing titanium dioxide pigments using ultrasonication.” U.S. Patent 9,353,266, 2016. Available from: https://patents.google.com/patent/US9353266B2/en.
- Davis, B. R.; Rahm, J. A. “Process for manufacturing titanium dioxide.” U.S. Patent 4,288,418, 1981. Available from: https://patents.google.com/patent/US4288418A/en.
- Ayorinde, T.; Sayes, C. M. “An updated review of industrially relevant titanium dioxide and its environmental health effects.” J. Hazard. Mater. Lett., 2023, 4, 100085. DOI: 10.1016/j.hazl.2023.100085.
