Benzotricloruro: proprietà, reazioni, produzione e usi
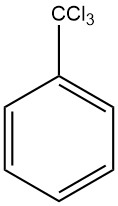
What is Benzotrichloride?
Benzotrichloride is the product resulting from exhaustive chlorination of the side chain of toluene also known as trichloromethylbenzene, α,α,α-trichlorotoluene and phenyl chloroform. It is a chemical compound with the formula C7H5Cl3.
The synthesis of benzotrichloride was initially accomplished in 1858 by L. SCHISCHKOFF and A. ROSING, employing the reaction between PCl5 and benzoyl chloride.
Today, due to it significant role as an important intermediate in the synthesis of acid chlorides (specifically benzoyl chloride), dyes, herbicides, pesticides, and various other products, benzotrichloride is produced on a large-scale.
Sommario
Proprietà fisiche del benzotricloruro
Il benzotricloruro è un liquido incolore dall’odore pungente ed è irritante per gli occhi e le mucose. Genera fumi se esposto all’aria umida.
Etanolo, etere dietilico e cloroformio sono buoni solventi per il benzotricloruro. Tuttavia, la sua solubilità in acqua è limitata, con solo 0,05 g per litro a 5 °C e 0,25 g per litro a 39 °C. In particolare, l’idrolisi si verifica durante il processo di dissoluzione in acqua.
La quantità di cloro che può essere disciolta in 100 grammi di benzotricloruro dipende dalla temperatura. A 30 °C la solubilità è di 5,1 grammi, mentre a 50 °C diminuisce a 3,4 grammi e a 100 °C si riduce ulteriormente a 1,3 grammi. Le proprietà fisiche del benzotricloruro sono le seguenti:
- Massa molare = 195,48 g/mol
- Punto di ebollizione = 220,7 °C
- Punto di fusione = -4,5 °C
- Densità = 1,373 a 20 °C
- Indice di rifrazione = 1,558 a 20 °C
- Punto di infiammabilità = 108 °C
- Temperatura di accensione = 420 °C
Reazioni chimiche del benzotricloruro
L’acido benzoico è prodotto dall’idrolisi acida o alcalina del benzotricloruro, mentre l’idrolisi parziale produce cloruro di benzoile.
Quando il benzotricloruro reagisce con gli acidi carbossilici, produce i corrispondenti cloruri acidi e il cloruro di benzoile.
La condensazione del benzotricloruro con benzene, in presenza di catalizzatori come FeCl3, AlCl3 o ZnCl2, porta alla formazione di difenil- e trifenilmetano.
Il trattamento del benzotricloruro con acido fluoridrico o fluoruri consente la sostituzione di tutti e tre gli atomi di cloro con fluoro.
Facendo reagire il benzotricloruro con alcoli anidri, è possibile preparare orto-esteri dell’acido benzoico.
L’idrolisi del benzotricloruro può essere ottenuta reagendo con acqua.
Produzione di benzotricloruro
Un metodo simile alla procedura impiegata per cloruro di benzile può essere utilizzato per la clorurazione esaustiva della catena laterale del toluene, facilitando la produzione di benzotricloruro. La clorurazione fotochimica, in particolare, è comunemente impiegata a questo scopo.
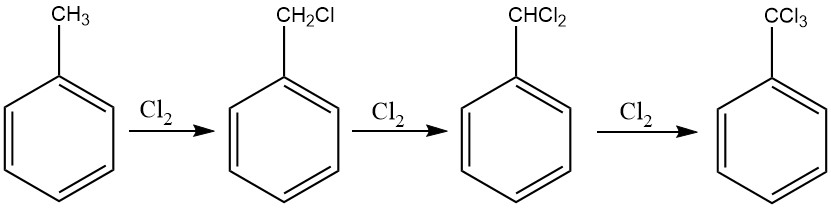
Nei processi continui, è consigliabile implementare una cascata di sei-dieci reattori per impedire la formazione di derivati clorurati ad anello. Questo approccio consente il controllo dell’alimentazione di cloro, assicurando che venga ottenuto benzotricloruro con quantità minime di cloruro benzale.
La figura 1 illustra un impianto a funzionamento continuo progettato per la produzione di benzotricloruro. Il toluene fresco viene indirizzato attraverso il pre-cloratore (R0) e successivamente entra nel primo reattore nella cascata di otto reattori. I reattori vengono caricati con quantità decrescenti di cloro.
In genere, l’ultimo reattore nella cascata viene spurgato con azoto puro per rimuovere il gas di cloro residuo. Ai fini della rimozione del gas di scarico (indicato da linee tratteggiate), i reattori possono essere classificati in tre gruppi.
I reattori R1-R3 ricevono una misurazione precisa del cloro, la maggior parte del quale viene consumata durante la reazione. Il gas di scarico dei reattori R4-R8 contiene una concentrazione più elevata di cloro a causa della clorurazione avanzata del materiale in questi reattori. Di conseguenza, questo gas viene riciclato nei reattori R1 e R2.
Allo stesso modo, il gas di scarico dei reattori R1-R4 viene introdotto nel pre-cloratore (R0), che contiene la più alta percentuale di toluene, per eliminare eventuali tracce rimanenti di cloro. Il gas di scarico del reattore R0 è quindi privo di cloro e viene indirizzato al sistema di depurazione per rimuovere l’HCl.
Controllando accuratamente le alimentazioni di cloro e toluene, questa tecnica ottiene una conversione quasi completa del toluene in benzotricloruro, generando gas di scarico composti prevalentemente da acido cloridrico e azoto, senza cloro presente.

Per migliorare la resa e la velocità di reazione, è fondamentale escludere l’ossigeno e possono essere aggiunte quantità catalitiche di bromo, cloruro di ammonio o una combinazione di tricloruro di fosforo e bis(dimetiltiocarbamoil) disolfuro.
La clorurazione dei metilbenzeni nei corrispondenti tricloruri come solventi, che si dice offra un’elevata resa di prodotti altamente puri, rappresenta un metodo alternativo per la produzione di benzotricloruro.
Un altro processo di produzione del benzotricloruro prevede la clorurazione dell’etere dibenzilico, un sottoprodotto ottenuto durante la conversione del cloruro di benzile in alcol benzilico. Questo processo di clorurazione produce una miscela di benzotricloruro e cloruro di benzoile, che può essere successivamente lavorata per ottenere cloruro di benzoile puro.
Questo approccio migliora indirettamente la redditività economica della produzione di alcol benzilico.
Utilizzi del benzotricloruro
L’applicazione principale del benzotricloruro risiede nel suo utilizzo per la produzione di cloruro di benzoile tramite idrolisi parziale con acqua o reazione con acido benzoico.
Il benzotricloruro trova anche applicazioni su scala minore in vari settori industriali. È impiegato nella produzione di prodotti farmaceutici e agrochimici, in particolare dopo aver subito una trasformazione in benzotrifluoruro. Inoltre, funge da precursore per la sintesi di stabilizzatori UV e coloranti di tipo benzofenone.
Tossicologia del benzotricloruro
Il benzotricloruro è una sostanza chimica tossica che può causare irritazione alla pelle, agli occhi e alle vie respiratorie. È anche un probabile cancerogeno per l’uomo.
La tossicità orale acuta (LD50) del benzotricloruro è di 2188 mg/kg nei ratti maschi e 1590 mg/kg nei ratti femmine. Ciò significa che il 50% dei ratti morirà se ingeriscono rispettivamente 2188 mg/kg o 1590 mg/kg di benzotricloruro.
I valori LC50 per il benzotricloruro sono superiori a 600 mg/m³ nei ratti maschi e circa 500 mg/m³ nei ratti femmine dopo un periodo di esposizione di 4 ore. Ciò significa che il 50% dei ratti morirà se esposti a vapori di benzotricloruro a una concentrazione superiore a 600 mg/m³ o circa 500 mg/m³, rispettivamente, per 4 ore.
È stato anche dimostrato che il benzotricloruro è mutageno nei sistemi di test batterici. Ciò significa che può causare cambiamenti nel DNA che possono portare al cancro.
L’esposizione per inalazione di topi femmine al benzotricloruro ha causato tumori polmonari e cutanei sia benigni che maligni. In uno studio sui tumori polmonari nei topi, l’iniezione intraperitoneale di benzotricloruro ha aumentato l’incidenza di adenomi polmonari.
Inoltre, la somministrazione orale di benzotricloruro a 40 topi femmina per 25 settimane ha indotto neoplasie nel prestomaco, nel polmone e nella ghiandola timica alla dose più elevata.
Questi risultati suggeriscono che il benzotricloruro è un potenziale cancerogeno per gli esseri umani. È importante evitare l’esposizione a questa sostanza chimica utilizzando le opportune precauzioni di sicurezza quando la si maneggia.
Riferimento
- Benzyl Chloride and Other Side-Chain-Chlorinated Aromatic Hydrocarbons; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.o04_o01.pub2
