Benzidina: proprietà, produzione e usi
Cos’è la benzidina?
La benzidina è un composto organico con formula chimica C12H12N2. È un solido cristallino giallo-raggiante, grigio-rossastro o bianco, leggermente solubile in acqua.
La benzidina è una base difenilica ampiamente utilizzata come intermedio nella produzione di coloranti e pigmenti azoici. Viene anche utilizzata come agente di reticolazione nelle plastiche poliuretaniche e come reagente analitico e diagnostico.
La benzidina può reagire con una varietà di sostanze, tra cui cationi, anioni, composti organici e agenti ossidanti. Questa versatilità li rende strumenti preziosi per un’ampia gamma di applicazioni.
Sommario
1. Proprietà fisiche della benzidina
La benzidina è un composto diacido con formula chimica C12H12N2 e massa molare di 184,24 g/mol. Le proprietà fisiche della benzidina sono elencate nella seguente tabella:
| Proprietà | Valore |
|---|---|
| Aspetto | Polvere bianca |
| Punto di fusione | 128 °C (barre grossolane) 122-125 °C (modifica metastabile) |
| Punto di ebollizione | 400-401 °C |
| Densità | 1,25 g/cm3 |
| Solubilità in acqua | 1 parte in peso in 2447 parti di acqua a 12 °C 106,5 parti di acqua a 100 °C |
| Solubilità in solventi organici | Poco solubile in etere (45 parti) ed etanolo assoluto (13 parti) a 20 °C |
| Acidità | Diacidico (può donare due protoni in soluzione) |
| Costanti di dissociazione (a 30 °C) | K1 = 9,3 x 10-10, K2 = 5,6 x 10-11 |
| Calore di neutralizzazione | 106,5 kJ/mol |
| Pressione di vapore | < 0,1 mmHg a 25 °C |
| Indice di rifrazione | 1,652 a 25 °C |
| Punto di infiammabilità | 205 °C |
| Temperatura di autoaccensione | 300 °C |
2. Reazioni chimiche della benzidina
La benzidina presenta le seguenti reazioni chimiche:
- Esposizione all’aria: la benzidina scolorisce se esposta all’aria.
- Resistenza all’acqua: la benzidina è resistente all’acqua.
- Reazioni cromatiche: la benzidina forma colorazioni blu, verdi o rosse e precipita con agenti ossidanti. Queste reazioni sono utili per rilevare agenti ossidanti.
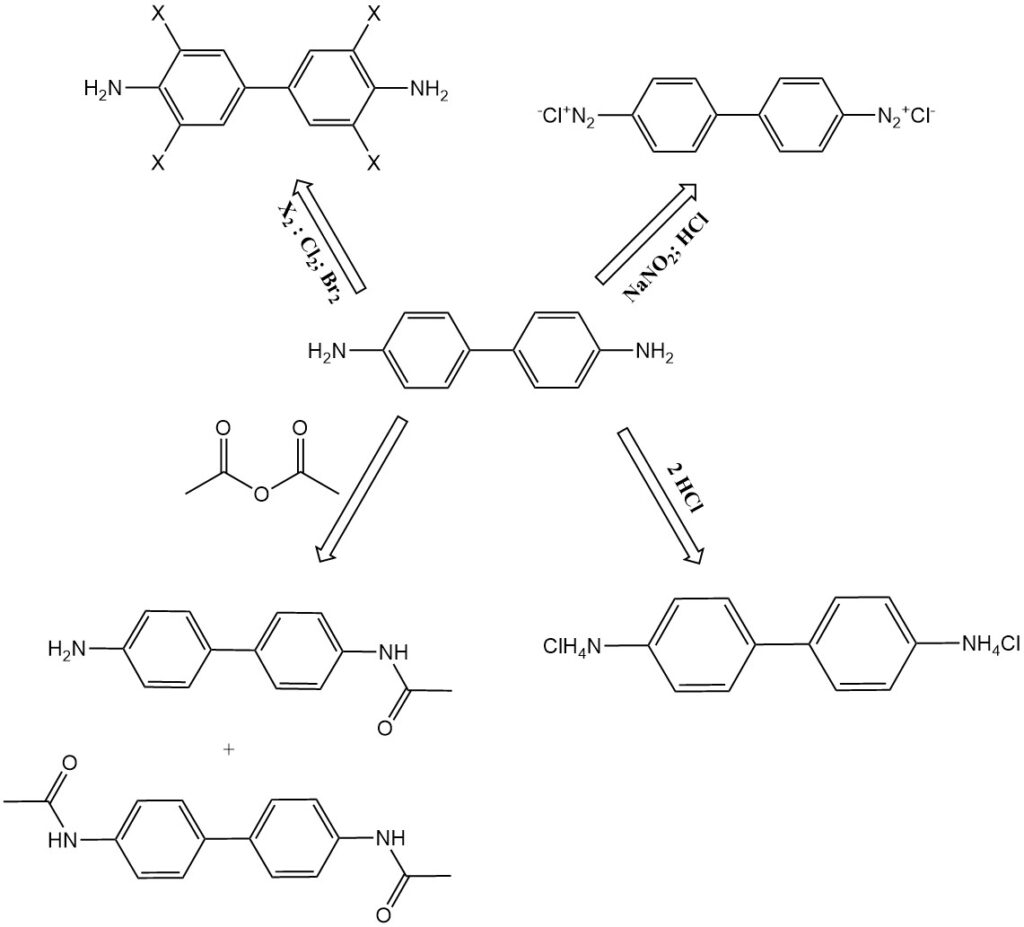
- Clorazione e bromurazione: la benzidina si trasforma rispettivamente in 3,3′,5,5′-tetraclorobenzidina e tetrabromobenzidina.
- Nitrazione e solfonazione: il solfato di benzidina produce 2-nitrobenzidina, 2,2′-dinitrobenzidina e 2,3′-dinitrobenzene tramite reazioni di nitrazione. Acidi solfonici e solfoni della benzidina possono essere formati in condizioni di solfonazione.
- N-acetilazione: la benzidina reagisce con l’anidride acetica per formare prodotti di N-acetilazione, come N-acetil-benzidina e N,N’-diacetil-benzidina. Questi composti si trovano anche come metaboliti nella digestione animale.
- Diazotazione: la benzidina può essere diazotata per formare composti di tetrazonio. Il primo gruppo diazonio si accoppia vigorosamente, mentre il secondo reagisce più lentamente. Ciò consente la produzione di coloranti diazoici asimmetrici.
- Formazione di sali: la benzidina forma sali con acidi, come benzidina monocloridrato, benzidina dicloridrato e benzidina solfato.
3. Produzione di benzidina
La benzidina viene prodotta in tre fasi:
- Riduzione del gruppo nitro per formare composti idrazoici
- Riarrangiamento della benzidina
- Isolamento di basi
La benzidina è stata prodotta industrialmente dal nitrobenzene sin dalla fine del XIX secolo. I metodi di produzione comuni includono la riduzione alcalina del ferro, la riduzione dell’amalgama e la riduzione elettrochimica.
L’idrazobenzene risultante viene riorganizzato con acido cloridrico o acido solforico durante il raffreddamento e il prodotto viene isolato come cloridrato di benzidina o solfato di benzidina. Per ridurre al minimo il rischio di tossicità cronica, la conversione di questi sali in base libera viene evitata ove possibile.
3.1. Riduzione del nitrobenzene
La riduzione del nitrobenzene a idrazobenzene può essere rappresentata dalla seguente equazione:
2 C6H5NO2 + 10 H → C6H5NH-NHC6H5 + 4 H2O
Questo processo di riduzione è noto come processo Haber e procede attraverso diverse fasi, che coinvolgono la condensazione intermedia di un composto nitroso con un composto idrossilammina per formare il composto azossilico.
Questo metodo determina la formazione di composti idrazoici simmetrici. Il sottoprodotto primario generato è l’ammina primaria monociclica, come l’anilina, corrispondente al composto nitro originale. Questo sottoprodotto si forma sia dall’ulteriore riduzione della fenilidrossiammina sia dalla disproporzione del composto idrazo instabile.
Nelle applicazioni industriali vengono impiegate varie tecniche di riduzione, tra cui:
1. Riduzione con polvere di zinco: questo metodo prevede la riduzione di composti nitro aromatici con polvere di zinco in un ambiente alcalino. La reazione è data da:
2 C6H5NO2 + 5 Zn + 10 NaOH → C6H5NH-NHC6H5 + 5 Na2ZnO2 + 4 H2O
Industrialmente, il nitrobenzene viene disciolto in un solvente ad alto punto di ebollizione e la polvere di zinco viene sospesa nella soluzione. La soluzione di idrossido di sodio viene emulsionata e avviene la riduzione. È necessario un attento controllo della temperatura di reazione e il processo è completato quando il colore rosso della fase azoica svanisce.
2. Riduzione con ferro: la riduzione con soluzione di ferro e idrossido di sodio è meno comune nella chimica preparativa, ma è stata esplorata per la produzione commerciale. L’equazione di riduzione è:
2 C6H5NO2 + 4 Fe + 6 H2O → C6H5NH-NHC6H5 + 2 Fe(OH)2 + 2 Fe(OH)3
In questo metodo vengono utilizzate varie forme di ferro, come trucioli di ghisa o polvere di ferro. La riduzione viene condotta in un rapporto molare di 1:2:4 per nitrobenzene, ferro e idrossido di sodio, rispettivamente.
3. Riduzione con amalgama di sodio: l’amalgama di sodio viene impiegato per la riduzione del nitrobenzene a temperature elevate. La riduzione avviene in una miscela emulsionata di nitrobenzene in acqua o idrossido di sodio e si forma il prodotto azobenzene. Tuttavia, durante questo processo può verificarsi una certa sovrariduzione ad ammine monocicliche.
4. Riduzione elettrolitica: la riduzione elettrochimica su scala commerciale è un altro metodo utilizzato per la riduzione dei nitro a composti idrazo. Comporta l’uso di celle elettrolitiche con catodi, diaframmi e anodi e la reazione può essere rappresentata come:
2 C6H5NO2 + 10 H+ + 10 e– → C6H5NH-NHC6H5 + 4 H2O
La riduzione viene condotta a temperature elevate e densità di corrente specifiche, con il processo regolato tramite il controllo dell’aggiunta di reagenti.
5. Riduzione catalitica: il nitrobenzene può essere ridotto a idrazobenzene mediante idrogenazione catalitica in presenza di un catalizzatore palladio-carbonio. Questo metodo può includere alcol diluito, una base e condizioni di temperatura e pressione elevate.
Esistono altri agenti riducenti utilizzati nella chimica preparativa, come vari metalli, amalgami e agenti riducenti organici come metanolo, formaldeide e glucosio, che vengono impiegati in base a requisiti di reazione specifici.
3.2. Riarrangiamento della benzidina
Il riarrangiamento della benzidina è un passaggio fondamentale nella produzione di composti diamminodifenilici. Questi composti si formano riorganizzando i composti idrazo aromatici, che inizialmente derivano dalla riduzione dei composti nitro aromatici con una soluzione alcalina.
Il processo di riorganizzazione, tipicamente catalizzato da acidi minerali, porta alla formazione di composti diaminodifenilici (1), (2) e (3) e composti amminodifenilamminici (4) e (5).

- I riarrangiamenti orto producono piccole quantità di o-benzidina (2,2′-diaminodifenile) (2) e difenilina (2,4′-diaminodifenile) (3).
- I riarrangiamenti parziali producono o-semidina (2-amminodifenilammina) (4) e p-semidina (4-amminodifenilammina) (5).

Il tipo e la quantità di prodotti di riarrangiamento sono influenzati dalla struttura chimica del materiale di partenza, ma possono essere regolati solo in minima parte variando le condizioni di reazione. Alcuni sottoprodotti, come la difenilina (3), vengono prodotti in quantità fino al 15%, ma non hanno alcun valore commerciale.
Il riarrangiamento della benzidina è una vera reazione intramolecolare, il che significa che non produce benzidine miste da miscele di diversi composti idrazoici. Invece, produce esclusivamente la corrispondente benzidina asimmetrica da idrazobenzeni sostituiti in modo asimmetrico.
Nel processo industriale, il riarrangiamento della benzidina inizia con la soluzione calda ottenuta dalla riduzione del nitrobenzene in idrazobenzene. Mentre l’isolamento intermedio dell’idrazobenzene non è sempre necessario, è consigliabile in casi specifici, come le riduzioni di amalgama.
Per ridurre il contenuto di azo dell’idrazobenzene, alcuni agenti riducenti come l’idrosolfito di sodio (ditionito di sodio) o la polvere di zinco possono essere aggiunti prima del riarrangiamento.
La reazione avviene quando la soluzione di idrazobenzene viene miscelata con un acido minerale adatto, in genere acido cloridrico al 10-30%, acido solforico al 20-80% o una miscela dei due.
La temperatura ottimale per la riorganizzazione è di 100 °C per le basi difeniliche. È fondamentale mantenere le temperature entro l’intervallo appropriato, poiché un calore eccessivo può ridurre la resa, che in genere è mirata al 70-95%.
3.3. Isolamento del prodotto puro
La fase più importante della riorganizzazione della benzidina è la formazione del sale di acido cloridrico o solforico della benzidina. Questo sale può essere isolato direttamente, ad esempio mediante salatura con cloruro di sodio o solfato di sodio, oppure convertito prima nella base libera utilizzando un alcali diluito, come una soluzione di idrossido di sodio o una soluzione di ammoniaca.
I sottoprodotti, in particolare l’anilina e la difenilina, possono essere separati grazie alla loro maggiore solubilità. L’azobenzene è l’unico composto che rimane nel solvente inerte dopo l’estrazione acida e può essere riportato al processo di riduzione.
4. Usi della benzidina
La benzidina ha diverse applicazioni, tra cui:
- Produzione di coloranti: la benzidina viene utilizzata per produrre coloranti azoici per lana, cotone e pelle. Tuttavia, il suo utilizzo in questa capacità è diminuito a causa della sua cancerogenicità.
- Determinazione quantitativa dell’acido solforico: la benzidina può essere utilizzata per determinare la concentrazione di acido solforico.
- Rilevamento e determinazione di anioni e ioni metallici: la benzidina può essere utilizzata per rilevare e quantificare vari anioni e ioni metallici.
- Rilevamento di cloro libero o piridina: la benzidina può essere utilizzata per rilevare tracce di cloro libero o piridina nell’acqua potabile.
- Rilevamento del sangue: la benzidina può essere utilizzata per rilevare il sangue in base al suo cambiamento di colore dal verde al blu in presenza di perossido di idrogeno e perossidasi.
- Produzione di gomma: la benzidina è utilizzata come agente di reticolazione nella produzione di prodotti in gomma, come pneumatici e tubi flessibili.
- Produzione di plastica: la benzidina è utilizzata come stabilizzante nella produzione di alcune materie plastiche.
- Produzione farmaceutica: la benzidina è utilizzata come intermedio nella produzione di alcuni prodotti farmaceutici, come antistaminici e antispasmodici.
La benzidina è un composto altamente tossico, ma continua a essere utilizzata in varie sintesi chimiche e applicazioni.
5. Tossicologia della benzidina
Tossicità orale acuta: LD50 nei ratti = 1,57 g/kg
Esposizione alimentare subacuta: gli effetti avversi nei topi includono gonfiore torbido del fegato, degenerazione vacuolare dei tubuli renali, iperplasia degli elementi mieloidi nel midollo osseo e alterazioni delle cellule linfoidi nel timo e nella milza.
Assorbimento cutaneo e polmonare: sono disponibili informazioni limitate, ma le manifestazioni sistemiche di tossicità suggeriscono che potrebbe verificarsi un assorbimento significativo.
Iniezione endovenosa e metabolismo: la benzidina viene convertita in N-acetil-benzidina e N,N’-diacetilbenzidina, che vengono ulteriormente trasformate in N-idrossi-N,N’-diacetilbenzidina e 3-idrossi-N,N’-diacetilbenzidina. Quest’ultimo composto si lega agli acidi nucleici.
Risultati del test di Ames: la benzidina risulta positiva al test di Ames e anche i suoi metaboliti hanno dimostrato di indurre mutazioni.
Effetti sul DNA: la benzidina provoca rotture del filamento di DNA e trasformazione cellulare. Induce sintesi di DNA non programmata nelle cellule HeLa e negli epatociti di ratto.
Proprietà cancerogene: è stato dimostrato che il cloridrato di benzidina induce carcinoma epatocellulare nei topi e altri tumori nei ratti, nei criceti e negli esseri umani.
La benzidina è un potente cancerogeno negli animali e negli esseri umani. È classificata come Gruppo A1 dalla commissione MAK e Gruppo A1b dall’ACGIH.
Riferimento
- Benzidine and Benzidine Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_539
