Antracene: proprietà, produzione e usi
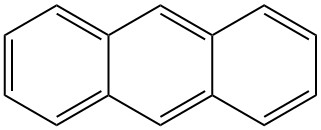
L’antracene è un idrocarburo aromatico policiclico solido con formula C14H10 composto da tre anelli benzenici fusi. È un componente del catrame di carbone ed è stato scoperto nel 1832 da J. Dumas e H. A. Laurent. L’antracene è incolore ma presenta una fluorescenza blu sotto la radiazione ultravioletta.
Sommario
1. Proprietà fisiche dell’antracene
L’antracene è un solido incolore con un peso molecolare di 178,24 g/mol, un punto di fusione di 218 °C e un punto di ebollizione di 340 °C a 101,3 kPa. Presenta una fluorescenza blu-viola e può sublimare, ovvero passa direttamente da solido a vapore.
L’antracene può formare cristalli misti con fenantrene e carbazolo in sistemi binari e ternari.
L’antracene ha una leggera solubilità in benzene, cloroformio e disolfuro di carbonio, una minore solubilità in etere dietilico ed etanolo ed è quasi insolubile in acqua.
L’antracene ha una capacità termica specifica di 1164 J/kg a 24 °C, un calore di fusione di 162 kJ/kg, un calore di vaporizzazione di 294 kJ/kg e un calore di combustione di 40110 kJ/kg a 25 °C.
2. Reazioni chimiche dell’antracene
L’antracene può subire varie trasformazioni chimiche in condizioni specifiche:
1. Irradiazione con luce UV: quando esposto alla luce UV in assenza di ossigeno, l’antracene si converte in diantracene.
2. Ossidazione con ossigeno: in presenza di ossigeno, l’antracene reagisce aggiungendo ossigeno alle posizioni 9,10, con conseguente formazione di un composto perossido

3. Pirocondensazione: tramite pirocondensazione, l’antracene può produrre due prodotti, ovvero 2,9-bianthryl e 9,10-diidroantracene.
4. Idrogenazione: l’antracene può essere facilmente idrogenato per produrre 9,10-diidroantracene. Utilizzando catalizzatori omogenei al rutenio, può subire un’ulteriore idrogenazione per produrre 1,2,3,4-tetraidroantracene e la successiva idrogenazione può portare alla formazione di 1,2,3,4,5,6,7,8-ottaidroantracene.

5. Ossidazione: quando sottoposto a ossidazione, sia in fase liquida che gassosa, l’antracene si trasforma in antrachinone.
6. Alogenazione, nitrazione e solfonazione: l’antracene subisce principalmente alogenazione e nitrazione nelle posizioni 9 e 10 e solfonazione nelle posizioni 1 o 2, a seconda delle condizioni di reazione specifiche.

7. Addizione di Diels-Alder: l’antracene è in grado di subire reazioni di addizione di Diels-Alder con dienofili come l’anidride maleica. Queste aggiunte si verificano in genere nelle posizioni 9 e 10.
L’antracene può reagire con il magnesio metallico nel tetraidrofurano (THF) per formare un addotto magnesio-antracene. Questo addotto può essere ulteriormente elaborato per ottenere magnesio altamente reattivo, che può essere successivamente convertito in idruro di magnesio e reagenti di Grignard.
Queste reazioni chimiche illustrano la versatilità dell’antracene in vari processi di sintesi e il suo potenziale per la formazione di diversi composti organici in condizioni specifiche.
3. Produzione di antracene
3.1. Estrazione di antracene dal catrame di carbone
L’antracene viene estratto dal catrame di carbone ad alta temperatura mediante distillazione continua del catrame. La frazione che bolle tra 300 e 360 °C, nota come olio di antracene I, viene concentrata per contenere circa il 7% di antracene.
Questo olio viene quindi raffreddato e centrifugato per produrre residui di antracene, che contengono circa il 20-35% di antracene.
I residui di antracene possono essere ulteriormente purificati tramite cristallizzazione o distillazione. La distillazione produce un prodotto grezzo contenente il 45-55% di antracene, comunemente noto come “antracene 50s”. L’antracene 50s di qualità migliorata può essere ottenuto tramite un processo di distillazione a colonna continua in due fasi.
Per ottenere una purezza maggiore, l’antracene 50s grezzo può essere ricristallizzato utilizzando solventi selettivi. La ricristallizzazione ripetuta da un eccesso di piridina da tre a quattro volte, ad esempio, produce antracene con una purezza del 95% rispetto al suo contenuto di antracene 50s, con una resa dell’80%. Per la ricristallizzazione possono essere utilizzati anche vari altri solventi selettivi.
3.2. Metodi di estrazione alternativi
L’antracene può anche essere estratto dall’olio altobollente della liquefazione del carbone. Per l’antracene grezzo privo di carbazolo, è possibile utilizzare la distillazione e la cristallizzazione dei residui della pirolisi delle frazioni idrocarburiche in olefine, sebbene questi oli di pirolisi contengano in genere meno dell’1% di antracene.
L’idrodealchilazione selettiva della frazione aromatica contenente metilfenantreni e metilantraceni può aumentare le rese di antracene.
3.3. Sintesi dell’antracene
L’antracene può anche essere sintetizzato con vari metodi, tra cui l’idrogenazione del fenantrene, l’isomerizzazione del sim-ottaidrofenantrene a sim-ottaidroantracene e la successiva deidrogenazione.
Una miscela di sim-ottaidroantracene e sim-ottaidrofenantrene può essere ottenuta tramite disproporzionamento catalitico della tetralina.
Inoltre, l’antracene può essere formato dal difenilmetano in presenza di HF/BF3 a 80 °C e dalla reazione termica dell’o-metildifenilmetano a circa 600 °C.
Tuttavia, questi metodi di sintesi non sono commercialmente significativi a causa dell’ampia disponibilità di antracene dal catrame di carbone.
4. Utilizzi dell’antracene
L’antracene è un composto organico versatile con un’ampia gamma di applicazioni. Su scala commerciale, viene utilizzato principalmente per produrre antrachinone, una sostanza chimica industriale chiave utilizzata nella produzione di coloranti, pigmenti e altri prodotti chimici.
L’antracene è anche oggetto di esplorazione per una serie di applicazioni alternative. Ad esempio, è stato proposto come potenziale plastificante per resine termoindurenti ed è stato anche considerato come stabilizzatore della luce per polimeri.
Nella scienza dei materiali, i derivati dell’antracene sono oggetto di esplorazione come elementi costitutivi per materie plastiche ingegneristiche. Ad esempio, il polietere del 9,10-diidrossiantracene è una plastica ad alte prestazioni con eccellenti proprietà meccaniche e termiche.
L’antracene è un fotoconduttore organico cristallino, il che significa che può generare una corrente elettrica quando esposto alla luce. Questa proprietà rende l’antracene utile nell’elettrofotografia, una tecnologia comunemente associata alla fotocopiatura e alla stampa laser.
Nella sua forma più pura, l’antracene è utilizzato come scintillante nelle applicazioni scientifiche. Gli scintillanti sono materiali che emettono luce quando interagiscono con le radiazioni.
Gli scintillanti di antracene sono particolarmente utili per il rilevamento di radiazioni ad alta energia, come raggi gamma e raggi X. Questo utilizzo è fondamentale in campi come la fisica nucleare, dove la misurazione precisa delle radiazioni è di fondamentale importanza per scopi di ricerca e sicurezza.
5. Tossicologia dell’antracene
L’antracene è un idrocarburo aromatico policiclico che è stato studiato per la sua potenziale cancerogenicità, ma l’antracene puro in condizioni controllate non mostra effetti cancerogeni significativi. Ciò è supportato da risultati negativi in numerosi test di genotossicità in vitro e in vivo.
Ad esempio, iniezioni sottocutanee di 20 mg di antracene in una soluzione oleosa 33 volte alla settimana hanno provocato fibromi locali, talvolta accompagnati da escrescenze simili a sarcomi. Tuttavia, questo risultato non riflette il potenziale cancerogeno dell’antracene puro.
Inoltre, un test di inizio del tumore epidermico sui topi utilizzando antracene puro ed estere di forbolo come promotore ha causato papillomi solo in pochi casi (4 su 28 animali). Questi casi limitati non stabiliscono un forte legame cancerogeno per l’antracene puro.
Pertanto, l’Agenzia internazionale per la ricerca sul cancro (IARC) e l’Agenzia per la protezione ambientale degli Stati Uniti (EPA) hanno classificato l’antracene come “non classificabile per quanto riguarda la sua cancerogenicità per l’uomo” (Categoria IARC 3 ed EPA Gruppo D).
In termini di tossicità acuta, la somministrazione orale di 1,7 g/kg di antracene puro ai topi non ha avuto effetti letali.
L’antracene viene anche assorbito attraverso la pelle. Quando una soluzione marcata con 14C in esano o acetone (circa 9 mg/cm³) è stata applicata localmente sulla pelle del ratto, circa il 50% è stato assorbito entro 6 giorni, con il 29% recuperato dalle urine, il 22% dalle feci e l’1% da vari tessuti, principalmente fegato e reni. Dopo solo 1 giorno, il 20% della dose era già presente nelle urine (circa il 17%) e nelle feci (circa il 3%).
L’antracene è un sensibilizzante cutaneo e può causare fotosensibilità locale. Come misura di sicurezza, è stato proposto un valore limite di soglia (TLV) raccomandato di 0,1 mg/m³ per ridurre al minimo i potenziali problemi di esposizione.
Riferimento
- Anthracene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_343.pub2
