Anidride acetica: proprietà, reazioni, produzione e usi
Cos’è l’anidride acetica?
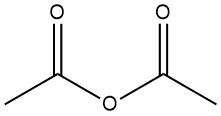
L’anidride acetica è un composto organico con formula chimica (CH3CO)2O. È un liquido incolore dall’odore pungente ed è comunemente usato come agente acetilante e disidratante. È stato preparato nel 1852 dalla reazione di cloruro di benzoile e acetato di potassio fuso.
Da allora, l’anidride acetica è emersa come un importante intermedio organico con un significato sostanziale in varie applicazioni di ricerca e industriali. Attualmente, è ampiamente utilizzata sia nella sintesi accademica che in quella industriale.
L’anidride acetica si trova in tracce nell’uva da vino (Vitis vinifera), ma è principalmente prodotta industrialmente.
Sommario
1. Proprietà fisiche dell’anidride acetica
L’anidride acetica è un liquido incolore caratterizzato da un odore pungente e possiede forti proprietà lacrimatorie. I dati fisici chiave associati all’anidride acetica sono forniti di seguito.
| Proprietà | Valore |
|---|---|
| Formula molecolare | (CH3CO)2O |
| Peso molecolare | 102,09 g/mol |
| Aspetto | Liquido incolore |
| Densità | 1,08 g/cm3 |
| Punto di ebollizione | 140,1 °C |
| Punto di fusione | -73,1 °C |
| Solubilità in acqua | Reagisce violentemente; miscibile |
| Odore | Pungente |
| Pressione di vapore | 13 mmHg a 25 °C |
| Punto di infiammabilità | 49 °C (vaso chiuso) |
| Temperatura di autoaccensione | 485 °C |
| Indice di rifrazione | 1,392 |
| Viscosità | 1,3 cP a 25 °C |
| Limiti di esplosività | 2,3 - 10,6% (volume) |
A una temperatura di -73,1 °C, l’anidride acetica subisce una transizione di fase da solido a liquido (punto di fusione). D’altro canto, bolle a 140 °C sotto una pressione di 101,3 kPa (punto di ebollizione).
L’anidride acetica dimostra miscibilità con solventi polari e mostra solubilità in alcol freddo, sebbene con una lenta velocità di decomposizione. Quando disciolta in acqua a una temperatura di 20 °C, la solubilità dell’anidride acetica è di circa il 2,6% in peso, accompagnata da un graduale processo di decomposizione.
Al contrario, a una temperatura di 15 °C, la solubilità dell’acqua nell’anidride acetica è di circa il 10,7% in peso, anche con una graduale tendenza alla decomposizione.
2. Reazioni chimiche dell’anidride acetica
L’anidride acetica presenta un’ampia gamma di reazioni chimiche ed è stata ampiamente studiata come anidride di acido carbossilico alifatico.
Negli ultimi 25 anni, l’anidride acetica è stata utilizzata in numerose pubblicazioni e brevetti, in particolare per l’acetilazione di gruppi idrossilici (OH) o amminici (NH), fungendo da passaggio primario in queste reazioni.
2.1. Acetilazione
L’anidride acetica nella piridina viene utilizzata per introdurre il gruppo acetile in diverse molecole, inclusi i gruppi idrossilici, amminici e tiolici.
2.1.1. O-acetilazione
L’anidride acetica è altamente adatta per reazioni di esterificazione con alcoli, che sono spesso difficili o impossibili da ottenere utilizzando acido acetico. Durante questo processo, viene liberato acido acetico. Catalizzatori come basi, acidi forti e sali come l’acetato di sodio sono comunemente impiegati.
Esempi notevoli di reazione dell’anidride acetica con gruppi idrossilici includono la formazione di acetilcellulosa, acido acetilsalicilico (comunemente noto come Aspirina) e triacetato di glicerolo.
Quando l’anidride acetica reagisce con il perossido di idrogeno, produce acido peracetico o perossido di diacetile, il risultato dipende dal rapporto molare dei reagenti:
(CH3CO)2O + 2 H2O2 → 2 CH3CO3H
(CH3CO)2O + H2O2 → CH3COOH + CH3CO3H
(CH3CO)2O + CH3CO3H → CH3COOOOCOCH3 + CH3COOH
2.1.2. N-acetilazione
L’acetilazione di composti contenenti gruppi NH produce acetamidi, seguendo l’equazione generale:
RR’NH + (CH3CO)2O → RR’NCOCH3 + CH3COOH
Qui, R e R’ rappresentano gruppi idrogeno (H) o alchilici. Le ammine alifatiche reagiscono in genere senza bisogno di riscaldamento. L’anilina, ad esempio, produce acetanilide, che impedisce l’ossidazione durante la successiva nitrazione.
Le reazioni di N-acetilazione generalmente si verificano più velocemente dell’acetilazione dei gruppi OH, consentendo l’acetilazione parziale di composti con più gruppi funzionali. Esempi includono la produzione di N-acetilamminoacidi come N-acetilmetionina-S-ossido (1) e acidi N-acetil antranilici (2).

Le ammidi e le carbammidi con gruppi NH liberi, sia alifatici che aromatici, possono essere acetilate usando anidride acetica.
L’acido solforico è comunemente usato come catalizzatore. Questa reazione trova applicazione nella sintesi di vari prodotti come N,N,N’,N’-tetraacetiletilendiammina ((CH3CO)2NCH2CH2N(COCH3)2) e 2,4,6,8-tetraacetilazabiciclo[3.3.1]nonano-3,7-dione.
![2,4,6,8-tetraacetylazabicyclo[3.3.1]nonane-3,7-dione.](https://chemcess.com/wp-content/uploads/2023/07/2468-tetraacetylazabicyclo3.3.1nonane-37-dione.jpg)
2.1.3. C-acetilazione
I composti con legami CH reattivi possono subire acetilazione con anidride acetica, a volte richiedendo un catalizzatore. Esempi degni di nota includono la produzione di etile α-cianoacetoacetato (CH3COCH(CN)COOC2H5) utilizzando carbonato di potassio come catalizzatore e la reazione di Friedel-Crafts tra anidride acetica e idrocarburi aromatici come il benzene, con conseguente formazione di acetofenone.
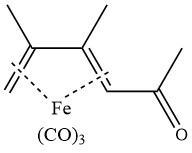
L’acetilazione del ferro tricarbonile 2,3-dimetilbutadiene in presenza di cloruro di alluminio produce il seguente complesso:
La reazione dei chetoni con l’anidride acetica, catalizzata dal trifluoruro di boro, porta alla formazione di β-dichetoni.
Il triacetilmetano può essere sintetizzato direttamente da acetato di isopropenile, anidride acetica e un catalizzatore di cloruro di alluminio.
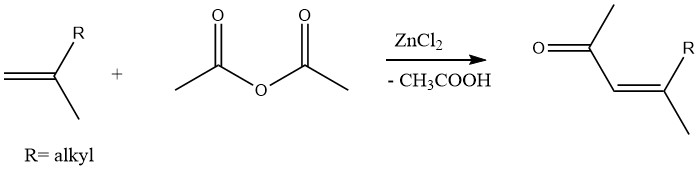
Analogamente, i metil chetoni insaturi possono essere prodotti tramite l’acetilazione di olefine con anidride acetica in presenza di cloruro di zinco come catalizzatore:
2.1.4. Acetilazione di acidi minerali
La reazione dell’anidride acetica con l’acido nitrico determina la formazione di acetilnitrato, spesso impiegato come agente nitrante in chimica organica. L’acetilnitrato può anche essere sintetizzato utilizzando pentossido di diazoto e anidride acetica.
Altri acidi forti come l’acido solforico, gli acidi solfonici e l’acido cloridrico possono formare anidridi miste con l’anidride acetica. La reazione dell’anidride acetica con l’acido fosforoso produce acido 1-idrossietano-1,1-difosfonico.

2.1.5. Acetilazione degli ossidi
Il triossido di antimonio reagisce con l’anidride acetica per produrre triacetato di antimonio (Sb(OCOCH3)3). Una reazione simile con il triossido di cromo porta a soluzioni di acetato di cromile, spesso utilizzate nell’ossidazione di olefine e idrocarburi, ma bisogna fare attenzione perché occasionalmente possono essere esplosive.
2.1.6. Acetilazione dei sali
Vari sali reagiscono con le anidridi degli acidi carbossilici in modo simile ai loro corrispondenti acidi liberi:
Li−C−CR + (CH3CO)2O → CH3CO−C−CR + CH3COOLi
Il perossido di bario trattato con anidride acetica produce perossido di diacetile:
BaO2 + (CH3CO)2O → (CH3CO)2O2 + BaO
Un metodo generale per produrre vinil chetoni prevede la reazione di bromuri di magnesio vinilico con anidride acetica.
2.1.7. Produzione di acetossi silani
L’anidride acetica reagisce con i silani secondo l’equazione:

dove X = H, Cl, OR, NR2.
2.1.8. Addizione a composti eterociclici con scissione dell’anello
Queste reazioni sono concettualmente simili a quelle descritte sopra. Ad esempio, il diacetato di glicole etilenico può essere prodotto dall’ossido di etilene in presenza di catalizzatori fortemente acidi o basici, e i diacetati di ossimetilenico possono essere ottenuti dal triossano.
2.1.9. Addizione ossidativa ai doppi legami carbonio-carbonio
Le reazioni di addizione ossidativa determinano la formazione dei corrispondenti diacetati. Ad esempio, l’aggiunta di etilene all’anidride acetica produce diacetato di glicole etilenico. Allo stesso modo, il butadiene può essere convertito in 1,4-diacetossi-2-butene attraverso un processo simile.
2.1.10. Produzione di perossidi diacilici misti
I perossidi diacilici possono essere sintetizzati facendo reagire l’ossigeno con miscele di aldeidi alifatiche e anidride acetica in presenza di acetato di sodio.
2.1.11. Reazione con N-ossidi
Le reazioni con N-ossidi producono vari prodotti in base al tipo specifico di N-ossido. La piridina-N-ossido, ad esempio, produce 2-acetilossipiridina, mentre la 4-picolina-N-ossido forma una miscela di 4-acetilossimetilenipiridina e 3-acetilossi-4-metilpiridina. La reazione di Polonovski degli N-ossidi determina la formazione di formaldeide, aldeidi insature e ammidi acide.
2.1.12. Reazione con S-ossidi
La riduzione dei solfossidi a solfuri mediante anidride acetica è nota come reazione di Pummerer. Ad esempio, CH3SOR reagisce con l’anidride acetica per produrre CH3COOCH2SR e CH3COOH.
Questa reazione viene anche utilizzata per ossidare alcoli primari e secondari, anche quelli stericamente impediti, utilizzando miscele di dimetilsolfossido o tetrametilensolfossido insieme ad anidride acetica, con conseguente formazione dei corrispondenti composti carbonilici.
2.1.13. Produzione di acilali e acetati di vinile
Le aldeidi reagiscono con l’anidride acetica in presenza di catalizzatori acidi per formare acilali. Se l’aldeide possiede un atomo di idrogeno α, l’eliminazione dell’acido acetico porta alla formazione del corrispondente acetato di vinile. L’aggiunta di zinco facilita la scissione della frazione di acido acetico. Questo processo è particolarmente adatto per la sintesi di 2,2-diclorovinilacetato.
2.1.14. Trifluoruro di boro
L’anidride acetica e le anidridi acetiche sostituite possono essere trasformate in acetilchetoni utilizzando un complesso di trifluoruro di boro che si decompone in acqua calda.
2.2. Disidratazione
L’anidride acetica trova applicazione come agente disidratante in vari settori, tra cui l’industria degli esplosivi. Un esempio notevole della sua proprietà disidratante è nella produzione di esogeno (1,3,5-trinitroesaidro-1,3,5-triazina).

Nella sintesi del nitroestere del 1,2,4,5-tetraidrossi-3,6-dinitrocicloesano, l’anidride acetica viene impiegata per la sua capacità di legare l’acqua:

Inoltre, l’anidride acetica viene utilizzata nella produzione di cianuri alchilici mediante disidratazione degli aldossime:
RCH=NOH + (CH3CO)2O → RCN + 2 CH3COOH
Inoltre, l’anidride acetica funge da agente disidratante in numerose reazioni di ciclizzazione.
2.3. Reazioni dei protoni α
La reazione di Perkin è un metodo ampiamente utilizzato per la sintesi di acidi α, β-insaturi da aldeidi aromatiche, tra cui la benzaldeide. Questa reazione avviene in genere in presenza di acetato di potassio o acetato di sodio. Viene utilizzata anche per la produzione di acido cinnamalacetico.
Reazioni simili includono la carbossimetilazione ossidativa, in cui vengono utilizzati anidride acetica e agenti ossidanti, e la conversione di alcheni a catena lunga nei loro corrispondenti derivati di acido carbossilico.
2.4. Reazioni di un singolo gruppo carbonilico
In alcuni casi, è possibile che solo uno dei gruppi carbonilici nell’anidride acetica partecipi a una reazione. Ad esempio, quando l’anidride acetica reagisce con acido cianidrico in presenza di una base, forma il composto (3). Analogamente, in presenza di un reattivo di Grignard (RMgBr), l’anidride acetica produce il composto (4).

2.5. Produzione di chetenuro d’argento
Quando l’acetato d’argento e l’anidride acetica vengono fatti reagire in presenza di piridina a temperatura ambiente, subiscono una reazione per formare un complesso piridinico di chetenuro d’argento. Se viene impiegato un eccesso di anidride acetica, la miscela risultante può essere sottoposta a distillazione frazionata di piridina e acido acetico, portando all’isolamento del chetenuro d’argento.
3. Produzione di anidride acetica
Storicamente, il metodo più antico per produrre anidride acetica era la conversione dell’acetato di sodio con un eccesso di un cloruro inorganico, come cloruro di tionile, cloruro di solforile o cloruro di fosforile.
In questo processo, metà dell’acetato di sodio viene convertito in cloruro di acetile, che quindi reagisce con l’acetato di sodio rimanente per formare anidride acetica.
Un altro sviluppo è stata la conversione dell’acido acetico con fosgene in presenza di cloruro di alluminio, consentendo un funzionamento continuo:
2 CH3COOH + COCl2 → (CH3CO)2O + 2 HCl + CO2
Altri due metodi utilizzati in passato includevano la scissione del diacetato di etilidene per formare acetaldeide e anidride acetica in presenza di catalizzatori acidi come il cloruro di zinco, nonché la reazione dell’acetato di vinile con acido acetico su catalizzatori al palladio(II) per formare acetaldeide e anidride acetica. Tuttavia, questi processi non hanno più importanza industriale.
Attualmente, la produzione di anidride acetica viene effettuata principalmente tramite il processo del chetene o l’ossidazione dell’acetaldeide. Un altro metodo, noto come carbonilazione dell’acetato di metile (processo Halcon), è stato introdotto nel 1983.
Nell’Europa occidentale, circa il 77% dell’anidride acetica viene prodotto tramite il processo del chetene, mentre il 23% viene prodotto tramite l’ossidazione dell’acetaldeide.
Negli Stati Uniti, dall’introduzione del processo Halcon nello stabilimento Tennessee-Eastman, il 25% dell’anidride acetica viene prodotto tramite questo metodo, mentre il 75% viene prodotto tramite il processo del chetene.
3.1. Produzione di anidride acetica tramite processo del chetene
Il processo del chetene prevede due fasi: la scissione termica dell’acido acetico per formare chetene e la successiva reazione del chetene con acido acetico per produrre anidride acetica. Le reazioni complessive possono essere riassunte come segue:
1. Scissione termica dell’acido acetico:
CH3COOH → CH2=C=O + H2O (ΔH = 147 kJ/mol)
2. Reazione del chetene con acido acetico:
CH2=C=O + CH3COOH → (CH3CO)2O (ΔH = -63 kJ/mol)
La scissione termica dell’acido acetico per produrre chetene e acqua viene eseguita riscaldando il vapore caldo dell’acido acetico a una temperatura di 700-750 °C in presenza di tracce di catalizzatore acido fosforico.
La pressione del reattore viene in genere ridotta per consentire l’isolamento del chetene prima che reagisca con acido acetico o acqua. Il processo di scissione avviene in un reattore multicoil con bobine realizzate in leghe di acciaio altamente resistenti al calore, come il Sicromal.
Il processo del chetene prevede più fasi e configurazioni di apparecchiature, a seconda della capacità di produzione desiderata.
Nelle operazioni su piccola scala, vengono utilizzati forni di preriscaldamento e scissione separati, mentre i forni di medie dimensioni sono spesso costruiti come forni a camera singola riscaldati a gas o olio.
I forni su larga scala funzionano efficacemente con sistemi a tre o quattro camere e flussi di gas parziali. È anche possibile far funzionare più forni con acido acetico fornito da un evaporatore centrale.
Dopo la scissione termica dell’acido acetico, il chetene risultante viene quindi fatto reagire con acido acetico per produrre anidride acetica. Per questa reazione vengono comunemente utilizzati due processi: il processo di scrubber e il processo Wacker.
Nel processo di scrubber, il chetene viene assorbito facendo circolare acido acetico glaciale in scrubber riempiti con anelli Raschig. Il chetene viene assorbito principalmente nel primo scrubber e la miscela liquida contenente anidride grezza viene raccolta e raffreddata.
Nel processo Wacker, il chetene viene pompato attraverso una pompa ad anello liquido, dove reagisce con l’acido acetico a temperatura e pressione controllate. L’anidride grezza viene raccolta continuamente e una parte di essa viene restituita alla pompa di reazione.
L’anidride grezza ottenuta dalla reazione viene ulteriormente purificata tramite distillazione. Vengono utilizzati metodi di distillazione sia continui che discontinui.
Nella distillazione discontinua, si ottengono tre frazioni: forerun, middle run e anidride pura.
La distillazione continua coinvolge più colonne per separare le diverse frazioni. La purezza dell’anidride è in genere di circa il 99% nella distillazione discontinua, ma può essere migliorata operando a pressione ridotta.
Il processo Wacker viene utilizzato anche per il processo di workup, consentendo l’elaborazione di acidi di scarto senza la necessità di materiali aggiuntivi. Il processo ha caratteristiche di elevata affidabilità e risparmio energetico.
Per la produzione di 100 kg di anidride acetica, sono necessari circa 122 kg di acido acetico, considerando l’acido acetico diluito riconcentrato. La resa del processo è superiore al 96% a circa il 75% di scissione.
3.2. Produzione di anidride acetica mediante ossidazione di acetaldeide
L’anidride acetica può anche essere prodotta direttamente mediante l’ossidazione in fase liquida dell’acetaldeide. Questo processo comporta la reazione dell’acido peracetico, formato da ossigeno e acetaldeide, con una seconda molecola di acetaldeide per produrre anidride acetica e acqua.
Un raffreddamento efficiente e l’uso di catalizzatori adatti sono fondamentali in questo processo. Combinazioni di sali metallici, come acetato di manganese e acetato di rame, acetato di cobalto e acetato di nichel, o sali di cobalto e rame di acidi grassi superiori, sono comunemente usati come catalizzatori.
Per mantenere la temperatura di reazione e prevenire una rapida idrolisi dell’anidride acetica, il processo viene in genere eseguito tra 40 °C e 60 °C.
Un raffreddamento efficace è necessario a causa della natura esotermica della reazione e l’aggiunta di solventi bassobollenti come acetato di metile e acetato di etile, che formano miscele azeotropiche con l’acqua, aiuta nella separazione dell’acqua dalla miscela di reazione.
Il rapporto tra anidride acetica e acido acetico nel prodotto finale dipende dal rapporto iniziale tra acetato di etile e acetaldeide.
In pratica, una miscela di acetaldeide e acetato di etile viene ossidata con l’aggiunta di catalizzatori di acetato di cobalto e acetato di rame. Le condizioni di reazione ottimizzate possono portare a un rapporto più elevato tra anidride acetica e acido acetico. Vari solventi, tra cui cloruro di metilene, etere diisopropilico, cicloesanone e diacetato di etilidene, possono essere utilizzati come diluenti nel processo.
La miscela di gas contenente ossigeno e acetaldeide viene introdotta nel reattore, dove l’ossidazione avviene nella fase liquida in presenza di catalizzatori. L’effluente del reattore viene quindi fatto passare attraverso un condensatore raffreddato ad acqua, che funziona anche come separatore per i gas non condensabili.
L’acetaldeide fresca viene introdotta in una colonna riempita, dove si combina con il gas di scarico dal condensatore. I condensati dal condensatore e dalla colonna vengono distillati per ottenere il prodotto desiderato.
L’acetaldeide viene recuperata dal flusso di gas non condensabile. Il gas di scarico può contenere prodotti combustibili a basso punto di ebollizione e solventi, che possono essere bruciati.
Il processo descritto sopra fornisce un esempio e diversi produttori possono impiegare varianti di configurazioni del reattore e condizioni di reazione specifiche.
3.3. Produzione di anidride acetica mediante carbonilazione di acetato di metile
Il processo convenzionale per la produzione di anidride acetica prevede la decomposizione termica dell’acido acetico per formare chetene, che richiede una notevole quantità di energia.
Tuttavia, sono stati sviluppati processi alternativi, come il processo di produzione di acido acetico di Monsanto e la carbonilazione di acetato di metile.
La carbonilazione dell’acetato di metile per formare anidride acetica è stata brevettata da Halcon nel 1973 e il primo impianto che utilizza questo processo è entrato in funzione nel 1983. In questo processo, l’acetato di metile viene carbonilato in fase liquida a temperature comprese tra 160 °C e 190 °C e una pressione parziale di monossido di carbonio di 2-5 MPa.
Per la reazione di carbonilazione possono essere utilizzati vari catalizzatori, tra cui composti di rodio e nichel attivati da ioduri o altre sostanze contenenti iodio. I catalizzatori di rodio mostrano un’attività maggiore rispetto ai catalizzatori di nichel ed entrambi i catalizzatori mostrano una selettività superiore al 95%.
L’aggiunta di una piccola percentuale di idrogeno al monossido di carbonio utilizzato nella sintesi aumenta l’attività e la durata dei catalizzatori. I composti di cromo possono anche essere impiegati per accorciare la fase di induzione della reazione.
Il processo di carbonilazione può iniziare sia dall’acetato di metile che dall’etere dimetilico, con quest’ultimo convertito in acetato di metile prima della sua trasformazione in anidride acetica.
Il processo Halcon (Figura 1), ad esempio, prevede l’alimentazione continua di acetato di metile essiccato in un reattore rivestito con Hastelloy, dove viene carbonilato a 175 °C in presenza di una miscela di catalizzatori.

a) Compressore; b) Reattore di carbonilazione; c) Evaporatore; d) Adsorbitore; e) Colonna di distillazione; f) Condensatore; g) Scrubber
Il calore generato durante la reazione viene rimosso tramite scambio termico e utilizzato per preriscaldare l’acetato di metile e generare vapore a bassa pressione. Il monossido di carbonio non reagito viene riciclato dopo la rimozione dei gas condensabili.
Un flusso laterale viene lavato con anidride acetica pura per impedire l’accumulo di gas inerti. Il prodotto di reazione liquido che lascia il reattore viene sottoposto a distillazione flash per separare il liquido contenente catalizzatore per il riciclaggio.
L’anidride grezza viene ulteriormente purificata tramite distillazione in tre colonne consecutive, con la colonna finale che produce anidride acetica con purezza del 99%.
Per ridurre il contenuto di ioduro nell’anidride pura, è possibile aggiungere una soluzione di acetato di potassio in anidride acetica durante il processo di distillazione.
Questi processi alternativi offrono vantaggi rispetto al percorso di decomposizione termica convenzionale in termini di consumo energetico e utilizzo delle materie prime, consentendo la produzione di anidride acetica da fonti diverse dal petrolio, come il carbone.
4. Utilizzi dell’anidride acetica
L’anidride acetica è utilizzata sia come agente acetilante che come agente disidratante. Un’applicazione importante è l’acetilazione della cellulosa su larga scala. Tuttavia, ci sono diverse altre aree in cui viene impiegata l’anidride acetica:
1. Produzione di schiuma rigida di poli(metilacrilimide), dove agisce come agente legante per l’ammoniaca liberata durante la conversione dei gruppi ammidici in gruppi immidici.
2. Ausiliari plastici acetilati, tra cui triacetato di glicerolo, acetil tributil citrato e acetil ricinolato.
3. Produzione di esplosivi, in particolare nella fabbricazione di esogeno.
4. Produzione di alcuni tipi di liquidi per freni.
5. Produzione di ausiliari per fluidi di perforazione.
6. Industria dei detersivi, in particolare nella produzione di attivatori di sbiancamento a freddo come la tetraacetiletilendiammina.
7. Industria della tintura, dove l’anidride acetica, in combinazione con l’acido nitrico, viene utilizzata come agente nitrante, sfruttando le sue proprietà solventi e disidratanti.
8. Preparazione di vari intermedi organici, come il cloruro di cloroacetile, il perossido di diacetile, le anidridi carbossiliche superiori, gli acetati e il complesso di trifluoruro di boro.
9. Produzione di prodotti farmaceutici, tra cui acido acetilsalicilico (aspirina), p-acetilaminofenolo, acetanilide, acetofenacetina, teofillina, cloruro di acetilcolina, sulfonamidi, ormoni, vitamine e l’agente di contrasto per raggi X acido 2,4,6-triiodo-3,5-diacetilamidobenzoico.
10. Applicazioni nell’industria alimentare, principalmente nell’acetilazione di grassi animali e vegetali per ottenere le solubilità desiderate, produzione di acetostearine (materiali di imballaggio commestibili) e chiarificazione di oli vegetali.
11. Aromi e fragranze, dove viene utilizzato nella produzione di esteri e cumarina.
12. Erbicidi come metolaclor (Dual) e alaclor (Lasso).
Riferimenti
- Acetic Anhydride and Mixed Fatty Acid Anhydrides; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_065
- https://lotus.naturalproducts.net/compound/lotus_id/LTS0216280
