Acido Glicolico: Proprietà, Produzione, Reazioni e Usi

Cos’è l’acido glicolico?
L’acido glicolico solido è l’acido α-idrossicarbossilico più semplice con formula C2H4O3. Forma cristalli prismatici, monoclini e incolori. Questo acido presenta un’elevata solubilità in vari solventi, tra cui acqua, metanolo, etanolo, acetone e acetato di etile.
La volatilità dell’acido glicolico è limitata, con una tendenza minima a evaporare quando esposto al calore. Di conseguenza, non può essere distillato efficacemente in condizioni di vuoto.
Gli sforzi per distillarlo spesso provocano autoesterificazione, accompagnata da perdita di acqua, che porta alla formazione di di- e poliglicolidi.
Sommario
Proprietà fisiche dell’acido glicolico
In forma pura, l’acido glicolico è cristallizzabile e non può essere distillato senza decomposizione, nemmeno sotto vuoto.
Le proprietà fisiche sono le seguenti:
- Massa molare = 76 g/mol
- Punto di fusione = 78-80 °C
- Punto di ebollizione = 100 °C (decomposizione)
- Densità a 25 °C = 1,49
- Indice di rifrazione (20 °C) = 1,423
- pKa = 3,81 a 25 °C
Reazioni chimiche dell’acido glicolico
L’acido glicolico mostra la capacità di subire dimerizzazione eliminando acqua, con conseguente formazione di un diestere ciclico noto come 1,4-diossano-2,5-dione. Questi diesteri sono comunemente chiamati lattidi a causa della loro scoperta iniziale durante studi che coinvolgono acido lattico.

La polimerizzazione dell’acido glicolico tramite policondensazione produce Poliglicolide o poli(acido glicolico), che è un polimero biodegradabile e termoplastico. Questo tipo di esterificazione, noto come formazione di estolide, non è limitato agli acidi α-idrossicarbossilici.

Un’altra caratteristica importante dell’acido glicolico è che la vicinanza dei suoi due gruppi funzionali indebolisce i legami C-C intermedi. Di conseguenza, il trattamento di tali composti con acido solforico porta all’eliminazione dell’acido formico. Dopo l’esposizione all’acido solforico concentrato, l’acido formico si decompone, producendo monossido di carbonio e acqua.
Questa reazione di eliminazione avviene con elevata efficienza, rendendolo uno strumento prezioso per la determinazione quantitativa dell’acido glicolico.
Anche la scissione ossidativa è fattibile per l’acido glicolico. Ad esempio, quando trattato con perossido di idrogeno in presenza di ioni ferro(II), l’acido glicolico subisce facilmente l’eliminazione dell’anidride carbonica.
L’acido glicolico può essere deidrogenato cataliticamente ad acido gliossilico in fase di vapore.
Quando l’acido glicolico reagisce con PCl3, forma cloruro di cloroacetile (ClCH2COCl).
Produzione di acido glicolico
L’acido glicolico viene comunemente sintetizzato tramite l’idrolisi dell’acido monocloroacetico fuso utilizzando una soluzione acquosa al 50% di idrossido di sodio a temperature comprese tra 90 e 130 °C.
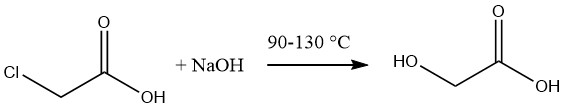
La soluzione risultante di acido glicolico ha una concentrazione approssimativa del 60%, accompagnata da un contenuto di cloruro di sodio del 12-14%. L’eliminazione del sale può essere ottenuta tramite evaporazione seguita dall’estrazione dell’acido utilizzando acetone.
Sono stati esplorati approcci alternativi in cui l’idrolisi viene condotta con catalizzatori acidi a temperature più elevate di 150-200 °C, impiegando acqua o vapore pressurizzato.
In questo processo, si forma acido cloridrico come sottoprodotto al posto del cloruro di sodio, che può essere separato tramite distillazione. Tuttavia, questo metodo richiede l’utilizzo di notevoli quantità di acqua, il che rappresenta un notevole svantaggio.
Negli Stati Uniti, la produzione commerciale di acido glicolico (da parte di Du Pont) comporta il trattamento di formaldeide o triossimetilene con monossido di carbonio e acqua in presenza di catalizzatori acidi a pressioni superiori a 30 MPa.

Un altro metodo, precedentemente impiegato da Degussa, comporta la riduzione elettrolitica dell’acido ossalico.
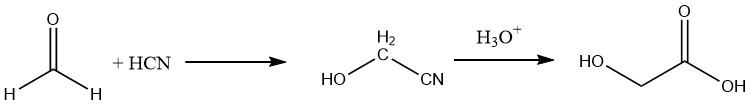
Inoltre, l’acido glicolico può essere preparato con una resa di circa il 90% idrolizzando il nitrile corrispondente, che si ottiene facendo reagire la formaldeide con l’acido cianidrico.
Uno studio recente dimostra che l’acido glicolico può essere prodotto tramite un processo di ossidazione selettiva dell’etilenglicole (EG) utilizzando nanocatalizzatori bimetallici PtMn/MCM-41 altamente efficienti.
Utilizzi dell’acido glicolico
L’acido glicolico è disponibile in commercio sotto forma di soluzioni acquose, con concentrazioni del 57% (Hoechst) o del 70% (Du Pont). Il consumo annuo globale di queste soluzioni è di circa 2000-3000 tonnellate.
In vari settori, l’acido glicolico trova applicazione nella tintura tessile, nella stampa e nell’antipiega. La sua capacità di formare chelati con ioni calcio (II) lo rende particolarmente adatto per mascherare la decalcinazione nell’industria della pelle. Viene anche utilizzato nei mordenti di allume e cromo, nonché nelle operazioni di lavorazione delle pellicce.
Grazie alla sua natura poco corrosiva e alle proprietà battericide, l’acido glicolico viene comunemente incorporato in detergenti acidi. È particolarmente efficace nella pulizia di contenitori del latte, attrezzature per la lavorazione del latte, fontanelle e per rimuovere ruggine e calcare da scambiatori di calore e condutture.
L’acido glicolico mostra effetti inibitori sulla crescita di batteri che ossidano il ferro. Il suo utilizzo elimina la necessità di aggiungere contemporaneamente agenti chelanti e battericidi.
Le proprietà complessanti dell’acido glicolico lo rendono adatto anche per applicazioni come lucidature del rame, agente di incisione per lastre litografiche e nella formulazione di bagni di elettrolucidatura e zincatura.
Derivati dell’acido glicolico
Il metilglicolato e l’etilglicolato sono due esteri dell’acido glicolico comunemente utilizzati come materiali di partenza per la sintesi in laboratorio di acido glicolico puro. In passato, venivano impiegati anche come solventi per resine e nitro- o acetilcellulosa. Oltre a questi esteri, solo la carbossimetilcellulosa e l’n-butilglicolato hanno rilevanza commerciale.
n-butilglicolato
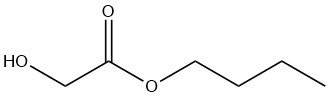
Il glicolato di n-butile è un liquido incolore miscibile con la maggior parte dei solventi organici. La sua solubilità in acqua è limitata all’8% in peso a 20 °C, sebbene il composto stesso possa contenere fino al 25% in peso di acqua.
Produzione di glicolato di n-butile
La produzione di glicolato di n-butile comporta il trattamento del cloroacetato di sodio con alcol n-butile a temperature comprese tra 125 e 160 °C, seguito da distillazione sotto vuoto.
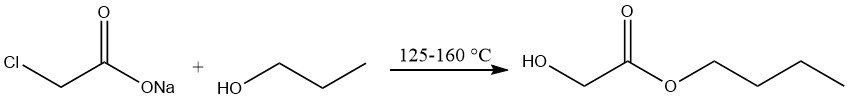
Utilizzi del n-butil glicolato
Il n-butil glicolato trova applicazione primaria come additivo nelle vernici, apprezzato per la sua bassa volatilità. Alcuni nomi commerciali del n-butil glicolato includono Polysolvan-O (Hoechst) e GB-Ester (Wacker).
Conferisce proprietà di distribuzione uniforme e elevata lucentezza alle vernici alla nitrocellulosa. Nel caso dell’acetilcellulosa, agisce efficacemente come inibitore del rossore in condizioni di elevata umidità.
Grazie alle sue favorevoli proprietà di miscelazione, il n-butil glicolato viene utilizzato anche come additivo nelle resine alchidiche e nelle vernici a base di olio.
Il n-butil glicolato è considerato non pericoloso.
Riferimenti
- Hydroxycarboxylic Acids, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_507
- Process for manufacture of glycolic acid. – https://patents.google.com/patent/US2152852A/en
- Glycolic Acid Production from Ethylene Glycol. – https://pubs.acs.org/doi/10.1021/acssuschemeng.1c03717
