Acido gallico: proprietà, reazioni, produzione e usi
Cos’è l’acido gallico?
L’acido gallico, noto anche come acido 3,4,5-triidrossibenzoico, è un acido idrossiaromatico con formula chimica C7H6O5. È un solido bianco, ma spesso assume una colorazione marrone a causa dell’ossidazione, ed è solubile in alcol e solventi polari. Fu scoperto da Carl Wilhelm Scheele nel 1786.
L’acido gallico si trova nelle foglie di uva ursina, nella corteccia della radice di melograno, nelle noci di galla, nell’amamelide, nel sommacco, nelle foglie di tè, nella corteccia di quercia e in molte altre piante, sia allo stato libero che come parte della molecola di tannino.
Sommario
1. Proprietà fisiche dell’acido gallico
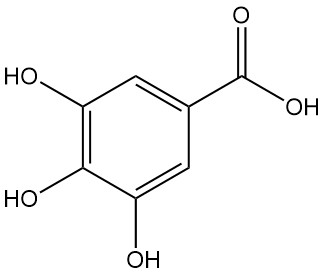
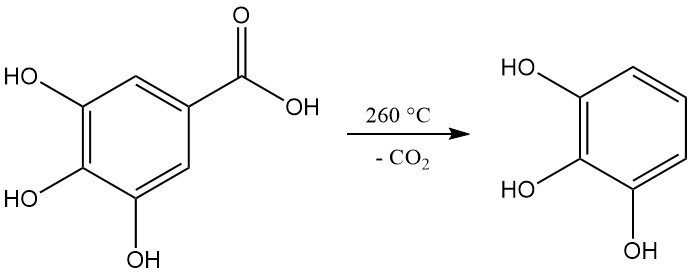
L’acido 3,4,5-triidrossibenzoico, comunemente noto come acido gallico, si presenta come una polvere cristallina di colore da bianco a giallo pallido. La cristallizzazione da soluzioni acquose produce una forma monoidrata a forma di aghi setosi, che si decompone in pirogallolo e anidride carbonica riscaldando a 258-263 °C.
L’acido gallico è solubile in acqua calda, etanolo, etere dietilico e acetone, mentre è insolubile in benzene e cloroformio.
Le proprietà fisiche dell’acido gallico sono elencate nella seguente tabella:
| Proprietà | Valore |
|---|---|
| Numero CAS | [149-91-7] |
| Formula chimica | C7H6O5 |
| Massa molecolare | 170,12 g/mol |
| Punto di fusione | 258–263 °C (decomposizione) |
| Sublimazione Temperatura | 210 °C |
| Densità a 25 °C | 1,694 g/cm3 |
| pKa1 a 30 °C | 2,33 |
| pKa2 | 8,85 |
2. Reazioni chimiche dell’acido gallico
La molecola di acido gallico contiene due gruppi funzionali: gruppi ossidrilici (fenolici) e un gruppo carbossilico. Poiché entrambi i gruppi funzionali presentano idrogeni acidi, possono reagire per formare numerosi esteri, eteri e sali, tra cui l’acido digallico (1).

Le soluzioni di acido gallico, in particolare quelle contenenti sali di metalli alcalini, sono sensibili all’ossidazione da parte dell’ossigeno atmosferico, con conseguente viraggio al marrone, come nel pirogallolo.
La decarbossilazione dell’acido gallico mediante riscaldamento a una temperatura superiore a 260 °C produce pirogallolo.
L’acido gallico è un potente agente riducente in grado di ridurre i sali d’oro o d’argento alle loro forme elementari.
La reazione dell’acido gallico con i sali di ferro (III) produce un complesso blu intenso, utilizzato nella formulazione di inchiostri. L’inchiostro di noce di galla, composto da acido gallico e solfato di ferro (II), subisce un’ossidazione nell’aria per generare il complesso blu ferro (III)-acido gallico.
Riscaldando l’acido gallico con acido solforico concentrato si produce esaidrossiantrachinone (2; acido rufigallico) per reazione di condensazione.

La reazione con il cloridrato di p-nitrosodimetilanilina forma derivati dell’ossazina.
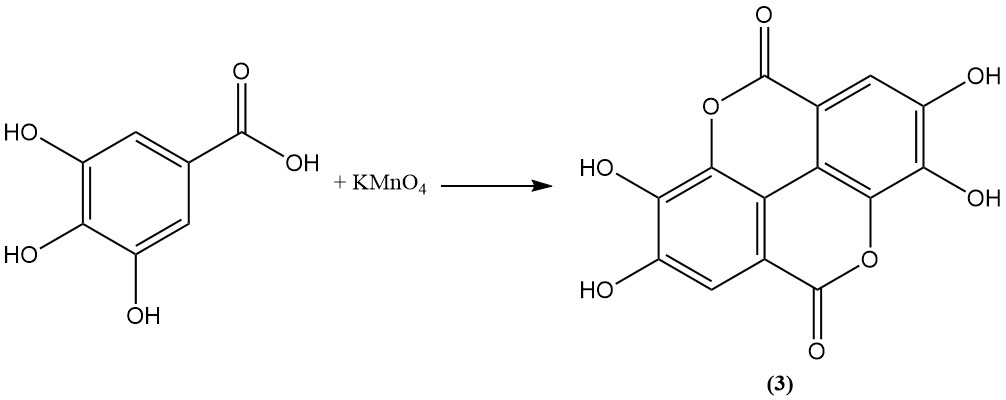
L’ossidazione dell’acido gallico con acido arsenico, permanganato, persolfato o iodio porta alla formazione di acido ellagico (3).
Il gruppo acido carbossilico dell’acido gallico può essere esterificato con alcoli mediante esterificazione azeotropica o con il metodo Fischer utilizzando alcol con acido cloridrico.

I derivati etere-estere dell’acido gallico possono essere preparati per alchilazione utilizzando dialchilsolfati o alogenuri alchilici in presenza di una base o utilizzando diazometano.
Il gruppo ossidrilico in posizione 4 è più reattivo rispetto agli altri. L’idrolisi parziale dell’acido 3,4,5-trimetossibenzoico con acidi forti produce acido 4-idrossi-3,5-dimetossibenzoico (4) (acido siringico).

3. Produzione di acido gallico
L’acido gallico è un costituente di numerosi agenti concianti ed è presente in forma libera o legato ai tannini in fonti naturali come divi-divi, corteccia di quercia, noci di galla, radici di melograno, sommacco e tè.
L’acido gallico viene prodotto da estratti acquosi di noci di galla ricchi di tannini mediante idrolisi acida con acido solforico a 110-120 °C o mediante trattamento alcalino.

Può anche essere preparato mediante scissione enzimatica del tannino da parte della tannasi o mediante fermentazione utilizzando muffe come Penicillium glaucum e Aspergillus niger.
I processi di fermentazione allo stato solido o in immersione, che utilizzano funghi filamentosi liberi o immobilizzati, come R. oryzae e Aspergillus foetidus, sono stati sviluppati per idrolizzare l’acido tannico da polvere di tara a basso costo o da altre materie prime ricche di tannini a basso costo.
L’acido gallico viene quindi estratto dalla soluzione di fermentazione mediante etere dietilico, con rese elevate di circa il 95%. Questo processo di biosintesi consuma meno energia rispetto all’idrolisi acida convenzionale.
4. Usi dell’acido gallico
L’acido gallico viene utilizzato nella produzione di inchiostro di noce di galla ferrosa e di vari coloranti, tra cui antragallolo, gallocianina, galloflavina e acido rufigallico.
Gli esteri di gallato, in particolare il gallato di metile (gallicina) e il gallato di propile, sono utilizzati come antiossidanti e conservanti alimentari per i grassi.
L’acido gallico è utilizzato come agente riducente in ambito farmaceutico (Dermatol, Airol e sale di bismuto dell’acido gallico) e come materia prima per la produzione dell’alcaloide allucinogeno mescalina e del trimetoprim (antibiotico ad ampio spettro).
L’acido gallico è utilizzato nella produzione di sviluppatori fotografici, così come il pirogallolo, impiegato nell’assorbimento dell’ossigeno e nella sintesi dei coloranti azoici.
Viene utilizzato anche nel processo di concia delle pelli per le sue proprietà astringenti e come antiossidante e conservante nei prodotti alimentari.
Molti studi stanno indagando i potenziali benefici per la salute dell’acido gallico come agente antiossidante, antimicrobico, antinfiammatorio e antitumorale.
5. Tossicologia dell’acido gallico
Studi sulla tossicità dell’acido gallico indicano una bassa tossicità acuta e subacuta. Tuttavia, il composto ha indotto effetti emorragici negli embrioni di pollo, sottolineando la necessità di limitazioni di dose.
I valori di DL50 riportati sono 320 mg/kg (topo, endovenoso), 5000 mg/kg (coniglio, orale) e 4300 mg/kg (topo, intraperitoneale). I valori di LDL0 sono 800 mg/kg (topo, intraperitoneale) e 5 mg/kg (topo, sottocutaneo, al 1° giorno di gravidanza).
L’esposizione umana all’acido gallico avviene principalmente per via professionale e alimentare.
È classificato come mutageno e teratogeno.
Riferimenti
- Hydroxycarboxylic Acids, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_519
- Organic and Fatty Acid Production, Microbial. – https://www.sciencedirect.com/science/article/abs/pii/B9780123739445001565
- Toxicity of natural products. – https://www.sciencedirect.com/science/article/abs/pii/B9780128243152011891
- https://pubchem.ncbi.nlm.nih.gov/compound/Gallic-Acid
