Acido fluorosolforico: proprietà, produzione e usi
Cos’è l’acido fluorosolforico?
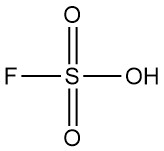
L’acido fluorosolforico è un composto inorganico con formula chimica HSO3F. È un liquido da incolore a giallo pallido con un odore pungente che esala facilmente in aria umida. È riconosciuto come uno degli acidi più forti disponibili in commercio.
Il legame fluoro-zolfo è più forte di quello dell’acido clorosolforico, quindi, di conseguenza, l’acido fluorosolforico viene idrolizzato più lentamente dell’acido clorosolforico. In condizioni ottimali, è possibile la sintesi di sali di acido fluorosolforico in soluzione acquosa.
L’acido fluorosolforico fu menzionato per la prima volta nel 1892, insieme a un metodo di sintesi che utilizza acido fluoridrico e anidride solforica, che rimane il processo di produzione preferito.
Storicamente, l’acido fluorosolforico è stato utilizzato nelle reazioni di fluorurazione e come catalizzatore nei processi di alchilazione e ciclizzazione. Processi industriali come la produzione di trifluoruro di boro e la polimerizzazione del tetraidrofurano utilizzano l’acido fluorosolforico. Inoltre, è stato impiegato nella lucidatura chimica del vetro al piombo fin dagli anni ’60.
L’acido fluorosolforico commerciale è composto per circa il 99,0% da HSO3F, con impurità minori tra cui acido solforico, anidride solforosa, anidride solforosa e ferro.
Ad oggi, sali e derivati dell’acido fluorosolforico hanno un’importanza industriale limitata.
Sommario
1. Proprietà fisiche dell’acido fluorosolforico
L’acido fluorosolforico è un liquido incolore, solubile in solventi organici polari (ad esempio, nitrobenzene, acido acetico e acetato di etile), ma scarsamente solubile in solventi apolari.
Le proprietà fisiche dell’acido fluorosolforico sono riassunte nella Tabella 1.
| Proprietà | Valore |
|---|---|
| Numero CAS | [7789-21-1] |
| Formula chimica | HSO3F |
| Peso molecolare | 100,07 g/mol |
| Punto di fusione | - 88,98 °C |
| Punto di ebollizione |
a 101,3 kPa: 162,7 °C a 16,0 kPa: 110 °C a 2,5 kPa: 77 °C |
| Densità |
a 18 °C: 1,740 g/cm³ a 25 °C: 1,725 g/cm³ |
| Pressione di vapore a 25 °C | 330 Pa |
| Viscosità a 25 °C | 1,56 mPa.s |
| Calore di formazione (liquido) | 792,45 kJ/mol |
2. Produzione di acido fluorosolforico
L’acido fluorosolforico viene prodotto industrialmente mescolando acido fluoridrico e anidride solforica in acido fluorosolforico come solvente per la reazione. L’acido fluorosolforico viene raffreddato per mantenere costante la temperatura nel reattore a < 100 °C, come mostrato in Figura 1.
HF + SO3 → HSO3F
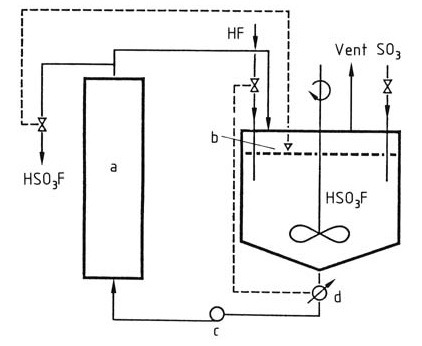
Figura 1: Produzione di acido fluorosolforico
a) Refrigeratore; b) Controllo di livello; c) Pompa; d) Conduttometro
In alternativa, l’acido fluorosolforico può essere sintetizzato facendo reagire il fluoruro di idrogeno di potassio o il fluoruro di calcio con oleum (acido solforico fumante) a temperature elevate (circa 250 °C).
Dopo la reazione, l’eventuale fluoruro di idrogeno rimanente viene rimosso mediante spurgo con gas inerte. L’acido fluorosolforico risultante può quindi essere purificato per distillazione in un apparecchio in vetro.
A causa della natura corrosiva dell’acido fluorosolforico, la sua produzione e manipolazione richiedono attrezzature specializzate e rigorosi protocolli di sicurezza.
3. Usi dell’acido fluorosolforico
3.1. Usi dell’acido fluorosolforico in chimica inorganica
L’acido fluorosolforico è utilizzato come agente fluorurante che mostra una reattività più moderata rispetto all’acido fluoridrico. Esempi di reazioni di fluorurazione includono la conversione del biossido di silicio in tetrafluoruro di silicio, dell’acido borico in trifluoruro di boro, del triossido di arsenico in trifluoruro di arsenico e del perclorato di potassio in percloril fluoruro. Quest’ultimo composto è impiegato come agente fluorurante nella sintesi organica.
3.2. Usi dell’acido fluorosolforico nella lucidatura del vetro
L’acido fluorosolforico viene utilizzato per ripristinare i bagni di lucidatura del vetro al piombo, che contengono il 60-70% di acido solforico, il 2-6% di acido fluoridrico e acqua. Il processo di lucidatura consuma questi acidi dissolvendo parzialmente la superficie del vetro, come mostrato nelle seguenti equazioni:
PbO + H2SO4 → PbSO4 + H2O
SiO2 + 6 HF → H2SiF6 + 2 H2O
Quando l’acido fluorosolforico viene aggiunto al bagno di lucidatura, questo viene idrolizzato per riprodurre questi acidi nel mezzo acido consumando parte dell’acqua formatasi.
HSO3F + H2O → H2SO4 + HF
Questo metodo riduce il consumo di acido fluoridrico di circa il 28% e riduce anche l’acido di scarto rispetto alle tecniche di rigenerazione tradizionali che utilizzano acido solforico e fluoridrico.
3.3. Usi dell’acido fluorosolforico in chimica organica
L’acido fluorosolforico catalizza reazioni di alchilazione, polimerizzazione e isomerizzazione nella sintesi organica. L’intermedio reattivo alchil fluorosolfato è responsabile dell’attività catalitica. Esempi di questa reazione includono:
- Alchilazione di olefine e isoparaffine
- Formazione di carburanti ad alto numero di ottano da idrocarburi a basso numero di ottano
- Produzione di aromatici alchilati e alchilazione del fenolo a tert-butilfenolo.
Inoltre, viene utilizzato nelle reazioni di polimerizzazione, come la polimerizzazione del tetraidrofurano, dell’etilene a idrocarburi insaturi a catena lunga e del triossano a poliossimetilene. Anche l’isomerizzazione di idrocarburi C7, pentene e metilpentene è catalizzata dall’acido fluorosolforico.
La produzione selettiva di beta-naftolo dal naftalene mediante idrossilazione catalitica con perossido di idrogeno si ottiene utilizzando una combinazione di acido fluorosolforico e pentafluoruro di antimonio come sistema catalitico.
3.4. Usi dell’acido fluorosolforico nella purificazione del fluoro
L’acido fluorosolforico offre un’alternativa al fluoruro di sodio per la rimozione dell’acido fluoridrico dal fluoro elementare. A differenza del fluoruro di sodio, che forma acido fluoridrico di sodio scarsamente solubile, il prodotto formato con l’acido fluorosolforico può essere rimosso per distillazione.
4. Rischi per la sicurezza e manipolazione dell’acido fluorosolforico
L’acido fluorosolforico presenta rischi significativi per la salute umana a causa della sua natura corrosiva e reattività. Il contatto con occhi, pelle o mucose può provocare gravi ustioni e danni ai tessuti. L’esposizione ai vapori può irritare le vie respiratorie. L’idrolisi dell’acido fluorosolforico in presenza di umidità genera acido fluoridrico e acido solforico, aggravandone gli effetti corrosivi.
L’acido fluoridrico ha proprietà tossicologiche uniche; penetra nella pelle e causa danni ai tessuti profondi. La sua capacità di chelare gli ioni calcio e magnesio interferisce con il metabolismo cellulare.
La rigorosa osservanza dei protocolli di sicurezza è fondamentale quando si maneggia l’acido fluorosolforico. È obbligatorio indossare dispositivi di protezione individuale, tra cui protezioni respiratorie, guanti resistenti alle sostanze chimiche, occhiali protettivi e tute integrali nei casi più gravi.
Le procedure di emergenza in caso di esposizione richiedono la decontaminazione immediata con acqua e una soluzione di gluconato di calcio, seguita da cure mediche. L’ingestione richiede la somministrazione di latte di magnesia o soluzione di gluconato di calcio.
L’acido fluorosolforico può infiammare materiali organici in determinate condizioni. Le fuoriuscite devono essere gestite con estrema cautela, utilizzando grandi quantità di acqua per la diluizione e prevenendo al contempo la formazione di nebbie corrosive.
Per piccole fuoriuscite si consiglia l’aggiunta di acido solforico concentrato a freddo, seguita da diluizione e neutralizzazione con calce.
Riferimento
- Fluorosulfuric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a11_431.pub2
Sono un chimico organico appassionato e continuo ad apprendere su vari processi di chimica industriale e prodotti chimici. Garantisco che tutte le informazioni su questo sito web siano accurate e meticolosamente referenziate ad articoli scientifici.
