Tricloroacetaldehído (cloral)
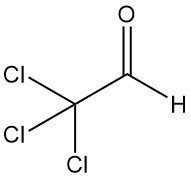
El tricloroacetaldehído [75-87-6], también conocido como cloral o 2,2,2-tricloroetanal (CCl3CHO), es un líquido incoloro con un peso molecular de 147,39 g/mol. Fue producido por primera vez en 1832 por Justus von Liebig mediante la cloración de etanol.
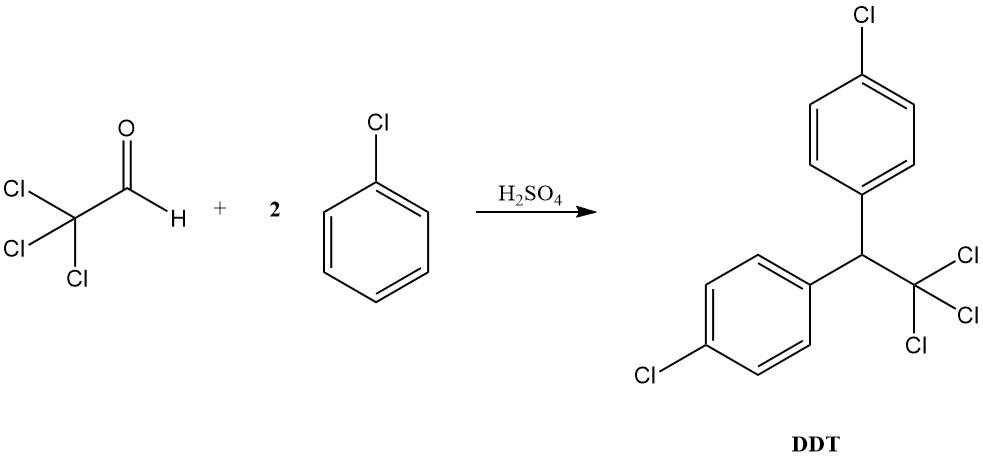
El cloral tiene importancia histórica como la primera droga hipnótica, introducida en 1869. Además, sirve como precursor del conocido insecticida DDT (1,1,1-tricloro-2,2-bis(4-clorofenil)etano), descubierto en 1941.
Si bien el cloral era una sustancia química valiosa en la década de 1960, su uso ha disminuido significativamente desde entonces debido a las restricciones al DDT y otros insecticidas clorados debido a preocupaciones ambientales.
Tabla de contenido
1. Propiedades físicas del tricloroacetaldehído
El cloral, también conocido como tricloroacetaldehído o tricloroetanal, presenta las siguientes propiedades físicas:
- Punto de fusión: -56,5 °C
- Punto de ebullición: 97,8 °C a 101,3 kPa
- Densidad: 1,5121 g/cm³ a 20 °C
- Índice de refracción: 1,4557 a 20 °C
- Presión de vapor: 4,7 kPa a 20 °C
- Apariencia: Líquido incoloro, móvil y aceitoso
- Olor: penetrante
- Solubilidad: Fácilmente soluble en agua, alcohol, éter y cloroformo
- Coeficiente de partición octanol-agua: 0,99 (bajo)
- Formación de azeótropos: forma azeótropos con 1,2-dicloroetano, heptano y benceno
2. Reacciones químicas del tricloroacetaldehído
El tricloroacetaldehído tiene propiedades químicas distintivas en comparación con los aldehídos típicos, principalmente debido a la fuerte influencia aceptora de electrones de sus tres átomos de cloro. Se descompone al exponerse a la luz solar o al calor.
El cloral reacciona fácilmente con los nucleófilos y forma varios productos de adición. Con alcoholes genera hemiacetales aislables (CCl3CH(OH)OR) y con agua forma el conocido hidrato de cloral [302-17-0] (CCl3CH(OH)2, pf 53 °C y pe 97,5 °C).
A diferencia de la mayoría de los aldehídos, el cloral no puede participar en muchas condensaciones catalizadas por bases. Las bases fuertes tienden a romper su enlace carbono-carbono, dando lugar a productos como cloroformo y HCO2Na, o HCONR2 (R = alquilo), según el reactivo específico.
CCl3CHO + NaOH → CHCl3 + HCO2Na
CCl3CHO + R2NH → CHCl3 + HCONR2 (R = alkyl)
En condiciones ácidas, el cloral se comporta más como un aldehído típico, formando acetales con alcoholes y condensándose con compuestos aromáticos para producir diariltricloroetanos, como lo ejemplifica la formación de DDT a partir de clorobenceno.
En presencia de iniciadores aniónicos como el terc-butóxido de litio, el cloral se polimeriza en un alto polímero insoluble y no inflamable de fórmula [CH(CCl3)O]n. Este polímero, sin embargo, no tiene aplicaciones comerciales conocidas.
La oxidación del tricloroacetaldehído produce ácido tricloroacético.
3. Producción de tricloroacetaldehído
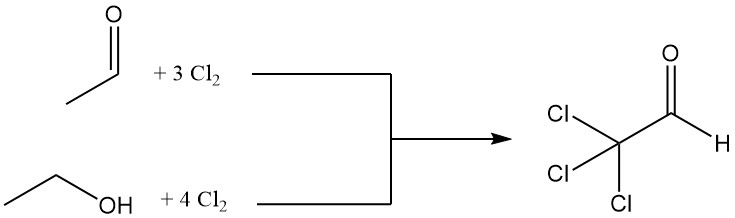
El cloral se produce mediante la cloración de acetaldehído o etanol; a menudo se prefiere el acetaldehído debido a sus ventajas económicas.
CH3CHO + 3 Cl2 → CCl3CHO + 3 HCl
El acetaldehído reacciona con el cloro en una solución de ácido clorhídrico para reducir los subproductos de la condensación y la oxidación del aldehído. Como catalizador se utiliza tricloruro de antimonio.
La temperatura aumenta gradualmente de 0 °C a 90 °C para mantener la velocidad de reacción.
El cloral se destila de la mezcla como hidrato, que luego se descompone con ácido sulfúrico concentrado para separarlo de la capa ácida más pesada. Luego se destila mediante una columna de fraccionamiento.
La cloración de un mol de etanol requiere cuatro moles de cloro, y un mol se utiliza para la oxidación a acetaldehído.
CH3CH2OH + Cl2 → CH3CHO + 2 HCl
Los recipientes de reacción y las tuberías están revestidos con materiales resistentes a los ácidos (cerámica, etc.) para resistir el ácido clorhídrico caliente. Las válvulas están hechas de aleaciones de níquel-molibdeno (Hastelloy B) para resistir la corrosión.
La pureza del cloral de grado técnico oscila entre el 94% y el 99%, siendo el agua la principal impureza.
4. Usos del tricloroacetaldehído
El cloral se utilizó inicialmente en la producción del insecticida DDT, pero sus usos van mucho más allá. Aunque el DDT está prohibido en muchos países, el cloral se ha utilizado en la producción de otros insecticidas, como metoxicloro y naled, y herbicidas (ácido tricloroacético).
También se utiliza en la producción de espuma rígida de poliuretano.
El tricloroacetaldehído puede inducir la hinchazón de los gránulos de almidón a temperatura ambiente, lo que podría afectar a varias industrias basadas en almidón.
El hidrato de cloral, la forma hidratada del cloral, se utilizaba en medicina como fármaco sedante e hipnótico (cloral betaína, α-cloralosa y triclofos sódico). Si bien se utiliza principalmente para el tratamiento del insomnio a corto plazo, también se ha utilizado para controlar la ansiedad, inducir la sedación antes de los procedimientos y tratar los síntomas de abstinencia del alcohol y otras drogas.
Su uso en niños ha disminuido en favor de alternativas más seguras, pero todavía encuentra aplicación en determinadas situaciones médicas.
En microscopía, la solución de Hoyer, que contiene hidrato de cloral, se utiliza para montar diversos organismos como briofitas, helechos, semillas y artrópodos para una observación detallada.
5. Toxicología del cloral
Síntomas de exposición:
- El cloral y su hidrato exhiben propiedades idénticas y actúan como depresores del sistema nervioso central.
- Las dosis terapéuticas (0,5 a 1,0 g) afectan mínimamente la respiración y la presión arterial, pero las dosis más altas deprimen ambas.
- Se producen efectos sinérgicos con el etanol, amplificando la acción del cloral.
- La irritación de la piel y las membranas mucosas es un efecto secundario conocido.
- El metabolismo convierte el cloral en tricloroetanol, el principal contribuyente a sus efectos fisiológicos.
- La excreción se produce predominantemente a través de la conjugación de glucurónido en la orina.
Toxicidad:
- La ingestión oral de 4 a 30 g ha demostrado ser letal en adultos.
- Los estudios de inhalación en ratas demuestran una alta toxicidad, con una CL50 de 440 mg/m³ para una exposición de 4 horas.
- La exposición crónica a concentraciones más bajas (75–78 mg/m³) induce lesiones pulmonares graves y mortalidad en ratas.
- Se observa mutagenicidad en la prueba de Ames.
- No existen valores límite umbral (TLV) ni concentraciones máximas permitidas (MAK) establecidas para el cloral, lo que exige un manejo cauteloso similar a cloroacetaldehído.
Carcinogenicidad:
- La Agencia Internacional para la Investigación del Cáncer (IARC) clasifica el cloral y el hidrato de cloral en el Grupo 3: «no clasificable en cuanto a su carcinogenicidad para los seres humanos».
- Aunque la evidencia limitada sugiere carcinogenicidad en estudios con animales, los datos en humanos siguen siendo inadecuados.
Clasificación UE:
- Según la Directiva 67/548/EEC, el cloral y el hidrato de cloral se designan como «tóxicos» (T) con frases de riesgo R25-36/38, lo que significa toxicidad ingestión e irritación de la piel/ojos.
Referencia
- Chloroacetaldehydes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
