Producción y usos del cloruro de amonio

El cloruro de amonio, NH4Cl, está presente de forma natural en el material volcánico, pero su extracción de fuentes naturales tiene una importancia mínima. La producción industrial de NH4Cl está estrechamente ligada al avance de la industria de las gaseosas y a la síntesis a gran escala de NH3 sintético.
Inicialmente destinado a ser utilizado como fertilizante, el cloruro de amonio encuentra actualmente aplicaciones en diversos campos. Sus procesos de producción son de particular interés para la ingeniería química debido a su importancia histórica como un ejemplo temprano de procesamiento químico que incluye las tres fases: sólida, líquida y gaseosa.
Tabla de contenido
1. Propiedades del cloruro de amonio
La masa molar del cloruro de amonio es 53,49 g/mol y es un sólido con una densidad específica de 1,530 a 20 °C. Su calor específico promedio, cp, entre 298 K y 372 K, se mide en 1,63 kJ/kg. El cloruro de amonio tiene dos formas cristalinas reversibles, y la transformación entre ellas se produce a 457,6 K (184,5 °C).
La forma estable a temperatura ambiente es la forma α, mientras que el β-NH4Cl (cúbico; tipo NaCl) se funde a 793,2 K a 3,45 MPa y se sublima a presión atmosférica. A temperaturas más bajas, el NH4Cl es relativamente volátil y se disocia en NH3 y HCl.
La solubilidad del NH4Cl en agua aumenta con el aumento de la temperatura. El calor integral de la solución hasta la saturación es +15,7 kJ/mol y el calor diferencial de la solución en la saturación es +15,2 kJ/mol.
La adición de amoníaco puede mejorar la solubilidad en agua, mientras que la presencia de NaCl tiende a precipitar el NH4Cl de las soluciones amoniacales. El NH4Cl también muestra propiedades higroscópicas débiles.
La humedad puede provocar el apelmazamiento del producto y no está claro si los contenidos de humedad inferiores al 0,1 % en peso son por sí solos responsables del apelmazamiento del cloruro de amonio. La sublimación podría ser otra posible explicación para este fenómeno.
El cloruro de amonio es muy soluble en NH3 líquido pero prácticamente insoluble en acetona y piridina. A 292,7 K, presenta una solubilidad del 3,24 % en peso en metanol y del 0,64 % en peso en etanol.
La forma cristalina obtenida a partir de soluciones acuosas de NH4Cl puede verse influenciada por otras sustancias, lo que se ha aprovechado para producir cristales grandes y ayuda a identificar impurezas durante la producción de NH4Cl.
2. Producción de cloruro de amonio
La producción comercial de cloruro de amonio implica dos procesos principales:
1. Proceso Solvay Modificado (Amoníaco – Proceso de Ceniza de Soda o ASAP): Este es uno de los métodos más utilizados para la producción comercial de NH4Cl. Implica la reacción entre el amoníaco y la carbonato de sodio (carbonato de sodio) para producir bicarbonato de amonio, que luego se convierte en cloruro de amonio mediante calentamiento.
2. Reacción directa entre HCl y NH3: En este proceso, el cloruro de amonio se forma directamente por la reacción entre el ácido clorhídrico (HCl) y el amoníaco (NH3).
Además, existe un tercer proceso conocido como reacción de pares recíprocos de sales, que aún es de interés desde una perspectiva científica, pero aún no se ha aplicado comercialmente para la producción de cloruro de amonio.
2.1. Proceso Solvay Modificado (Amoníaco – Ceniza de Sosa)
En el proceso Solvay, la producción de cloruro de amonio y carbonato de sodio se logra mediante una serie de reacciones. El amoníaco y el dióxido de carbono se disuelven en una solución acuosa de cloruro de sodio, lo que da como resultado la formación de bicarbonato de sodio poco soluble.
Luego, este bicarbonato de sodio se calienta (calcina) para producir carbonato de sodio. El amoníaco se recupera del líquido restante (licor madre) haciéndolo reaccionar con cal, que también genera cloruro de calcio.
Las principales fuentes de cal y dióxido de carbono son la piedra caliza. La reacción general implica la conversión de sal gema y piedra caliza en carbonato de sodio y cloruro de calcio como subproductos.
Para compensar las pérdidas de las plantas, sólo se añaden las cantidades necesarias de agua, dióxido de carbono y amoníaco. La elección de la materia prima y los productos resultantes determinan la ubicación de una planta Solvay, lo que convierte a estas plantas en unidades en gran medida independientes.
El proceso Solvay modificado, conocido como proceso de cloruro de amonio y carbonato de sodio, es un ejemplo temprano de producción industrial integrada que involucra dos sustancias. En este procedimiento modificado se precipita adicionalmente cloruro de amonio de las aguas madres. La reacción general de este proceso es:
2NH3 + CO2 + H2O + 2NaCl → 2NH4Cl + Na2CO3
Las cantidades de cloruro de amonio y carbonato de sodio producidas son casi iguales: se generan dos moles (107 g) de NH4Cl por cada mol (106 g) de Na2CO3. El proceso modificado requiere NH3 y CO2 externos y debe integrarse en un sistema de plantas interconectadas.
Además, el tratamiento de los gases residuales que contienen amoniaco se lleva a cabo con fines medioambientales, y no simplemente para reducir las pérdidas de NH3 y CO2. El balance energético en el proceso modificado difiere significativamente del del proceso Solvay tradicional debido a las distintas materias primas y productos involucrados.
2.1.1. Descripción del proceso
En el proceso de fabricación de NH4Cl y Na2CO3, se utiliza un proceso de reciclaje operado continuamente, con las concentraciones ajustadas en función de si el producto principal es cloruro de amonio o carbonato de sodio. Inicialmente desarrollado por BASF, este proceso se centra en NH4Cl como producto principal (Figura 1).
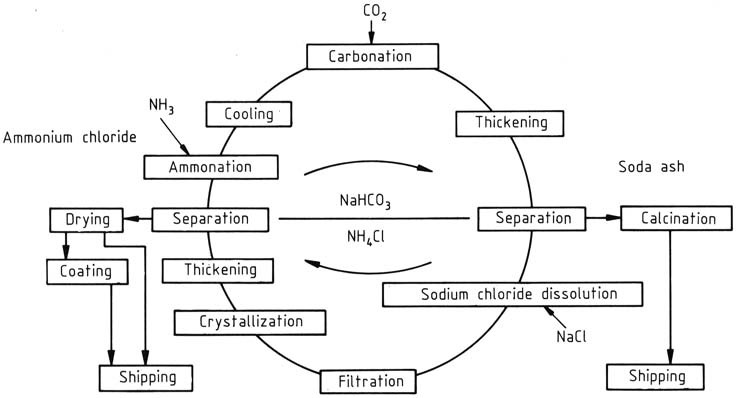
El ciclo comienza con la adición de amoníaco y dióxido de carbono a una solución acuosa de reciclaje. El bicarbonato de amonio formado reacciona aún más con el cloruro de sodio en la solución, lo que lleva a la generación de cloruro de amonio y bicarbonato de sodio escasamente soluble. Este último se separa y se lava mediante una centrífuga y posteriormente se calcina para producir carbonato de sodio.
Calentar el bicarbonato de sodio restante en las aguas madres a 337,2 K lo descompone. El carbonato de sodio altamente soluble no interfiere con la cristalización del cloruro de amonio.
La alta temperatura de la solución se utiliza para disolver rápidamente la materia prima de sal gema, introducida a través de tanques de mezcla, y la cantidad se ajusta en función del equilibrio de materia durante todo el ciclo.
Se filtran las impurezas insolubles, como sulfatos, sales de hierro, calcio y magnesio. La eliminación de residuos, una preocupación cada vez mayor, se aborda utilizando como materia prima sal más pura en lugar de sal gema.
El cloruro de amonio se recupera mediante cristalización en dos etapas mediante enfriamiento indirecto. La suspensión resultante del cristalizador se espesa en hidrociclones y el sólido se separa y se lava en una centrífuga.
El sólido con aproximadamente un 5 – 7 % en peso de contenido de agua se seca luego en una secadora actual para reducir el contenido de humedad a menos del 0,1 %. El producto final puede recibir un recubrimiento de agente antiaglomerante. Después de la eliminación del cloruro de amonio, el ciclo se completa y las aguas madre se pueden reutilizar.
Asahi Glass ha desarrollado un proceso alternativo que produce carbonato de sodio como producto principal. En este proceso, se añade amoniaco a las aguas madre antes de la cristalización del cloruro de amonio. Se puede añadir sal cruda triturada con o sin lavado y se disuelve en la solución.
Enfriar la solución por debajo de 20°C provoca la cristalización del cloruro de amonio. Los cristales se separan mediante un separador centrífugo y las aguas madre se reciclan a la sección de carbonatación. Los cristales de cloruro de amonio se secan para reducir el contenido de humedad a menos del 0,3% en un secador rotatorio o de lecho fluidizado. El tamaño de los cristales se puede controlar para diversas aplicaciones.
En la sección de carbonatación, la solución se pasa a una torre de carbonatación, donde precipita el bicarbonato de sodio mediante reacción con dióxido de carbono a 30 – 40°C.
La suspensión resultante se separa en cristales de bicarbonato de sodio y las aguas madre. Las aguas madre se dirigen a la sección de absorción de amoníaco. Los cristales separados se calcinan y se transforman en carbonato de sodio denso.
El proceso Asahi Glass incluye todos los pasos del proceso BASF que se muestran en la Figura 1 con una secuencia diferente. Se añade amoníaco después de la separación del bicarbonato de sodio. El calor liberado durante la adición de amoníaco proporciona la energía necesaria para descomponer el bicarbonato de sodio restante.
Si bien se observan ahorros de energía gracias a este enfoque, la mayor demanda de energía en la etapa de cristalización contrarresta algunos de los beneficios, ya que el cloruro de amonio es más soluble en soluciones ricas en amoníaco.
El proceso puede incluir una etapa de lavado para la alimentación de sal gema antes de la solución para eliminar la necesidad de filtración antes de la cristalización. Con o sin lavado, este proceso maximiza la utilización de la sal cruda, una consideración importante en Japón, donde se debe importar sal.
2.1.2. Problemas de contaminación
Los problemas de contaminación relacionados con el funcionamiento de las plantas no son graves y pueden gestionarse eficazmente mediante una operación cuidadosa. Con las medidas adecuadas, la producción de corrientes de aguas residuales puede reducirse significativamente, si no eliminarse por completo. Sin embargo, cualquier agua residual que se produzca debido a su alto contenido de amoníaco requerirá un tratamiento adecuado.
Para abordar las emisiones gaseosas, una solución práctica consiste en depurar los gases residuales con ácido clorhídrico, lo que da como resultado la producción de cloruro de amonio adicional.
Normalmente, se logran altas conversiones de amoníaco de alrededor del 98% y conversiones de sal gema de aproximadamente el 95%, aunque los valores exactos pueden variar según el tipo de proceso específico y las medidas medioambientales implementadas. Este enfoque ayuda a minimizar las emisiones gaseosas y contribuye a la sostenibilidad ambiental general del proceso de fabricación.
2.1.3. Grados y capacidad
En 1997, después del cierre de varias plantas de producción debido a la reducción de la demanda del mercado, la capacidad estimada de producción de NH4Cl mediante el proceso Solvay modificado en el hemisferio occidental y Japón era de alrededor de 100.000 toneladas por año.
En Asia, es común la producción de un producto granular con más del 97% de contenido de NH4Cl. Este NH4Cl de calidad fertilizante normalmente contiene más del 25 % en peso de nitrógeno amoniacal. Estas plantas se centran principalmente en la producción de carbonato de sodio, siendo el NH4Cl un subproducto.
Sin embargo, si el interés principal es la producción de NH4Cl, el proceso se puede adaptar para lograr purezas más altas. Se pueden alcanzar niveles de pureza superiores al 99,7 % en peso de NH4Cl, con menos del 0,25 % en peso de NaCl y menos de 3 ppm de Fe, lo que es adecuado para la mayoría de los fines industriales.
Para aplicaciones especiales que requieren NH4Cl de grado reactivo, la producción a gran escala es posible utilizando técnicas operativas específicas sin la necesidad de pasos de procesamiento adicionales.
Se puede obtener cloruro de amonio de grado reactivo con menos de 0,01 % en peso de NaCl y que cumpla con la especificación ACS (American Chemical Society). Este NH4Cl de mayor pureza es adecuado para aplicaciones que exigen una calidad y precisión excepcionales en los procesos químicos.
2.2. Reacción directa entre HCl y NH3
La síntesis de NH4Cl a partir de HCl y NH3 puede ser económicamente ventajosa, particularmente cuando el HCl está disponible como materia prima a bajo costo o sin costo alguno.
El proceso Engeclor, desarrollado por la empresa brasileña Engeclor, realiza la reacción en una solución acuosa. Se introduce amoníaco en la sección cónica de un saturador, mientras que se pasa HCl, diluido con aire, a la suspensión de NH4Cl.
La reacción se realiza a 353 K a presión reducida, con un exceso de NH3 para mantener un pH de 8. La suspensión resultante se retira de la base del saturador, se espesa mediante hidrociclones y se separa el NH4Cl de la mezcla en una centrífuga y luego secado.
El licor madre se recicla de nuevo al saturador. Para controlar las emisiones, los gases residuales del saturador se lavan con agua.
Se han propuesto esquemas alternativos en los que se introducen materias primas gaseosas en disolventes no acuosos. En estos casos, el calor de reacción (-176 kJ/mol) se elimina evaporando los disolventes, que luego se condensan.
Para este fin también se han descrito algunos procesos de lecho fluidizado. Para evitar la formación de aerosoles, se sugiere el dióxido de carbono como gas portador en lechos fluidizados.
La producción anual mundial estimada de NH4Cl mediante el proceso HCl-NH3 fue de 50.000 toneladas en 1997. El NH4Cl producido mediante este método contiene menos del 0,1 % en peso de NaCl.
El contenido de metales, especialmente el contenido de metales pesados, puede variar según la planta específica. Generalmente, los niveles de metal en NH4Cl producidos por este proceso son más altos que los del proceso Solvay modificado.
2.3. Reacción de pares recíprocos de sales
La reacción de pares recíprocos de sales sigue siendo un método de interés. Algunos pares de sales adecuados incluyen (NH4)2SO4 – KCl, que da como resultado la formación de NH4Cl – K2SO4 y (NH4)2SO4 – NaCl, que conduce a la producción de NH4Cl – Na2SO4.
El desafío con estos pares de sales es la menor pureza del NH4Cl debido al contenido relativamente alto de sulfato. NH4Cl y KNO3 se pueden obtener mediante la reacción de NH4NO3 y KCl. El KNO3 de alta pureza se puede utilizar en la producción de explosivos, mientras que el NH4Cl con una pureza mínima del 96% es adecuado como fertilizante.
Además, la preparación de NaNO3 y NH4Cl a partir de NaCl y NH4NO3 ha sido objeto de investigación. Este proceso explora la posibilidad de obtener estas dos sales a partir de sus respectivas sales precursoras.
3. Usos del cloruro de amonio
El cloruro de amonio encuentra amplias aplicaciones agrícolas e industriales:
3.1. Uso agrícola
En Japón, China y el sudeste asiático, el cloruro de amonio se utiliza ampliamente como fertilizante nitrogenado muy eficaz para el arroz con cáscara y de secano, el trigo y otros cultivos.
En Japón, una parte importante de la producción anual de NH4Cl se utiliza para fertilizantes compuestos de alta calidad, como fosfato de cloroamonio, fosfato de cloropotasa y amonio, fosfato de magnesia, cloropotasa y amonio y mezclas de nitrógeno y potasa. Sin embargo, su uso como fertilizante es limitado debido a su acidez y alto contenido en cloro.
3.2. Uso industrial
El cloruro de amonio de calidad técnica se emplea en diversas aplicaciones industriales:
- Electrolitos sólidos: sirve como componente vital en las baterías de celda seca.
- Explosivos para canteras: una forma fina de cloruro de amonio se utiliza como componente de explosivos para canteras.
- Endurecedores para Adhesivos: Actúa como agente endurecedor en adhesivos a base de formaldehído.
- Soluciones de grabado: el cloruro de amonio, junto con otros productos químicos, se utiliza en la producción de placas de circuito impreso.
- Fundentes en enchapado: Es un componente, junto con el cloruro de zinc, de los fundentes utilizados para estañado y cincado.
- Fotografía: Sirve como aditivo fijador rápido en fotografía.
- Aditivos de limpieza: el cloruro de amonio se utiliza como aditivo en productos de limpieza.
- Nutriente en cultivos de levadura: se utiliza como nutriente en cultivos de levadura para diversas aplicaciones.
- Curtido: En la industria del curtido, el cloruro de amonio encuentra aplicaciones.
- Refinación de Metales Preciosos: Se utiliza en el proceso de refinación de metales preciosos.
- Impresión y teñido de textiles: El cloruro de amonio se utiliza en la impresión y teñido de textiles.
- Industria del Caucho: Encuentra aplicaciones en la industria del caucho.
- Tejas y ladrillos: Se puede agregar cloruro de amonio a las tejas y ladrillos antes de cocerlos para controlar la porosidad y acelerar el proceso de cocción.
3.3. Aplicaciones de alta pureza
El cloruro de amonio de alta pureza se emplea en la industria alimentaria y farmacéutica, así como en síntesis químicas específicas.
Cabe señalar que el uso de NH4Cl como endurecedor de adhesivos a base de formaldehído ha disminuido significativamente debido a su sustitución por productos libres de cloruro.
Referencias
- Ammonium Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_243
Process of making ammonium chloride. – https://patents.google.com/patent/US2133513A/en
Preguntas más frecuentes
El cloruro de amonio (NH4Cl) es un compuesto químico compuesto de amoníaco (NH3) y ácido clorhídrico (HCl). Existe como un sólido cristalino blanco con un característico sabor salado y se conoce comúnmente como sal amoniacal.
NH4Cl es un ácido. Se forma por la reacción de un ácido fuerte, concretamente el ácido clorhídrico (HCl), con una base débil, concretamente el hidróxido de amonio (NH4OH).
El cloruro de amonio tiene diversas aplicaciones:
– Sirve como fertilizante nitrogenado eficaz para diversos cultivos, incluidos arroz, trigo y más.
– En el sector industrial se utiliza en baterías de celda seca, explosivos, adhesivos, fabricación de placas de circuito impreso y procesos de enchapado.
– Se utiliza en fotografía, aditivos de limpieza, cultivos de levadura, curtido, refinación de metales preciosos, impresión textil y en la industria del caucho.
– El cloruro de amonio de alta pureza se utiliza en alimentos, productos farmacéuticos y síntesis químicas específicas.
El cloruro de amonio se puede producir mediante varios métodos, uno de los cuales implica hacer reaccionar gas amoníaco (NH3) con ácido clorhídrico (HCl) en una solución acuosa. A continuación, el cloruro de amonio resultante se separa y se seca para su uso.
El cloruro de amonio debe eliminarse de acuerdo con las normas y directrices locales para la eliminación de residuos químicos. Es fundamental seguir los procedimientos adecuados para evitar la contaminación ambiental.
Cuando se calienta, el cloruro de amonio sufre sublimación, lo que significa que pasa directamente de sólido a gas sin fundirse. Se descompone en gases de amoníaco (NH3) y cloruro de hidrógeno (HCl).
El cloruro de amonio aparece como un sólido o polvo cristalino blanco con textura granular. Es inodoro y tiene un sabor salado distintivo.
