Ácido clorhídrico: Propiedades, Producción y Usos
El ácido clorhídrico, conocido por su nombre alternativo de ácido muriático, es una solución a base de agua compuesta de cloruro de hidrógeno (HCl).
Historia del descubrimiento
Durante el siglo XV, un alquimista alemán llamado VALENTIN aplicó calor a una sustancia llamada vitriolo verde (FeSO4·7 H2O) junto con sal común. Como resultado, obtuvo una sustancia conocida como espíritu de sal.
En el siglo XVII, GLAUBER sintetizó ácido clorhídrico combinando sal común con ácido sulfúrico. Fue en 1790 cuando DAVY estableció la composición del cloruro de hidrógeno mediante la síntesis de hidrógeno y cloro.
Ese mismo año, LEBLANC descubrió un proceso que lleva su nombre para la producción de refrescos. Este proceso implicó hacer reaccionar sal común con ácido sulfúrico, lo que resultó en la liberación de cloruro de hidrógeno. Inicialmente considerado un subproducto no deseado, se liberó a la atmósfera en cantidades significativas.
Sin embargo, en 1863, la Ley de Álcalis obligó a los productores ingleses de refrescos a disolver el cloruro de hidrógeno en agua, lo que llevó al uso industrial generalizado del ácido producido. Cualquier exceso de cloruro de hidrógeno que no pudiera utilizarse como ácido clorhídrico se oxidaba a cloro.
La síntesis industrial de cloruro de hidrógeno surgió junto con el desarrollo del proceso electrolítico cloro-álcali a principios del siglo XX. Este método, además del basado en la reacción entre cloruros y ácido sulfúrico o hidrogenosulfato de sodio, produjo un producto más puro.
Estos procesos están perdiendo importancia gradualmente debido a las cantidades sustanciales de cloruro de hidrógeno generado como subproducto en procesos de cloración como la producción de cloruro de vinilo a partir de etileno.
Además, el ácido clorhídrico se puede recuperar de los gases producidos durante la incineración de residuos que contienen cloro, lo que concuerda con el creciente interés en la protección del medio ambiente.
Tabla de contenido
1. Propiedades físicas del ácido clorhídrico
El cloruro de hidrógeno (HCl) existe en condiciones normales como un gas transparente que se caracteriza por su fuerte olor y su efecto altamente corrosivo sobre las membranas mucosas del sistema respiratorio.
Algunas propiedades físicas del cloruro de hidrógeno se presentan en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Masa molar | 36,461 g/mol |
| Punto de fusión (pf) | -114,22 °C |
| Punto de ebullición (pb) | -85,05 °C |
| Densidad de vapor | 1,639 g/L |
| Densidad del líquido | 1,18 g/mL |
| Temperatura crítica | 51 °C |
| Presión crítica | 81,6 bares |
2. Propiedades químicas del ácido clorhídrico
El cloruro de hidrógeno exhibe estabilidad térmica hasta aproximadamente 1500 °C, más allá del cual sufre una disociación significativa. En su forma completamente seca, el cloruro de hidrógeno demuestra una reactividad limitada y un ataque insignificante al acero dulce.
Además, las reacciones que implican cloruro de hidrógeno anhidro normalmente necesitan la presencia de catalizadores. Por el contrario, cuando el cloruro de hidrógeno se disuelve en un disolvente polar, como el agua, se transforma en un ácido potente y, en consecuencia, se convierte en un reactivo altamente reactivo.
La solubilidad del cloruro de hidrógeno en agua es sustancial y va acompañada de la liberación de una cantidad significativa de calor. Esto da como resultado la formación de ácido clorhídrico, que posee una naturaleza formidable y extremadamente agresiva.
Muestra la capacidad de corroer la mayoría de los metales y aleaciones disponibles comercialmente en diversos grados. En consecuencia, los metales necesitan protección mediante el uso de revestimientos no metálicos adecuados o materiales de construcción no metálicos.
En condiciones exactamente definidas se puede utilizar tantalio o aleaciones de níquel altamente resistentes como Hastelloy B. Sin embargo, los metales menos nobles se disuelven, lo que provoca la liberación de gas hidrógeno.
3. Producción de ácido clorhídrico
La presencia de cloruro de hidrógeno libre en la naturaleza es limitada y se presenta sólo en bajas concentraciones. Se ha detectado en la estratosfera en niveles de aproximadamente 10-11 por ciento en volumen.
Por otro lado, los cloruros inorgánicos tienen una amplia distribución, situándose el cloro como el undécimo elemento químico más abundante. Los cloruros de metales alcalinos y alcalinotérreos, en particular la sal gema, sirven como materia prima principal para diversos métodos de producción de cloruro de hidrógeno o ácido clorhídrico.
Estos métodos incluyen procesos que involucran sustancias intermedias como cloro o compuestos orgánicos clorados.
En fenómenos naturales, el cloruro de hidrógeno se libera durante erupciones volcánicas u otras liberaciones de gases subterráneos. La cantidad de cloruro de hidrógeno producida puede ser comparable a la de dióxido de azufre.
El ácido clorhídrico está presente de forma natural en el jugo gástrico de los mamíferos, con una concentración de aproximadamente 0,1 mol/L en el estómago humano.
3.1. Métodos de preparación de ácido clorhídrico.
El cloruro de hidrógeno se puede generar mediante varias reacciones:
1. Síntesis a partir de elementos:
La combinación de gas hidrógeno (H2) y gas cloro (Cl2) conduce a la formación de gas cloruro de hidrógeno (HCl):
H2 + Cl2 → 2 HCl
2. Reacción de cloruros metálicos con ácido sulfúrico:
Los cloruros metálicos, especialmente el cloruro de sodio, pueden reaccionar con ácido sulfúrico (H2SO4) o sulfato de hidrógeno para producir cloruro de hidrógeno:
Cloruro metálico + H2SO4 → HCl + Sulfato metálico
3. Subproducto de la cloración:
Durante la producción de diversos compuestos orgánicos clorados como diclorometano, tricloroetileno, percloroetileno o cloruro de vinilo, se forma cloruro de hidrógeno como subproducto mediante una serie de reacciones:
C2H4 + Cl2 → C2H4Cl2
C2H4Cl2 → C2H3Cl + HCl
4. Descomposición térmica de cloruros de metales pesados hidratados:
El cloruro de hidrógeno puede derivarse de la descomposición térmica de cloruros de metales pesados hidratados presentes en el licor de decapado usado para el tratamiento de metales.
5. Incineración de residuos orgánicos clorados:
Cuando se incineran residuos orgánicos clorados, se produce cloruro de hidrógeno como resultado:
C4H6Cl2 + 5 O2 → 4 CO2 + 2 H2O + 2 HCl
La principal fuente de cloruro de hidrógeno hoy en día es el subproducto obtenido de los procesos de cloración. El nivel de purificación requerido depende de la aplicación prevista. Actualmente, la recuperación de cloruro de hidrógeno a partir de materiales de desecho está aumentando.
Además, el cloruro de hidrógeno se puede formar en reacciones no deseadas como la hidrólisis de los catalizadores de Friedel-Crafts:
AlCl3 + 3 H2O → Al(OH)3 + 3 HCl
3.2. Producción industrial de ácido clorhídrico
3.2.1. De hidrógeno y cloro
El método más sencillo para producir cloruro de hidrógeno implica la síntesis directa a partir de sus componentes elementales, lo que da como resultado un producto de gran pureza. Esta reacción es altamente exotérmica, con una entalpía de reacción estándar (ΔH) de -184 kJ.
Es importante señalar que las mezclas de hidrógeno y cloro pueden ser extremadamente explosivas en una amplia gama de composiciones. La luz puede servir como iniciador de una explosión. Por tanto, se deben tomar precauciones para evitar la formación de mezclas reactivas de cloro e hidrógeno en los procesos industriales.
En la producción industrial se utiliza un quemador, en el que el cloro y el hidrógeno se introducen por separado a través de tubos concéntricos en la cámara de combustión. Una vez encendido, el cloro arde en presencia de hidrógeno, generando una llama caliente y silenciosa a temperaturas superiores a 2000 °C.
La sílice ha demostrado eficacia como material de construcción adecuado para el quemador. También se ha utilizado hierro fundido o acero, a veces refrigerado por agua, o grafito.
Normalmente, el quemador se coloca en el fondo de una cámara de combustión cilíndrica, con la llama dirigida verticalmente hacia arriba. La propia cámara de combustión está hecha de acero y revestida con ladrillo refractario. Una sección de refrigeración, de tamaño y forma adecuados, está conectada a la cámara de combustión.
Si los reactivos están muy húmedos o contaminados, se deben utilizar materiales de construcción resistentes a la corrosión, como sílice o grafito.
Las plantas de fabricación existentes se construyen predominantemente con acero al carbono y el cloruro de hidrógeno producido se enfría con agua sólo hasta una temperatura en la que el ácido clorhídrico acuoso no puede condensarse.
Los principales contaminantes son la humedad del hidrógeno y el oxígeno del cloro, aunque los compuestos de oxígeno como el óxido de dicloro (Cl2O) o el dióxido de carbono también pueden plantear problemas al formar agua.
La proporción de mezcla de las materias primas se ajusta en función del uso previsto del cloruro de hidrógeno producido. Se puede emplear un ligero exceso de hidrógeno o cloro.
No se recomienda trabajar con mezclas precisamente equimolares, ya que la reacción no es completamente cuantitativa y resulta más difícil prevenir mezclas explosivas.
Las desviaciones en el control pueden provocar cambios intermitentes entre el exceso de hidrógeno y el exceso de cloro, lo que resulta en la aparición ocasional de mezclas explosivas.
Por lo general, el hidrógeno en el cloruro de hidrógeno presenta menos desafíos que el cloro, por lo que comúnmente se usa un ligero exceso de 1-2 % de hidrógeno. Dependiendo de la pureza de las materias primas, es posible obtener cloruro de hidrógeno completamente libre de cloro, siendo el exceso de hidrógeno la única impureza.
Este cloruro de hidrógeno de alta pureza se puede utilizar para producir ácido clorhídrico excepcionalmente puro o se puede licuar o suministrar directamente a los usuarios como gas seco a través de tuberías de acero.
Usar acero para hornos y refrigeradores de síntesis es una opción atractiva. Esto permite el funcionamiento a presión elevada, que está determinada por la presión del cloro y el hidrógeno, así como por la temperatura y la presión en la tubería.
Es crucial mantener una presión lo suficientemente baja o una temperatura lo suficientemente alta para evitar la condensación del ácido clorhídrico acuoso. Los hornos de acero que funcionan en H€uls, por ejemplo, pueden producir cada uno de 30 a 40 toneladas diarias de cloruro de hidrógeno.
El gas cloruro de hidrógeno generado tiene una presión de hasta 0,7 MPa y un contenido de agua inferior a 50 ppm (en volumen), lo que requiere el uso de tuberías de acero para su transporte desde la planta.
Los procesos químicamente relacionados incluyen la reacción del cloro con carbono (en forma de coque) y vapor de agua:
C + 2 H2O + 2 Cl2 → 4 HCl + CO2
Otro proceso relacionado implica la reacción del cloro con dióxido de azufre y agua:
SO2 + 2 H2O + Cl2 → 2 HCl + H2SO4
3.2.2. Reacción de cloruros metálicos con ácido sulfúrico
El proceso de sulfato se caracteriza por un alto consumo de energía. En consecuencia, su importancia ha ido disminuyendo paulatinamente en comparación con otros procesos, en particular la cloración orgánica, que genera importantes cantidades de cloruro de hidrógeno como subproducto.
Además, el argumento de que el ácido clorhídrico sulfato produce un producto de mayor pureza ya no es válido. El ácido subproducto ahora se puede purificar adecuadamente para cumplir con los requisitos de estándares de alta calidad. Por lo tanto, aquí sólo se analizará el proceso más importante de sulfato-ácido clorhídrico.
La reacción entre la sal común y el ácido sulfúrico concentrado se produce a temperaturas relativamente bajas (150-300 °C), lo que da como resultado la formación de cloruro de hidrógeno e hidrogenosulfato de sodio.
Este último reacciona con el exceso de cloruro de sodio a una temperatura mínima de 550-600 °C, produciendo sulfato de sodio neutro. Aunque el uso de hidrogenosulfato de sodio como material de partida es técnicamente factible, se ha descontinuado debido a la naturaleza antieconómica del proceso causada por las altas temperaturas (600-800 °C) y el consumo de energía involucrado.
Actualmente, el ácido sulfúrico es el material de partida exclusivo. En el proceso de Mannheim se produce sulfato de sodio, mientras que en el proceso de ácido clorhídrico de Berlín se utiliza hidrogenosulfato de sodio.
En el proceso de Mannheim se utilizan hornos de mufla revestidos con ladrillos y encendidos desde el exterior. Estos hornos incluyen un mecanismo de agitación con acción raspadora para evitar la formación de grumos en la masa pastosa y eliminar el sulfato de sodio producido.
El cloruro de hidrógeno se descarga a través del costado de la mufla y se impulsa mediante un ventilador a la etapa siguiente, manteniéndose el horno a una presión ligeramente reducida.
La mezcla de gases de escape del horno contiene hasta un 85% de cloruro de hidrógeno, además de aire, niebla de ácido sulfúrico y finas partículas de sal. Normalmente, el gas pasa por múltiples etapas de purificación, incluida la filtración a través de coque y carbón activado, depuración húmeda o reacciones químicas.
El proceso de ácido clorhídrico de Berlín produce gas cloruro de hidrógeno de una pureza significativamente mayor que el proceso de Mannheim. La reacción entre la sal común y el ácido sulfúrico se produce en hidrogenosulfato de sodio fundido a unos 300 °C dentro de retortas de hierro fundido.
Alternativamente, se puede utilizar cloruro de potasio, lo que da como resultado la producción de cloruro de hidrógeno e hidrogenosulfato de potasio. Este proceso conserva cierta importancia comercial debido a que los productos primarios son las sales de potasio formadas (es decir, KHSO4 y K2S2O7), y el cloruro de hidrógeno se considera un subproducto.
El gas de las retortas está más concentrado debido a la naturaleza mejorada a prueba de fugas del equipo, lo que resulta en niveles más bajos de niebla de ácido sulfúrico como consecuencia de la temperatura de trabajo reducida.
3.2.3. Recuperación como subproducto de la cloración
La fuente principal de cloruro de hidrógeno y ácido clorhídrico es el subproducto de los procesos de cloración. El craqueo de 1,2-dicloroetano para producir cloruro de vinilo se destaca como el principal contribuyente a la producción de cloruro de hidrógeno.
Las cantidades de cloruro de hidrógeno generadas y consumidas pueden ser significativas, y muchas instalaciones producen alrededor de 10.000 m3/h (16 t/h o 140.000 t/a) o más.
En consecuencia, el cloruro de hidrógeno suele suministrarse directamente a plantas químicas que lo utilizan como materia prima. Las capacidades de almacenamiento de cloruro de hidrógeno suelen ser relativamente pequeñas. Por lo tanto, es crucial mantener una tasa equilibrada de producción y consumo.
En caso de problemas de producción o fluctuaciones del mercado que afecten a una planta o producto, la otra planta puede continuar operando solo si existe capacidad de producción de reserva (que generalmente no se utiliza en su totalidad).
El almacenamiento intermedio de cloruro de hidrógeno líquido se emplea para abordar los desequilibrios a corto plazo entre la producción y el consumo.
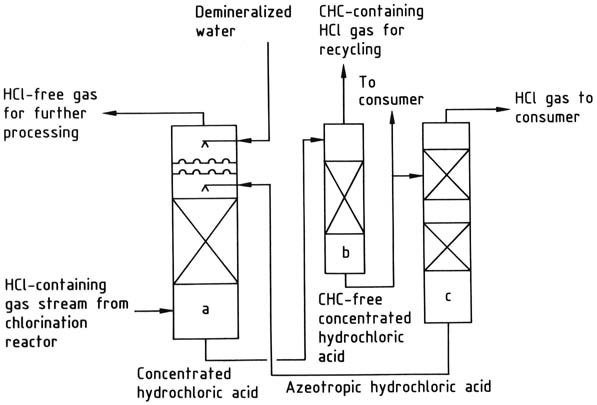
a) Columna de absorción de cloruro de hidrógeno; b) Columna de extracción de hidrocarburos clorados; c) Columna de desorción de cloruro de hidrógeno
El cloruro de hidrógeno producido mediante cloración orgánica puede someterse a varios métodos de tratamiento:
1. Condensación simple de hidrocarburos clorados: este enfoque se utiliza cuando la presencia de hidrocarburos clorados residuales u otros subproductos del proceso de cloración no plantea ningún problema para el cloruro de hidrógeno, que se suministra en forma de gas.
El nivel de purificación alcanzado depende de la presión y temperatura de condensación. Por ejemplo, en la cloración de clorometano a diclorometano, el cloruro de hidrógeno resultante se usa únicamente para convertir metanol en clorometano, que posteriormente se utiliza para producir diclorometano.
2. Aislamiento y purificación de cloruro de hidrógeno por destilación: La destilación fraccionada del gas licuado se puede emplear cuando se requiere un producto más puro. Por ejemplo, los productos gaseosos derivados del craqueo de 1,2-dicloroetano se licuan y luego se separan mediante destilación en cloruro de vinilo y cloruro de hidrógeno.
La licuefacción de estos gases a temperaturas extremadamente bajas no es económicamente práctica, por lo que la condensación y la destilación se llevan a cabo a presión elevada. Una ventaja de este método es que se produce gas cloruro de hidrógeno a una presión suficientemente alta (típicamente 1-2 MPa) para el procesamiento posterior, eliminando la necesidad de compresión mecánica adicional.
3. Absorción acuosa de cloruro de hidrógeno: este método da como resultado la producción de ácido clorhídrico como producto intermedio, pero presenta desafíos relacionados con los materiales de construcción.
Sin embargo, la introducción de fluoropolímeros ha mitigado estos problemas en gran medida. Sin embargo, muchas instalaciones han sustituido el tratamiento acuoso por métodos no acuosos, como la destilación fraccionada.
El cloruro de hidrógeno se puede absorber usando agua o una solución de ácido clorhídrico al 20 % en peso. El agua es adecuada cuando el objetivo principal es producir entre un 30 y un 35 % en peso de ácido clorhídrico como producto final.
Si la demanda de dicho ácido es insuficiente, se utiliza el azeótropo al 20% para la absorción de cloruro de hidrógeno, concentrando así el ácido a una concentración del 30-35% en peso.
El ácido clorhídrico concentrado se purifica si es necesario y luego se destila para producir cloruro de hidrógeno gaseoso y ácido clorhídrico azeotrópico. El cloruro de hidrógeno se seca y se entrega al consumidor, mientras que el azeótropo se recicla de nuevo a la etapa de absorción.
Si la presencia de hidrocarburos clorados en el ácido clorhídrico no es deseable, se puede implementar un paso de extracción para eliminarlos.
Para eliminar el cloruro de hidrógeno de una corriente gaseosa, se introduce una pequeña cantidad de agua en la columna de absorción. Esta adición de agua asegura que la corriente de gas quede libre de cloruro de hidrógeno. Sin embargo, para otros fines debe separarse una cantidad correspondiente de ácido.
Varios parámetros de procesos y equipos son cruciales para evaluar la economía de la absorción acuosa de cloruro de hidrógeno de una corriente de gas de producción:
- La concentración de cloruro de hidrógeno en la corriente de gas determina la presión y la temperatura mantenidas en la columna de absorción.
- La energía necesaria para liberar gas cloruro de hidrógeno puro disminuye a medida que aumenta la concentración del ácido concentrado formado.
- La producción de ácido clorhídrico concentrado a partir de una corriente de gas con una baja concentración de cloruro de hidrógeno requiere un esfuerzo considerable. Esto puede implicar aumentar la presión, reducir la temperatura o ambas cosas.
- La presencia de una alta concentración de vapor de agua en la corriente de gas de producción puede imposibilitar la producción de ácido clorhídrico concentrado en determinadas circunstancias.
Un método propuesto para absorber niveles bajos de cloruro de hidrógeno de un gas que contiene altos niveles de vapor de agua es utilizar una solución de cloruro de magnesio.
La elección de materiales de construcción para los equipos de absorción de cloruro de hidrógeno es limitada debido al posible ataque tanto del ácido clorhídrico concentrado como de los hidrocarburos clorados. Para enfriar el ácido se utilizan intercambiadores de calor de grafito.
Para las bombas, un material cerámico especial ha sido tradicionalmente la opción económicamente viable. La columna de destilación está revestida con ladrillos resistentes al ácido o bloques de grafito, y los ladrillos se cementan con resina fenólica.
A menudo se aplica un revestimiento de caucho resistente a los ácidos entre la carcasa de acero y la pared de ladrillo para evitar el ataque del ácido a través de poros y grietas.
Los equipos hechos completamente de resina fenólica exhiben una excelente resistencia química, pero son frágiles y mecánicamente frágiles, y generalmente requieren soporte, como una capa exterior de resina de poliéster reforzada con fibra de vidrio. Este tipo de equipo es adecuado para funcionar a presión atmosférica o ligeramente superior.
Se aplican consideraciones similares a la columna de extracción de hidrocarburos clorados. Si la concentración de hidrocarburos clorados es baja o se han eliminado eficazmente del ácido, se pueden utilizar otros materiales como el poli(cloruro de vinilo) para los recipientes de almacenamiento.
Sin embargo, la columna de desorción está hecha de grafito debido a la alta temperatura de funcionamiento. Alternativamente, se pueden emplear columnas revestidas de caucho con revestimiento interior de ladrillo.
Las columnas de acero revestidas con perfluoropolímero, especialmente politetrafluoroetileno (PTFE), han mostrado excelentes resultados, aunque pueden existir variaciones de productos entre diferentes fabricantes en cuanto a microporosidad, resistencia al desgarro y propiedades de flujo.
Las columnas de acero revestidas ofrecen ventajas sobre las columnas de grafito, ya que pueden funcionar a presión elevada, pero un fallo del revestimiento de PTFE provocaría una rápida destrucción de la carcasa de acero. Estas columnas se pueden construir utilizando pequeños elementos individuales que se pueden reemplazar rápidamente, minimizando el tiempo de inactividad por mantenimiento.
Los intercambiadores de calor en todos los casos están fabricados en grafito. También son posibles revestimientos de tantalio y evaporadores, pero se deben tomar precauciones para evitar la fragilización debido a la absorción de hidrógeno. Además, debe estar ausente el fluoruro de hidrógeno.
El cloruro de hidrógeno completamente seco no corroe las tuberías de acero ni los compresores. Antiguamente se utilizaba ácido sulfúrico concentrado para secar el gas cloruro de hidrógeno. Otro enfoque utiliza las propiedades del sistema HCl-H2O.
A bajas temperaturas, la presión parcial de vapor del agua sobre el ácido clorhídrico altamente concentrado es muy baja, lo que permite secar el cloruro de hidrógeno enfriándolo a temperaturas bajo cero suficientemente bajas.
A una presión ligeramente elevada (p ≈ 0,3 MPa), alcanzar -10 °C suele ser suficiente para obtener resultados satisfactorios. Sin embargo, la neblina de ácido clorhídrico debe eliminarse por completo para evitar una corrosión grave.
3.2.4. Recuperación de la Incineración de Residuos
Todos los procesos de cloración resultan inevitablemente en la formación de hidrocarburos clorados no deseados junto con los productos deseados. Estas sustancias inutilizables y a menudo nocivas deben eliminarse por motivos medioambientales.
Un método posible es la incineración, que convierte los hidrocarburos clorados en cloruro de hidrógeno, agua y dióxido de carbono. Recuperar el cloruro de hidrógeno es esencial tanto por consideraciones económicas como medioambientales.
Si bien las técnicas específicas empleadas pueden variar, el principio subyacente sigue siendo el mismo. La combustión se realiza en un horno revestido con materiales refractarios a temperaturas superiores a 1000 °C.
Los hidrocarburos clorados residuales que normalmente contienen hasta un 70 % en peso de cloro tienden a presentar buenas propiedades de combustión. Sin embargo, aumentos adicionales en el contenido de cloro disminuyen el poder calorífico hasta tal punto que el proceso de combustión requiere la adición de fueloil o gas para sustentarlo.
Las condiciones óptimas de reacción se encuentran dentro del siguiente rango:
1. Debe haber un exceso de oxígeno para asegurar la completa descomposición de los hidrocarburos clorados. El gas cloruro de hidrógeno resultante puede reaccionar con este oxígeno según la ecuación de Deacon:
2 HCl + 0,5 O2 ↔ Cl2 + H2O
El aumento de la temperatura desplaza el equilibrio hacia la izquierda, favoreciendo la formación de cloruro de hidrógeno. La temperatura se mantiene tan alta como sea permitida para los materiales de construcción para evitar la formación de cloro.
Incluso con una presión parcial de agua alta y un exceso de oxígeno bajo, es necesaria una temperatura superior a 1000 °C para lograr el cambio de equilibrio deseado. Este enfoque ayuda a mantener los niveles de cloro en un rango aceptable y garantiza una combustión completa.
2. La temperatura de reacción no debe exceder los 1200 °C para evitar la formación de óxidos de nitrógeno. Estos óxidos contaminarían el producto de ácido clorhídrico y plantearían desafíos para la purificación de gases residuales. Usar oxígeno puro en lugar de aire puede ser una posible solución.
Por estas razones, la incineración de hidrocarburos clorados residuales suele producirse entre 1.000 y 1.200 °C. Enfriar los gases de combustión y generar vapor puede plantear desafíos relacionados con los materiales de construcción. Es importante asegurar la ausencia de productos de combustión corrosivos.
Los desechos tratados deben tener una composición bien conocida, incluidos trazas de contaminantes, para predecir con precisión los productos de combustión esperados, sus concentraciones y comportamiento. Se prefiere el enfriamiento rápido para evitar la reformación del cloro, ya que un enfriamiento lento puede conducir a su reformación.
El cloruro de hidrógeno se recupera de los gases de combustión mediante absorción. El proceso de recuperación es similar al utilizado en los procesos de cloración, con algunas excepciones:
- Un proceso seco no es posible ya que siempre hay vapor de agua presente.
- Los gases deben condensarse de manera que permitan la formación de ácido clorhídrico lo más concentrado posible. Esto permite la recuperación de cloruro de hidrógeno gaseoso o de ácido clorhídrico concentrado. El ácido clorhídrico diluido tiene un valor comercial limitado.
- Se deben abordar desafíos especiales de corrosión en los puntos potenciales de condensación de ácido, que pueden no ocurrir con regularidad pero aún pueden presentar riesgos.
- Si los productos gaseosos de la combustión se utilizan directamente, la temperatura de funcionamiento siempre debe mantenerse por encima de la temperatura de condensación del ácido clorhídrico.
Una de las plantas más antiguas que produce cantidades comerciales de ácido clorhídrico al 33 % en peso mediante la incineración de hidrocarburos clorados está ubicada en St. Auban, Francia, y es operada por Atochem. Esta planta, establecida en 1975, consume aproximadamente 16.000 toneladas de hidrocarburos clorados al año.
3.3. Purificación de ácido clorhídrico
El carbón activado puede eliminar eficazmente diversas impurezas del gas cloruro de hidrógeno, incluidos SO2, As y Cl2, mediante adsorción. A medida que disminuye la importancia del proceso de sulfato, la eliminación de hidrocarburos clorados del gas cloruro de hidrógeno o del ácido clorhídrico se vuelve más relevante en la práctica.
El cloruro de hidrógeno gaseoso puede purificarse mediante depuración a baja temperatura utilizando un disolvente de alto punto de ebullición, que podría ser otro hidrocarburo clorado (por ejemplo, hexaclorobutadieno o tetracloroetano) o fracciones de aceite específicas. Después de dicho tratamiento, el uso de carbón activado suele ser innecesario.
El cloro se puede eliminar empleando tetracloruro de carbono, ya que es significativamente más soluble en tetracloruro de carbono en comparación con el gas cloruro de hidrógeno.
El ácido clorhídrico, ya sea que se use directamente o para generar cloruro de hidrógeno, contiene principalmente impurezas volátiles como los hidrocarburos clorados. En tales casos, estas impurezas se pueden eliminar del ácido mediante extracción.
La extracción con una corriente de gas inerte es una opción factible que resulta en un menor consumo de energía. Sin embargo, en la mayoría de los casos se prefiere calentar el gas por razones medioambientales. Las impurezas inorgánicas, especialmente el hierro, se pueden eliminar mediante intercambio iónico.
4. Usos del ácido clorhídrico
El ácido clorhídrico y el cloruro de hidrógeno son sustancias químicas vitales en diversos procesos industriales.
El productor suele utilizar la mayor parte del cloruro de hidrógeno inmediatamente, ya que el subproducto de los procesos de cloración orgánica debe utilizarse en su totalidad. Esto se logra mediante técnicas de oxicloración o hidrocloración o, en algunos casos, métodos de recuperación de cloro como el proceso KEL, el proceso Deacon modificado o la electrólisis del ácido clorhídrico.
El ácido clorhídrico acuoso encuentra amplias aplicaciones como ácido inorgánico fuerte. Se emplea en la fabricación de cloruros, disolución de minerales, decapado y grabado de metales, regeneración de resinas de intercambio iónico para el tratamiento de agua, neutralización de productos alcalinos o materiales de desecho, acidificación de salmuera en electrólisis cloro-álcali y muchos otros usos industriales. procesos.
5. Toxicología y Salud Ocupacional
Se sabe que el cloruro de hidrógeno causa irritación grave en los ojos, el tracto respiratorio y la piel, aunque en menor medida. La exposición a su vapor puede provocar queratoconjuntivitis y la inhalación puede provocar irritación y daño a las membranas mucosas. El olor a cloruro de hidrógeno normalmente se puede detectar en concentraciones de 1 a 5 ppm, y se vuelve desagradable a concentraciones de 5 a 10 ppm.
La exposición ocupacional prolongada a niveles elevados de cloruro de hidrógeno puede aumentar el riesgo de bronquitis crónica, trastornos estomacales e intestinales y caries dental, incluso en concentraciones aparentemente tolerables. Concentraciones superiores a 10 ppm pueden provocar fuertes irritaciones, incluso con la aclimatación.
El personal que trabaja con ácido clorhídrico debe usar gafas protectoras, ropa, guantes de goma y botas adecuadas. Se debe evitar la inhalación del vapor y se recomiendan filtros respiratorios diseñados para gases inorgánicos.
En la República Federal de Alemania se aplican normas para el control de sustancias peligrosas según las directivas de la CEE para el cloruro de hidrógeno y el ácido clorhídrico (>10 % en peso). Estas regulaciones especifican símbolos de peligro, instrucciones de seguridad y precauciones para el manejo de estas sustancias.
En caso de contacto con la piel o los ojos, es esencial un enjuague inmediato y profundo con agua. La ropa contaminada debe tratarse de manera similar y se pueden usar soluciones de limpieza alcalinas.
Cuando se trabaja con cloruro de hidrógeno, especialmente a presión elevada, es fundamental tener disponible un aparato respiratorio con suministro de aire independiente y ropa protectora completa en caso de accidentes.
En Alemania, la concentración máxima permitida (MAK) de cloruro de hidrógeno es de 5 ppm en volumen, equivalente a 7 mg/m3. Los mismos valores sirven como valor límite umbral (TLV) en los Estados Unidos. En la Unión Soviética el límite establecido es de 3 ppm (5 mg/m3).
Las regulaciones de aire limpio especifican límites de concentración de cloruro de hidrógeno en la atmósfera, como 0,1 mg/m3 como promedio anual y 0,2 mg/m3 por períodos cortos. Las diferentes especies de plantas exhiben diferentes tolerancias a la exposición al cloruro de hidrógeno.
En el caso de los gases residuales industriales, la concentración de cloruro de hidrógeno no debería exceder generalmente los 30 mg/m3 según la normativa alemana, aunque el límite es de 50 mg/m3 para las plantas de incineración de residuos. Como resultado, el coste de la limpieza de gases puede variar significativamente.
El lavado con agua suele ser suficiente para eliminar el cloruro de hidrógeno, pero pueden ser necesarias varias etapas, incluido un lavado final con una solución alcalina.
En algunos casos, no se puede producir ácido clorhídrico comercial y el ácido diluido se neutraliza antes de desecharlo en las aguas residuales. La neutralización con soda cáustica ocasionalmente puede producir una solución salina lo suficientemente pura como para reciclarla en una planta de cloro.
Referencia
- Hydrochloric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_283
Preguntas frecuentes: ácido clorhídrico
El ácido clorhídrico (HCl) es un ácido fuerte y altamente corrosivo compuesto de hidrógeno y cloro. Es un líquido incoloro con un olor acre.
Sí, el ácido clorhídrico se considera un ácido fuerte. Se ioniza completamente en agua, liberando iones de hidrógeno (H+) e iones de cloruro (Cl-) para crear una solución ácida.
El ácido clorhídrico tiene diversos usos industriales y de laboratorio. Se utiliza comúnmente en síntesis química, limpieza de metales, regulación del pH, procesamiento de minerales y producción de fertilizantes, colorantes y productos farmacéuticos. También se utiliza en la industria alimentaria para el procesamiento de alimentos y en suplementos de ácido gástrico.
El ácido clorhídrico no es inflamable. Sin embargo, puede reaccionar con determinadas sustancias, como materiales orgánicos o metales reactivos, liberando gas hidrógeno inflamable.
Sí, el ácido clorhídrico es muy corrosivo y puede provocar quemaduras graves en la piel, los ojos y el sistema respiratorio. La inhalación o ingestión de ácido clorhídrico concentrado puede ser extremadamente peligrosa. Se deben seguir las precauciones de seguridad y los procedimientos de manipulación adecuados.
El ácido clorhídrico se produce comúnmente disolviendo gas cloruro de hidrógeno en agua. La producción industrial a menudo implica la reacción de cloro gaseoso con hidrógeno gaseoso. Estos procesos sólo deben realizarse en entornos industriales controlados debido a la naturaleza peligrosa de los productos químicos involucrados.
El ácido clorhídrico es un solvente poderoso y puede disolver muchos metales, óxidos metálicos, carbonatos y ciertos compuestos orgánicos. Es particularmente eficaz para disolver el óxido o las incrustaciones de superficies metálicas.
La fórmula química del ácido clorhídrico es HCl, lo que indica que está compuesto por un átomo de hidrógeno y un átomo de cloro.
El ácido clorhídrico es un líquido incoloro. No tiene un color distinto.
