Producción de solución de hidróxido de sodio
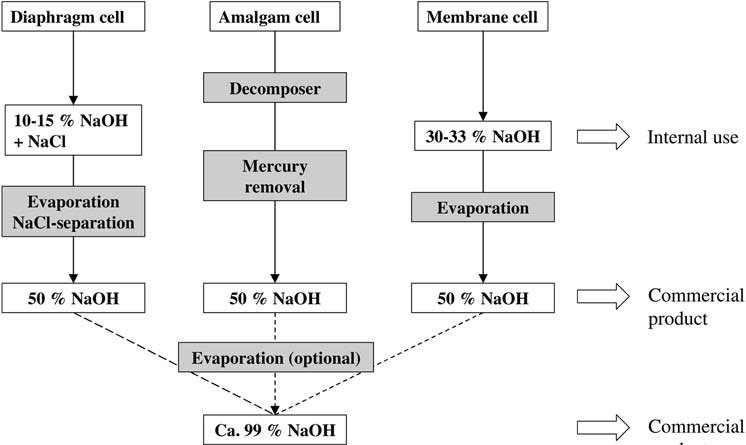
1. Electrólisis del cloruro de sodio
La producción industrial de solución de hidróxido de sodio implica principalmente la electrólisis del cloruro de sodio.
La reacción produce una solución de hidróxido de sodio, cloro gaseoso y gas hidrógeno en una proporción de masa de 1: 0,88: 0,025, como lo representa la ecuación general:
2 NaCl + 2 H2O → 2 NaOH + Cl2 + H2
El proceso de membrana se introdujo a principios de los años 1980 como una alternativa a los procesos de amalgama y diafragma para la producción de cloro-álcali.
En 2004, el proceso de membrana representó más del 44% de la capacidad total instalada de cloro-álcali. Este proceso ahorra aproximadamente un 30% de energía eléctrica y se considera la mejor técnica disponible, lo que lleva a un uso cada vez mayor de la tecnología en nuevas unidades.
En Japón, el proceso de amalgama se eliminó gradualmente y algunas plantas de diafragma fueron reemplazadas por plantas de membrana debido a consideraciones de costo y calidad en 1988.
En el proceso de amalgama, se produce una solución de hidróxido de sodio a partir de amalgama de sodio y agua sobre un catalizador de grafito a 80 – 120 °C, lo que produce una solución al 50 % en peso que se enfría y luego se vende sin tratamiento adicional después de que el mercurio se elimina mediante centrifugación o filtración. .
La celda de diafragma produce una solución que contiene aproximadamente 18% en peso de cloruro de sodio y 10-15% en peso de hidróxido de sodio.
Durante la evaporación, las impurezas arrastradas con la solución de cloruro de sodio empobrecida se eliminan hasta su solubilidad límite mediante cristalización fraccionada, y el contenido de cloruro de sodio solo se puede reducir a aproximadamente 1 – 1,5% en peso.
El proceso de membrana implica el uso de una membrana hidráulicamente impermeable para evitar la mezcla de los electrolitos.
Este proceso produce una solución de hidróxido de sodio de alta pureza, prácticamente libre de cloruros, comparable a la del proceso de amalgama. Sin embargo, el contenido de cloruro aumenta en un factor de aproximadamente 10 si el funcionamiento de la celda se interrumpe debido a la difusión de iones Cl‾ a través de la membrana.
El sulfato y el clorato presentes en el anolito también afectan la concentración de impurezas en el licor cáustico de la celda de la membrana. Esto se debe a que la membrana selectiva para cationes tiene una permeabilidad residual apreciable para los aniones. La mayoría de las celdas de membrana ofrecen un rendimiento económico óptimo con una concentración de NaOH del 30 al 35 % en peso.
Se ha desarrollado una membrana de intercambio iónico que permite la producción de una solución de hidróxido de sodio al 50% en peso en la celda, pero a expensas de un aumento considerable del voltaje. Estas membranas sólo son viables si los costos del vapor son altos y los costos de electricidad son bajos.
La solución de hidróxido de sodio al 30 – 33 % en peso generalmente se concentra en un evaporador de película descendente de dos o tres etapas, dependiendo de los costos del vapor y el tamaño de la planta, para obtener una solución comercial al 50 % en peso.
El consumo de vapor para un evaporador de tres etapas es de 0,55 t por tonelada de NaOH (100%), y para un evaporador de dos etapas es de 0,71 t por tonelada de NaOH (100%), con la solución de hidróxido de sodio y el vapor en contracorriente. fluir.
A diferencia del licor de celda de diafragma, la evaporación del licor de celda de membrana no produce ningún material sólido que pueda ensuciar el intercambiador de calor o erosionar las tuberías.
La absorción de metales durante la evaporación es de aproximadamente 1 ppm en peso si se utilizan materiales de construcción apropiados como níquel y acero inoxidable.
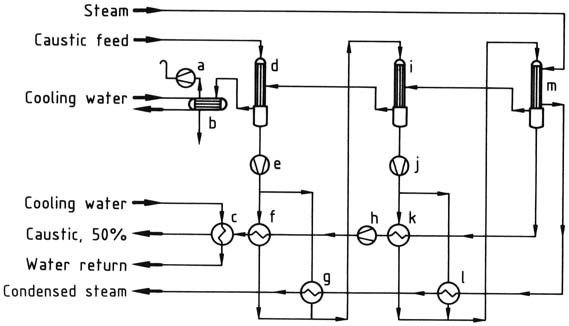
a) Bomba de vacío; b) Condensador; c) Enfriador de cáustico; d) Primer evaporador; e) Bomba cáustica; f ) Primer intercambiador de calor cáustico; g) Segundo intercambiador de calor; h) Bomba cáustica; i) Segundo evaporador; j) Bomba cáustica; k) Segundo intercambiador de calor cáustico; l) Primer intercambiador de calor; m) Tercer evaporador
Los tres procesos electrolíticos diferentes utilizados para producir hidróxido de sodio tienen diferentes requisitos energéticos.
El proceso de membrana requiere la menor cantidad de energía eléctrica, que oscila entre 2200 y 2500 kWh por tonelada de NaOH. Sin embargo, para generar una solución al 50 % en peso, se necesitan 200-300 kWh adicionales por tonelada de NaOH en forma de vapor.
Por el contrario, el proceso de diafragma utiliza menos energía eléctrica que el proceso de amalgama, pero necesita entre 700 y 900 kWh por tonelada de NaOH para la etapa de evaporación. Como resultado, el proceso de diafragma tiene el mayor consumo total de energía.
Debido a la gran demanda de energía eléctrica, los investigadores se han centrado en reducir el voltaje de la celda. El proceso de celda de membrana puede lograr una reducción de voltaje de aproximadamente 1 V mediante el uso de un cátodo de difusión de oxígeno, similar a una celda de combustible. Sin embargo, en este caso no se generan subproductos de hidrógeno.
Esta tecnología ha despertado un gran interés. El desarrollo del diseño de celdas, los cátodos de difusión de oxígeno y su integración en el diseño de la celda son áreas principales de atención. Los esfuerzos de investigación también se dirigen a explorar parámetros operativos y periféricos celulares.
La electrólisis de NaCl fusionado a 350°C con un diafragma de β-Al2O3 es una técnica prometedora. Las células a escala de laboratorio han alcanzado un consumo de energía de 2350 kWh por tonelada de NaOH. Sin embargo, esta técnica aún no se ha utilizado a escala comercial.
2. Otros procesos
1. La producción de hidróxido de sodio mediante caustificación de una solución de carbonato de sodio es el método más antiguo conocido. Era el único método disponible hasta la llegada de la electrólisis. Este método ha recuperado el interés entre las empresas que tienen acceso al carbonato de sodio sintético o natural.
En este proceso, se combina una solución caliente de aproximadamente un 12 % de carbonato de sodio con cal viva. Se elimina el carbonato de calcio precipitado y la solución de hidróxido de sodio de aproximadamente el 12% se evapora en varias etapas.
Na2CO3 + CaO·H2O → 2 NaOH + CaCO3
Las impurezas que precipitan, incluidos NaCl y Na2SO4, se filtran.
2. La combinación de celdas electrolíticas y de diálisis es una forma de dividir las sales de sodio en los ácidos y álcalis correspondientes:
Na2SO4 + 2 H2O → 2 NaOH + H2SO4
En una celda de dos cámaras, se puede utilizar una membrana de intercambio catiónico o aniónico. En una celda de tres cámaras, se puede emplear una membrana de intercambio catiónico y una de intercambio aniónico. Alternativamente, se puede usar una celda multicámara, que utiliza una combinación de cationes, aniones y membranas bipolares.
Sin embargo, todas las celdas operadas industrialmente producen una solución de hidróxido de sodio diluido (15-30 % en peso) que contiene algo de sal de material de partida.
Por lo tanto, este tipo de proceso es más adecuado para tratar aguas residuales que contienen sal de sodio de procesos en los que la solución diluida de hidróxido de sodio obtenida se puede reciclar con fines de neutralización.
3. El proceso de recuperación de ferrita proporciona una forma alternativa de producir una solución de hidróxido de sodio adecuada para pequeñas plantas de pulpa de papel.
Este proceso implica la evaporación del licor residual que contiene sales de sodio y sustancias orgánicas. El residuo resultante se mezcla con Fe2O3 y se calcina, formando ferrita de sodio que, al descomponerse con agua, produce NaOH y Fe2O3.
Referencia
- Sodium Hydroxide; Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.- https://onlinelibrary.wiley.com/doi/10.1002/14356007.a24_345.pub2
