Disulfuro de carbono: reacciones, producción y usos
El disulfuro de carbono, CS2, es un importante compuesto químico ampliamente empleado en diversas aplicaciones industriales. Su descubrimiento se puede atribuir a Lampadius en 1796, quien lo encontró mientras calentaba una combinación de pirita de hierro y carbono.
El compuesto despertó interés industrial ya en 1839, cuando Schrötter lo sintetizó con éxito utilizando carbón y azufre en una retorta calentada. Rápidamente se reconocieron las notables capacidades disolventes del disulfuro de carbono, lo que llevó a su uso generalizado en la extracción de grasas y aceites durante un período considerable.
Sin embargo, su verdadera importancia como producto químico industrial a gran escala surgió con la llegada del proceso del rayón viscosa a principios del siglo XX. Este proceso dependía del disulfuro de carbono para disolver la celulosa, estableciendo así su papel fundamental en la industria.
No obstante, el rápido crecimiento del rayón enfrentó reveses a finales de los años 1960 debido a la competencia de las fibras sintéticas a base de petróleo, lo que resultó en una disminución posterior tanto en el mercado del rayón como en el del disulfuro de carbono a lo largo de los años 1970. Sin embargo, en los últimos tiempos, el uso de disulfuro de carbono se ha estabilizado y se proyecta un pequeño crecimiento del mercado para el futuro.
En 1984, de la producción mundial total de 1,1 millones de toneladas de disulfuro de carbono, más del 75% fue consumido principalmente por la industria de la celulosa regenerada. La porción restante encontró su aplicación en la producción de tetracloruro de carbono y diversos compuestos organosulfurados, que se utilizan ampliamente como productos químicos para el caucho, agentes de flotación y pesticidas.
Tabla de contenido
1. Propiedades físicas del disulfuro de carbono
El disulfuro de carbono es un líquido altamente volátil de densidad significativa, que exhibe un amplio rango de inflamabilidad en presencia de aire, que abarca del 1 al 50 por ciento en volumen. En particular, posee una temperatura de autoignición excepcionalmente baja de 100 °C y un punto de inflamación de -30 °C. Su tasa de evaporación a la atmósfera supera la del éter dietílico en un factor de 1,6.
Este compuesto sirve como un disolvente excepcional para numerosas sustancias orgánicas, disolviendo fácilmente azufre, fósforo, yodo, ceras, caucho y resinas. La forma disponible comercialmente emite un aroma acre, característico de los compuestos a base de azufre.
Algunas de las propiedades físicas más útiles del disulfuro de carbono son las siguientes:
- Masa molar = 76,13 g/mol
- Punto de fusión = -111,6 °C
- Punto de ebullición = 46,23 °C
- Densidad a 25 °C = 1,26 g/ml
- Temperatura crítica = 273 °C
- Presión crítica = 7600 kPa
- Tensión superficial a 20 °C = 32,3 mN/m
- Índice de refracción a 20 °C = 1,62546
- Viscosidad a 25 °C = 0,36 mPa.s
2. Reacciones químicas del disulfuro de carbono
El disulfuro de carbono exhibe una amplia gama de reacciones químicas que han sido ampliamente estudiadas y documentadas.
Cuando el disulfuro de carbono reacciona con sulfuros, alcoholes, amoníaco, aminas y cloro, genera derivados e intermedios de importancia industrial. En presencia de álcalis acuosos, el disulfuro de carbono reacciona lentamente para formar compuestos de tritiocarbonato y carbonato, como lo representa la ecuación:
3 CS2 + 6 NaOH → 2 Na2CS3 + Na2CO3 + 3 H2O
Los sulfuros metálicos forman tritiocarbonatos cuando reaccionan con disulfuro de carbono, como se muestra en la reacción:
K2S (acuoso) + CS2 → K2CS3
Además, cuando el disulfuro de carbono reacciona con álcalis alcohólicos, produce xantatos, que son sales de ditiocarbonatos, mediante el siguiente proceso:
ROH + NaOH → RONa + H2O
RONa + CS2 → ROCSSNa
Esta reacción sirve como base para el proceso de la viscosa, en el que la celulosa se convierte en xantato y posteriormente se regenera en forma de fibras y películas, como se demuestra en la reacción:
(celulosa)ONa + CS2 → (celulosa)OCSSNa
2(celulosa)OCSSNa + H2SO4 → 2(celulosa)OH + 2 CS2 + Na2SO4
En presencia de amoníaco, el disulfuro de carbono forma ditiocarbamato de amonio (1), tritiocarbonato de amonio (2) y tiocianato de amonio (3), según la concentración de amoníaco y la temperatura:
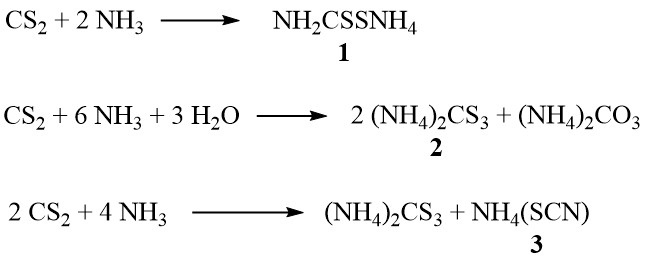
Además, a temperaturas más altas en la fase de vapor, el tiocianato se descompone para producir tiourea:
NH4(SCN) → SC(NH2)2
Las aminas primarias y secundarias producen predominantemente sales de ditiocarbamato en su reacción con disulfuro de carbono:
2 RNH2 + CS2 → RNHCSSNH3R
2 R2NH + CS2 → R2NCSSNH2R2
En presencia de álcalis, se pueden obtener diversas sales de ácido ditiocarbámico de importancia comercial:
R2NH+ CS2 + NaOH → R2NCSSNa + H2O
La reacción del disulfuro de carbono con metilamina y sosa cáustica en una solución acuosa produce metilditiocarbamato de sodio (CH3NHCSSNa), un fumigante esencial para el suelo. De manera similar, el disulfuro de carbono reacciona con etilendiamina para producir el fungicida etilen bis (ditiocarbamato) de sodio:
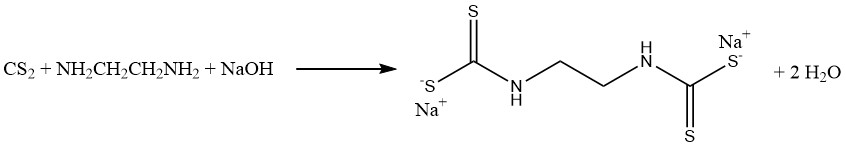
Las reacciones de anilina y disulfuro de carbono dan como resultado la formación de dos importantes aceleradores de vulcanización. En ausencia de azufre se produce tiocarbanilida, mientras que en presencia de azufre se obtiene 2-mercaptobenzotiazol (MBT):
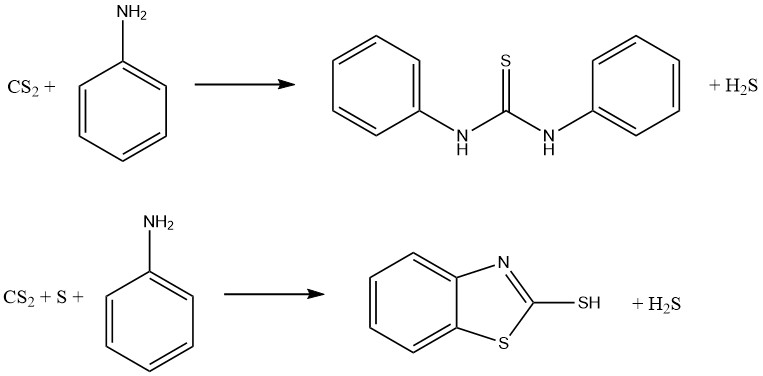
Los ditiocarbamatos se pueden oxidar para formar una familia de compuestos conocidos como disulfuros de tiuro, que se utilizan como fungicidas y aceleradores de vulcanización. La reacción involucra la siguiente ecuación:
2 R2NCSSNa + H2O2 + H2SO4 → (R2NCSS–)2 + Na2SO4 + 2 H2O
La cloración del disulfuro de carbono conduce a la formación de diversos productos clorados. Bajo catálisis con yodo, la cloración a temperaturas entre 5 y 30 °C produce cloruro de triclorometanosulfenilo, junto con tetracloruro de carbono, dicloruro de azufre y tiofosgeno, según el grado de cloración.
En presencia de cloruros de hierro y metales a temperaturas más altas (70 – 100 °C), se obtienen exclusivamente tetracloruro de carbono y cloruros de azufre.
El disulfuro de carbono reacciona fácilmente con agua en presencia de alúmina y catalizadores de óxido por encima de 150 °C, produciendo dióxido de carbono y sulfuro de hidrógeno. El sulfuro de carbonilo actúa como intermediario en esta reacción de hidrólisis. A temperaturas que oscilan entre 200 y 300 °C, la conversión de disulfuro de carbono en estos productos alcanza el equilibrio.
Cuando se somete a altas temperaturas (por encima de 150 – 200 °C) en presencia de catalizadores de sulfuro metálico como sulfuros de molibdeno y níquel, el disulfuro de carbono se reduce con hidrógeno, lo que da como resultado cantidades variables de metanotiol, sulfuro de dimetilo, metano y sulfuro de hidrógeno.
3. Producción de disulfuro de carbono
El disulfuro de carbono se produce por la reacción del azufre con carbón o metano. Aunque el etano, el propano y el propeno se han utilizado de forma limitada, el proceso del metano ha ganado importancia significativa desde su introducción a principios de los años cincuenta.
En consecuencia, el antiguo proceso de carbón vegetal ya no es relevante en la fabricación de disulfuro de carbono en Estados Unidos, Europa y Japón. Sin embargo, en regiones donde el gas natural o el metano no son fácilmente accesibles o cuando el tamaño de la planta es relativamente pequeño, el proceso de carbón vegetal todavía se emplea para satisfacer las demandas locales de producción de rayón viscosa.
3.1. Producción de disulfuro de carbono a partir de carbón vegetal y azufre
El proceso fundamental para la reacción del carbón vegetal con azufre ha sufrido cambios mínimos desde sus inicios a mediados de la década de 1840. Todavía se utilizan autoclaves calentadas externamente, aunque el diseño del equipo ha mejorado significativamente con la disponibilidad de materiales de construcción superiores.
En las plantas de retorta, el azufre fundido se vaporiza y se sobrecalienta antes o después de introducirlo en la retorta. Dentro de la retorta, a temperaturas que oscilan entre 850 y 900 °C y ligeramente por encima de la presión atmosférica, el vapor de azufre sobrecalentado reacciona con un lecho estacionario de carbón.
El gas producto resultante, que incluye disulfuro de carbono, azufre, sulfuro de hidrógeno, sulfuro de carbonilo y gases inertes, pasa a través de una serie de condensadores, depuradores y absorbentes de aceite para recuperar el disulfuro de carbono crudo.
Un tratamiento adicional en columnas de destilación produce el producto puro. El gas de cola, que consiste principalmente en sulfuro de hidrógeno, sulfuro de carbonilo y gases inertes, puede incinerarse y lavarse con una solución cáustica o dirigirse a una planta de recuperación de azufre.
Normalmente, cada retorta es capaz de producir de 1 a 3 toneladas métricas por día de disulfuro de carbono. La vida útil de las retortas de hierro fundido está limitada a menos de un año debido a la corrosión a alta temperatura. Para minimizar la necesidad de limpieza del reactor, las materias primas utilizadas en las retortas deben tener un bajo contenido de cenizas y residuos. La suciedad de las retortas dificulta la transferencia de calor y reduce su vida útil.
La calidad del carbón vegetal es crucial, ya que los materiales menos reactivos requieren temperaturas más altas para un funcionamiento satisfactorio. Por este motivo, se prefiere el carbón vegetal derivado de la madera dura.
El carbón vegetal normalmente se precalcina a 500 °C para eliminar sustancias volátiles que podrían provocar la formación de subproductos indeseables. La eficiencia térmica de las retortas es aproximadamente del 25%, con rendimientos de carbono y azufre generalmente inferiores al 90%.
Una fuente de calor alternativa para la reacción del carbón vegetal con azufre es el calentamiento por resistencia eléctrica en reactores electrotérmicos revestidos de ladrillos. Cuando se dispone de energía económica, el método eléctrico puede ser más rentable.
El consumo de energía por tonelada métrica de disulfuro de carbono producida es de unos 1200 kWh. Los reactores electrotérmicos ofrecen varias ventajas, incluida una mayor capacidad por reactor (hasta 10 toneladas métricas por día) y una vida útil prolongada del reactor. Además, se puede utilizar una gama más amplia de alimentación de carbono sólido, ya que los reactores electrotérmicos pueden generar temperaturas más altas.
3.2. Producción de disulfuro de carbono a partir de metano y azufre
Debido a la creciente demanda de disulfuro de carbono en la década de 1940, las limitaciones de los procesos de carbón impulsaron el desarrollo de un método de fabricación a gran escala más eficiente.
La reacción catalizada entre metano y azufre, aprovechando el gas natural rentable y fácilmente disponible, surgió como una alternativa exitosa. Entre 1943 y 1965 se concedieron numerosas patentes que cubrían diversos aspectos de este proceso.
El proceso comercial de metano, basado principalmente en las patentes adquiridas por Pure Oil Co., fue posteriormente asumido por Food Machinery Corp. (FMC) y Stauffer Chemical Co.
En 1953, FMC construyó la primera planta de procesamiento de metano en South Charleston, Virginia Occidental, seguida de una planta Stauffer en LeMoyne, Alabama, tres años después. A mediados de la década de 1960, toda la producción de disulfuro de carbono en los Estados Unidos se lograba mediante este método, y pronto surgieron plantas similares en Europa y otras regiones.
Actualmente, más del 85% de la capacidad de producción mundial de disulfuro de carbono se basa en el proceso del metano.
En la Figura 1 se ilustra un diagrama de flujo típico del proceso de metano. El gas natural purificado, que contiene más del 95 % de metano y bajas concentraciones de propano e hidrocarburos más pesados, se precalienta a aproximadamente 250 °C en la sección de convección del horno de reacción.
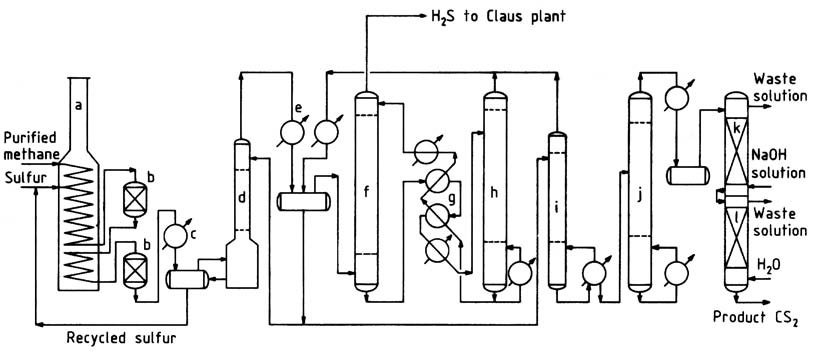
a) Horno de reacción; b) reactores catalíticos; c) Condensador de azufre; d) depurador de CS2; e) condensador CS2; f) absorbente de CS2; g) Intercambiadores de petróleo; h) separador de CS2; i) columna estabilizadora; j) columna de purificación; k) columna de lavado de cáusticos; l) Columna de lavado con agua
El horno, un horno de pirólisis de tipo caja comúnmente empleado en la industria petroquímica, consta de secciones radiantes y de convección. El gas metano caliente se mezcla con azufre líquido y se introduce en el serpentín calefactor horizontal situado en la sección radiante.
En esta sección, el azufre líquido se vaporiza y la temperatura de la mezcla aumenta a 550-650 °C. La presión de funcionamiento suele oscilar entre 400 y 700 kPa.
Alternativamente, se pueden introducir metano y azufre por separado y en diferentes lugares dentro del serpentín. Se emplea un ligero exceso de azufre (alrededor del 5%) para asegurar una conversión eficiente de metano y minimizar la formación de carbono y alquitrán.
Para resistir el ambiente corrosivo de alta temperatura, se utiliza acero inoxidable fundido de alta aleación como material del tubo, lo que proporciona una vida útil del tubo de aproximadamente 2 a 3 años. Los reactores empaquetados y revestidos de ladrillos están conectados al serpentín de calentamiento para ofrecer tiempo de residencia adicional y alojamiento para los lechos de catalizador.
La reacción tiene lugar tanto en los tubos como en los reactores, lo que garantiza una conversión casi completa de los hidrocarburos antes de que el gas salga del último reactor. El gas que sale del sistema del horno de reacción pasa a través de un condensador de azufre, donde se separa la mayor parte del exceso de azufre.
Posteriormente, el gas enfriado pasa a un depurador de azufre y luego al depurador de CS2, donde se elimina el azufre restante. El gas relativamente libre de azufre ingresa a condensadores enfriados por agua para la separación en masa del disulfuro de carbono.
El disulfuro de carbono restante se extrae del gas de sulfuro de hidrógeno en el absorbente de aceite. El gas de sulfuro de hidrógeno que sale del absorbente de aceite contiene aproximadamente entre 1 y 2 % de metano y menos de 1000 ppm de disulfuro de carbono.
Este gas se dirige a una planta de recuperación de azufre de Claus, donde se convierte nuevamente en azufre.
El disulfuro de carbono crudo, incluido el recuperado en el separador, se envía a la columna estabilizadora para eliminar las impurezas de bajo punto de ebullición.
Los fondos de la columna estabilizadora luego se procesan en la columna de purificación para separar del producto los contaminantes de alto punto de ebullición. La purificación del producto se completa mediante lavados cáusticos y con agua, después de lo cual el producto terminado se bombea para verificar los tanques y el almacenamiento.
4. Usos del disulfuro de carbono
El principal consumidor de disulfuro de carbono es la industria de la celulosa regenerada, que representa más del 65% de la producción mundial. Específicamente, la fabricación de rayón utiliza una porción significativa de disulfuro de carbono, consumiéndose aproximadamente 0,32 kg de disulfuro de carbono por cada kilogramo de rayón producido.
Alrededor del 10% del disulfuro de carbono se utiliza en la producción de celofán, mientras que otro 10% se clora para producir tetracloruro de carbono. Este método representa aproximadamente el 25% de la producción mundial de tetracloruro de carbono.
El 15% restante del disulfuro de carbono se distribuye entre diversas aplicaciones, que incluyen productos químicos para caucho, agentes de flotación, pesticidas, reactivos químicos diversos, solventes de extracción, agentes de presulfidación de catalizadores y solventes para pozos petroleros.
Sin embargo, la industria de la celulosa regenerada enfrenta desafíos debido a la competencia de fibras y películas sintéticas, lo que limita su crecimiento en el mercado. Para fomentar el progreso, es necesario mejorar gradualmente el uso del disulfuro de carbono, particularmente mediante una mayor utilización en la fabricación de productos químicos agrícolas y especializados.
Referencia
- Carbon Disulfide; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a05_185
