Dimetilamina
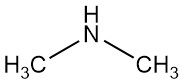
La dimetilamina es un compuesto orgánico con la fórmula (CH3)2NH. Es un gas incoloro, inflamable y con olor parecido al amoníaco, aunque en bajas concentraciones puede oler a pescado y su olor es más potente que metilamina y menos que trimetilamina. La dimetilamina se encuentra comúnmente comercialmente como una solución en agua en concentraciones de hasta alrededor del 40%.
Tabla de contenido
1. Propiedades físicas de la dimetilamina
La dimetilamina es un gas o líquido comprimido nocivo e incoloro que es altamente inflamable y tiene olores muy fuertes a pescado o amoníaco. Es soluble en agua y se vende como soluciones acuosas o en forma pura.
Al enfriar soluciones acuosas de dimetilamina, se forma el hidrato cristalino (CH3)2NH·7 H2O. La dimetilamina es soluble en varios disolventes orgánicos.
Las soluciones acuosas de dimetilamina son buenos disolventes para muchos compuestos orgánicos e inorgánicos; sin embargo, se debe considerar la reactividad potencial del soluto con la dimetilamina.
La Tabla 1 enumera las propiedades físicas de la dimetilamina.
| Propiedad | Valor |
|---|---|
| Peso molecular, g/mol | 45,08 |
| Punto de ebullición (101,33 kPa), °C | 6.8 |
| Punto de fusión, °C | -92,2 |
| Densidad a 25 °C (líquido), g/cm3 | 0,6556 |
| pKa (a 25 °C) | 10.77 |
| Índice de refracción a 17 °C | 1.350 |
| Tensión superficial (25 °C), 10-3 N/m | 16.33 |
| Calor de vaporización a 25°C, kJ/mol | 23.663 |
| Calor de fusión, kJ/mol | 5.945 |
| Calor de formación estándar, kJ/mol a 25 °C (líquido) | -43,96 |
| Calor de formación estándar, kJ/mol a 25 °C (gas) | -18,46 |
| Calor de combustión, estado estándar a 25°C, líquido, kJ/mol | -1744,63 |
| Capacidad calorífica, gas ideal (25°C), J K-1 mol-1 | 70,7 |
| Temperatura crítica, °C | 164,5 |
| Presión crítica, MPa | 5.31 |
| Constante dieléctrica (25°C), líquido | 5.26 |
| Momento dipolar en benceno (25°C), D | 1.18 |
| Punto de inflamación (copa cerrada), °C | -57 |
| Temperatura de ignición en el aire, °C | 400 |
| Límite inferior de explosión en el aire, % vol | 2.8 |
| Límite superior de explosión en el aire, % vol | 14.4 |
2. Reacciones químicas de la dimetilamina
La dimetilamina es básica y, en consecuencia, reacciona con agua y ácidos para formar compuestos de dimetilamonio. Debido a la presencia de grupos metilo donadores de electrones, la dimetilamina posee una mayor basicidad que el amoníaco.
Estos grupos metilo estabilizan la carga positiva formada durante la protonación. Sin embargo, su basicidad sigue siendo más débil en comparación con los iones hidróxido y alcóxido.
La dimetilamina se comporta como un nucleófilo debido a la presencia de un par de electrones no compartidos en el átomo de nitrógeno. La dimetilamina reacciona fácilmente con una variedad de sustratos, incluidos ácidos carboxílicos, haluros de acilo, anhídridos, ésteres, lactonas, isocianatos, nitrilos y ésteres α,β-insaturados, epóxidos, haluros de alquilo, dióxido de carbono y disulfuro de carbono.
La reacción de la dimetilamina con un ácido orgánico o el éster de un ácido orgánico conduce a la formación de una amida sustituida con dimetilo.
La dimetilamina y el fosgeno reaccionan para producir tetrametilurea. La reacción con urea conduce a la N,N-dimetilurea esperada.
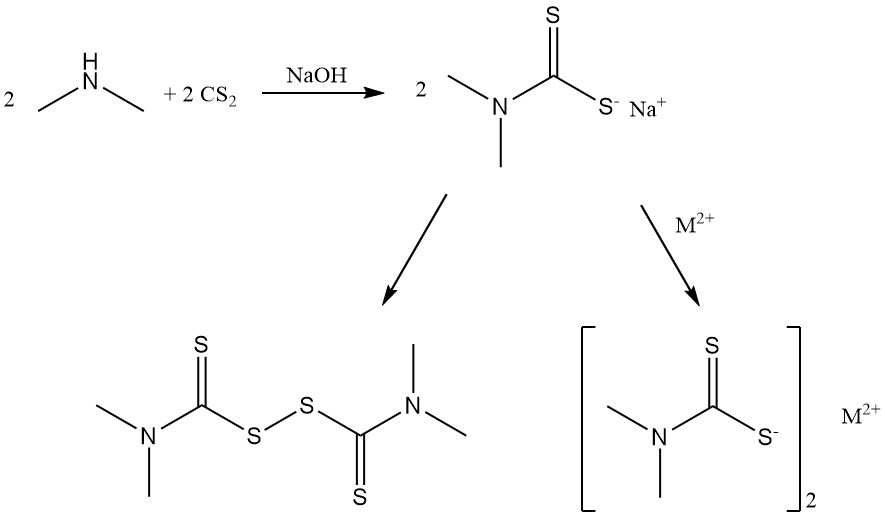
La reacción de la dimetilamina con disulfuro de carbono produce sales de dimetilditiocarbamato y disulfuro de bis(dimetilditiocarbamoilo) que se utilizan como aceleradores de caucho.
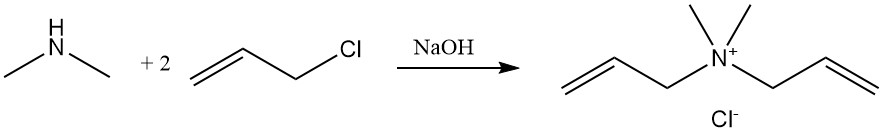
La reacción de dimetilamina con cloruro de alilo produce cloruro de dialildimetilamonio, un monómero que se polimeriza y se utiliza como floculante en aplicaciones de tratamiento de agua.
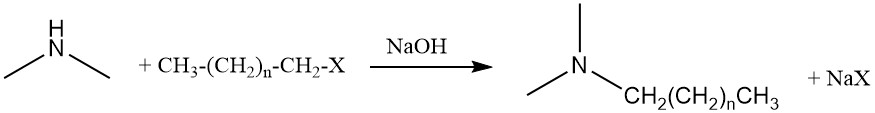
La dimetilamina también puede sufrir una reacción de aminación adicional con alcoholes grasos o haluros grasos para producir alquildimetilaminas, que son precursores de los tensioactivos de óxido de amina.
Tanto el ácido nitroso como el cloruro de nitrosilo convierten la dimetilamina en la nitrosamina correspondiente.
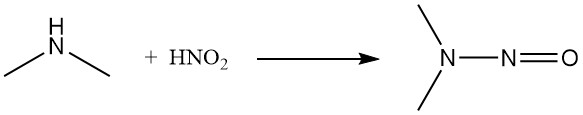
El óxido de etileno reacciona con la dimetilamina para dar dimetiletanolamina.

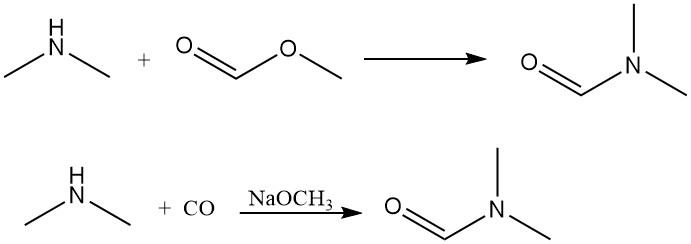
La dimetilamina reacciona con formiato de metilo para generar dimetilformamida, un disolvente aprótico dipolar. Esta reacción también se puede lograr de manera eficiente mediante la adición directa de monóxido de carbono con una base como catalizador.
La dimetilamina reacciona con dióxido de carbono para formar carbamatos de dimetilamina en condiciones anhidras y carbonatos de dimetilamina en presencia de agua.
La dimetilamina es corrosiva para el aluminio, el cobre, las aleaciones de cobre, el metal galvanizado, el magnesio, el zinc y las aleaciones de zinc. La dimetilamina anhidra y sus soluciones acuosas se pueden manipular utilizando materiales construidos de acero.
3. Producción de dimetilamina
Comercialmente, la dimetilamina se produce mediante la aminación de metanol con amoníaco. Este proceso ocurre en la fase de vapor (300–500 °C y 790–3550 kPa) sobre reactores de lecho fijo, produciendo una mezcla de mono, di y trimetilamina.

Método 1: Aminación de metanol catalizada por ácido (proceso Leonard)
Este método tradicional utiliza un catalizador ácido sólido, típicamente sílice-alúmina amorfa, para promover la conversión de metanol a alta temperatura. La reacción alcanza el equilibrio, favoreciendo la formación de trimetilamina en proporciones más bajas de amoníaco a metanol. Sin embargo, las demandas del mercado priorizan la dimetilamina, seguida de la metilamina y la trimetilamina.
Método 2: Aminación de metanol catalizada por ácido de forma selectiva
Este método aborda los desafíos de selectividad del Método 1 mediante el empleo de catalizadores de zeolita de forma selectiva (por ejemplo, mordenitas modificadas, RHO y chabazita). Estos catalizadores limitan la formación de moléculas voluminosas de trimetilamina dentro de sus poros, lo que da lugar a una mezcla de productos enriquecida en dimetilamina.
La aminación del metanol implica reacciones de sustitución secuenciales, transformando el metanol en aminas primarias, secundarias y terciarias. Además, se producen reacciones de desproporción, estableciendo un equilibrio entre los diferentes productos de metilamina.
El método 1 normalmente funciona con una alta conversión de metanol y se basa en reacciones rápidas de desproporción. Esto da como resultado una mezcla en equilibrio gobernada por la proporción de amoníaco a metanol. Para lograr la distribución deseada del producto, a menudo se recicla el exceso de metilamina y trimetilamina sin reaccionar, lo que consume mucha energía.
La llegada de los catalizadores de zeolita de forma selectiva ofreció una solución para optimizar la selectividad del producto. Debido a sus limitaciones en el tamaño de los poros, estos catalizadores restringen la formación y difusión de moléculas de trimetilamina, favoreciendo la producción de dimetilamina.
Ejemplos de procesos comerciales incluyen los siguientes:
- Proceso de rayón Mitsubishi: esta configuración de dos reactores utiliza un catalizador no selectivo para la desproporción inicial de trimetilamina, seguida de una zeolita de forma selectiva. lecho de catalizador para un mayor ajuste del producto.
- Proceso Químico Mitsui: Este proceso recicla continuamente la trimetilamina como mezcla azeotrópica con amoniaco, promoviendo su desproporción y posterior conversión a la dimetilamina deseada utilizando un catalizador de mordenita sililada de forma selectiva.
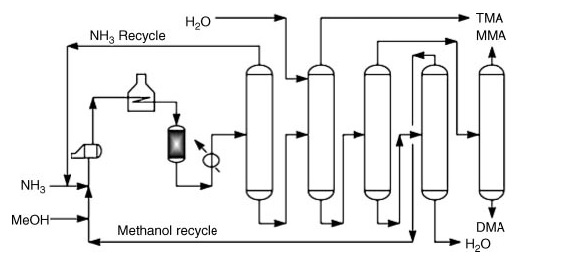
*MMA: metilamina; DMA: dimetilamina y TMA: trimetilamina
Después de las etapas de reacción, la recuperación del producto puro implica una serie de pasos de destilación:
- Separación y reciclaje de amoniaco.
- Recuperación de trimetilamina utilizando agua para mejorar la volatilidad.
- Separación de metilamina y dimetilamina de agua y metanol sin reaccionar.
- Recuperación individual de metilamina y dimetilamina purificadas.
- Separación del metanol sin reaccionar del agua.
4. Usos de la dimetilamina
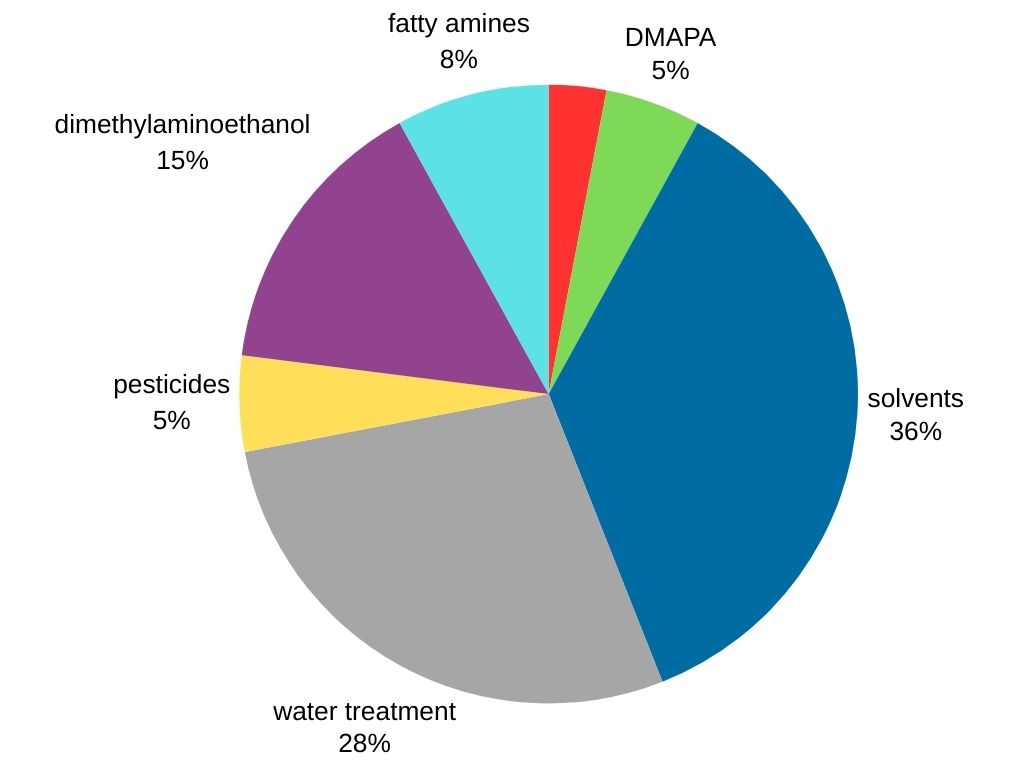
La dimetilamina destaca como la metilamina más demandada en el mercado global. Se utiliza en diversas industrias, entre ellas:
- Producción de solventes: la dimetilamina sirve como precursor crucial para la síntesis de solventes populares como la dimetilformamida (DMF) y la dimetilacetamida (DMAC).
- Tratamiento de agua.
- Tensioactivos: la dimetilamina se utiliza en la producción de 3-dimetilaminopropilamina (DMAPA), que es un tensioactivo intermedio.
- Procesamiento del caucho: la dimetilamina reacciona con disulfuro de carbono para producir ditiocarbamato de dimetilo, un componente crucial en la vulcanización del caucho, que fortalece y mejora las propiedades del caucho.
- Agroquímicos (pesticidas).
- Otros productos químicos (dimetilaminoetanol y aminas grasas).
5. Toxicología de la dimetilamina
La dimetilamina es un líquido o gas inflamable que presenta un importante riesgo de incendio.
Efectos de exposición aguda
- Irritantes y corrosivos para la piel y los ojos: el contacto puede provocar quemaduras e irritación graves.
- Irritante por inhalación: la respiración irrita la nariz, la garganta y los pulmones. Las concentraciones altas pueden causar acumulación de líquido en los pulmones (edema pulmonar), una emergencia médica.
Efectos de la exposición crónica
- Puede dañar el hígado si se expone repetidamente.
- Posible peligro para la reproducción (efectos en los testículos masculinos).
- Puede irritar los pulmones y provocar bronquitis con tos, flema y dificultad para respirar.
Según los datos actuales, la dimetilamina no está clasificada como carcinógeno.
Límites de exposición en el lugar de trabajo
- OSHA PEL (límite de exposición permitido): 10 ppm en promedio durante una jornada laboral de 8 horas.
- NIOSH REL (límite de exposición recomendado): 10 ppm en promedio durante una jornada laboral de 10 horas.
- ACGIH TLV (valor límite umbral): 5 ppm en promedio durante una jornada laboral de 8 horas, límite de exposición a corto plazo (STEL) de 15 ppm.
Medidas de precaución
- Controles de ingeniería: priorice las operaciones cerradas y utilice ventilación de escape local para minimizar la exposición al aire.
- Prácticas laborales: Mantenga buenas prácticas de higiene, evite el contacto con la piel y los ojos, y no coma, beba ni fume en áreas contaminadas.
- Equipo de protección personal: Cuando los controles de ingeniería sean insuficientes, utilice guantes, ropa, gafas o gafas de seguridad resistentes a productos químicos y respiradores adecuados, siguiendo protocolos establecidos.
Almacenamiento y manipulación
- Almacene en recipientes herméticamente cerrados en un área fresca y bien ventilada, lejos de fuentes de calor y productos químicos incompatibles (por ejemplo, agentes oxidantes, ácidos fuertes y mercurio).
- Contenedores metálicos rectificados y unidos durante las operaciones de transferencia.
- Utilice herramientas y equipos que no produzcan chispas, especialmente al manipular contenedores.
Referencias
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
- https://nj.gov/health/eoh/rtkweb/documents/fs/0737.pdf
