Dicloroacetaldehído

El dicloroacetaldehído [79-02-7], o 2,2-dicloroetanal, es un acetaldehído clorado con la fórmula química Cl2CHCHO. Es un líquido incoloro con un olor acre e irritante que fue producido por primera vez en 1868 por F. Paterno mediante la destilación de diclorodietil acetal, CHCl2CH(OC2H5)2, con ácido sulfúrico.
Tabla de contenido
1. Propiedades físicas del dicloroacetaldehído
El dicloroacetaldehído, también conocido como 2,2-dicloroetanal, es un líquido incoloro con un olor acre característico. Tiene varias propiedades físicas clave:
- Peso molecular: 112,94 g/mol
- Punto de fusión: -37,6 a -37,4 °C
- Punto de ebullición: 89,2 °C
- Densidad (25 °C): 1,4113 g/cm³
- Momento dipolar (30 °C): 2,36 D
- Solubilidad: miscible en agua, formando un hidrato y fácilmente soluble en disolventes orgánicos comunes.
El dicloroacetaldehído reacciona fácilmente con el agua para formar un monohidrato (CAS: 16086-14-9), conocido como 2,2-dicloro-1,1-etanodiol. Este sólido cristalino presenta distintas propiedades:
- Peso molecular: 130,96 g/mol
- Punto de fusión: 35–50 °C
- Punto de ebullición: 85–95 °C a 101,3 kPa
- Densidad (20 °C): 1,53–1,54 g/cm³
- Presión de vapor: 6,5 kPa a 20 °C, 25 kPa a 50 °C
- Solubilidad: soluble en disolventes orgánicos polares, insoluble en disolventes no polares.
- Punto de inflamación: Aproximadamente 95 °C
- Temperatura de ignición: Aproximadamente 605 °C
2. Reacciones químicas del dicloroacetaldehído
El dicloroacetaldehído se polimeriza espontáneamente durante el almacenamiento, formando un polímero sólido e incoloro. Este polímero vuelve a su forma monomérica al calentarlo a 120 °C.
El dicloroacetaldehído exhibe las reacciones características de los aldehídos, como oxidación, reducción y condensación.
La reacción de oxidación con ácido crómico produce ácido dicloroacético.
La reducción de dicloroacetaldehído con etilaluminio produce 2,2-dicloroetanol.

La autocondensación conduce a la formación de 2,2,4,4-tetracloroacetaldol.
La reacción de condensación de dicloroacetaldehído con etilbenceno da p,p’-dietil-1,1-difenil-2,2-dicloroetano, un insecticida conocido como pertano.

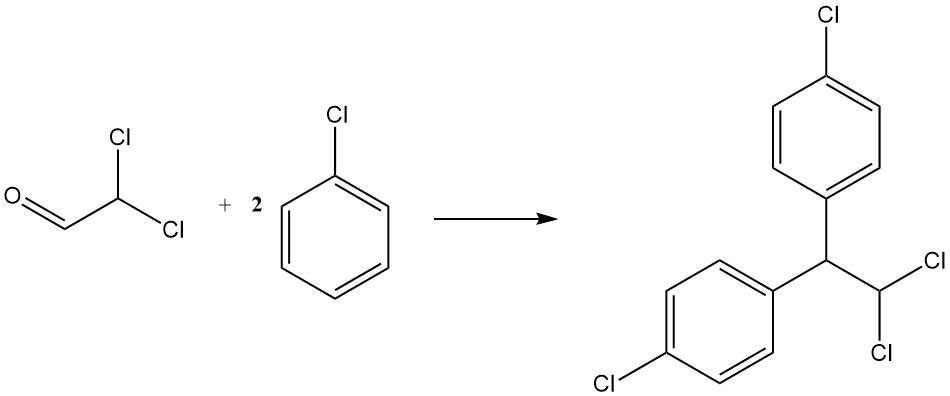
La condensación con clorobenceno produce p,p’-dicloro-1,1-difenil-2,2-dicloroetano, otro insecticida conocido como TDE o DDD. Está representado por la siguiente ecuación:
CHCl2CHO + 2 C6H5Cl → CHCl2CH(C6H4Cl)2 + H2O
3. Producción de dicloroacetaldehído
El proceso de producción industrial más importante del dicloroacetaldehído es la cloración del acetaldehído o paraldehído. Otro método para producir dicloroacetaldehído puro es la hipocloración de 1,2-dicloroetileno.
3.1. Cloración de Acetaldehído o Paraldehído
Este método genera dicloroacetaldehído junto con cloroacetaldehído y tricloroacetaldehído. Se pueden lograr altos rendimientos con catalizadores como el tricloruro de antimonio (83%) o el ácido fosfórico (>90%). La oxicloración durante el proceso Wacker para la producción de acetaldehído también puede producir dicloroacetaldehído como subproducto.
3.2. Hipocloración del 1,2-Dicloroetileno
Este proceso ofrece dicloroacetaldehído puro, libre de impurezas como cloral y monocloroacetaldehído. Consiste en tratar 1,2-dicloroetileno con un mol de cloro en condiciones específicas de temperatura y disolvente.
3.3. Cloración de etanol
La cloración controlada de etanol en presencia de cloruro de níquel (II) puede producir principalmente dicloroacetaldehído, junto con algo de cloral y monocloroacetaldehído. El hemiacetal resultante se puede utilizar directamente sin aislar dicloroacetaldehído puro o su hidrato.

4. Usos del dicloroacetaldehído
El dicloroacetaldehído y sus acetales se utilizan en la industria farmacéutica para la producción de triclorometiazida, un diurético utilizado para tratar enfermedades como la hipertensión arterial y edema y mitotano (1,1-dicloro-2-(o-clorofenil)-2-(p-clorofenil)etano), un agente citostático utilizado en el tratamiento de cánceres de glándula suprarrenal específicos.
También se utiliza en la producción de insecticidas como Perthane y TDE o DDD.
5. Toxicología del dicloroacetaldehído
El dicloroacetaldehído plantea una posible irritación respiratoria, aunque no existen datos formales de pruebas de toxicidad. Como medida de precaución, se debe manipular con cuidado.
6. Polímeros de dicloroacetaldehído
6.1. Hexacloroparaldehído
- Fórmula: C6H6Cl6O3
- Masa molar: 338,83 g/mol
- Apariencia: cristales incoloros
- Punto de fusión: 131-132 °C
- Punto de ebullición: 210–220 °C (descomposición)
El hexacloroparaldehído se produce por la reacción del dicloroacetaldehído con ácidos de Lewis como el tricloruro de antimonio, el cloruro de hierro (III) o el trifluoruro de boro o por cloración directa del paraldehído con 6–7 mol de cloro a 35 °C en condiciones anhidras.
Forma hidrato de dicloroacetaldehído en presencia de ácidos acuosos y se descompone en dicloroacetaldehído a temperaturas elevadas.
6.2. Polidicloroacetaldehídos
- Fórmula: (C2H2Cl2O)n
- Solubilidad: variable según el grado de polimerización, generalmente soluble en disolventes orgánicos comunes.
Las formas cristalinas de polidicloroacetaldehídos se producen tratando dicloroacetaldehído a -78 °C con compuestos organometálicos como trietilaluminio, y las formas amorfas se preparan utilizando ácidos de Lewis a temperaturas inferiores a 0 °C.
Estos polímeros son solubles en ácido sulfúrico concentrado a 100 °C con decoloración y en dimetilformamida. Pueden formar copolímeros con otros aldehídos.
Referencia
- Cloroacetaldehídos; Enciclopedia de química industrial de Ullmann. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
