Ciclohexanol: propiedades, reacciones, producción y usos
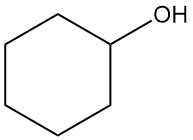
¿Qué es el ciclohexanol?
El ciclohexanol es un compuesto orgánico con la fórmula química C6H12O. Es un líquido o sólido cristalino incoloro y viscoso con un olor similar al del alcanfor, que es muy soluble en la mayoría de los disolventes orgánicos.
El ciclohexanol es un producto químico importante que se produce a gran escala comercial.
Tabla de contenido
1. Propiedades físicas del ciclohexanol
El ciclohexanol es una sustancia incolora que forma agujas cristalinas higroscópicas con un olor parecido al del alcanfor. En estado puro, se funde cerca de la temperatura ambiente a 25,15 °C.
El ciclohexanol es muy soluble en la mayoría de los disolventes orgánicos, como alcoholes, cetonas, éteres e hidrocarburos alicíclicos y aromáticos. Disuelve muchos aceites, ceras, gomas y resinas y forma azeótropos con agua y fenol.
Las propiedades físicas más importantes del ciclohexanol se muestran en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Número CAS | [108-93-0] |
| Fórmula química | C6H11OH |
| Masa molecular | 100,16 g/mol |
| Punto de fusión | 25,15 °C |
| Punto de ebullición | 161,1 °C |
| Presión de vapor | 0,15 kPa a 20 °C 0,48 kPa a 35 °C |
| Densidad | 0,9493 g/cm3 |
| Índice de refracción | 1,4656 |
| Coeficiente de expansión | 8,25 × 10-4 |
| Viscosidad dinámica | 41,07 mPa · s a 30 °C 17,20 mPa · s a 45 °C |
| Calor específico | 1,747 J/g |
| Tensión superficial a 30 °C | 33,47 mN/m |
| Calor de fusión | 1,791 kJ/mol |
| Calor de combustión | -3,722 MJ/mol |
| Calor de vaporización | 45,51 kJ/mol |
| Calor de formación | -352 kJ/mol |
| Punto de inflamación | 68 °C |
| Temperatura de autoignición | 300 °C |
| Solubilidad en agua a 20 °C | 3,6 g/100 g de agua |
2. Reacciones químicas del ciclohexanol
El ciclohexanol experimenta la mayoría de las reacciones típicas de los alcoholes secundarios. Forma ésteres con ácidos orgánicos y haluros de ciclohexilo con ácidos halogenados. Los ésteres comerciales más importantes del ciclohexanol son el ftalato de diciclohexilo, el adipato de diciclohexilo y el acrilato de ciclohexilo.
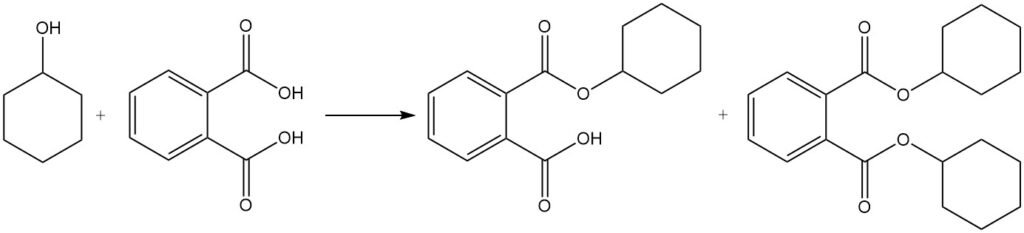
La reacción del ciclohexanol con ácido ftálico produce ftalatos de ciclohexilo y diciclohexilo, que se utilizan como plastificantes.
La deshidratación del ciclohexanol con ácido sulfúrico o el tratamiento en fase de vapor con alúmina a 300–400 °C produce ciclohexeno.
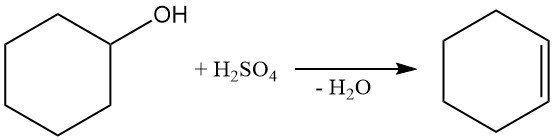
El ciclohexanol reacciona con bromuro de sodio y ácido sulfúrico para producir bromociclohexano con un rendimiento > 50%.
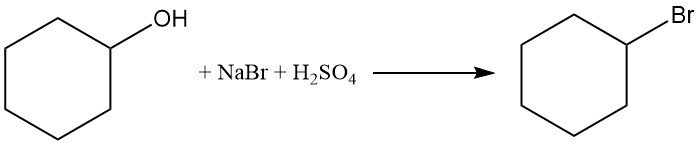
La oxidación suave o la deshidrogenación catalítica dan lugar a ciclohexanona, que puede oxidarse aún más hasta ácido adípico utilizando ácido nítrico a 75–80 °C y 1–4 bar. Esta reacción es importante a nivel industrial.
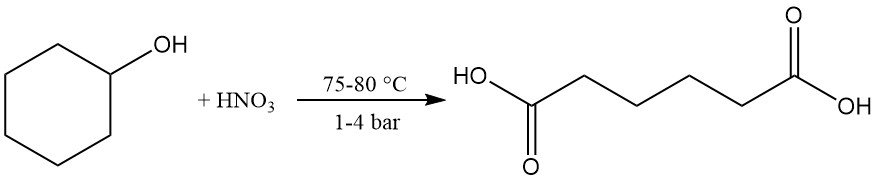
La reacción del ciclohexanol con amoniaco produce ciclohexilamina.
3. Producción industrial de ciclohexanol
El ciclohexanol se producía industrialmente mediante la hidrogenación del fenol, que también forma ciclohexanona. En la década de 1940, se desarrolló la oxidación del ciclohexano en fase líquida con aire catalizada por metales de transición para sintetizar una mezcla de ciclohexanol-ciclohexanona. La selección del catalizador influyó en la proporción del producto.
En la década de 1950, Scientific Design produjo ciclohexanol selectivamente mediante la oxidación del ciclohexano en fase líquida con aire modificado con ácido bórico, pasando por un hidroperóxido de ciclohexilo intermedio. Alrededor de 1990, Asahi produjo ciclohexanol a partir de ciclohexeno, que se obtiene a partir de la hidrogenación parcial del benceno.
3.1. Producción de ciclohexanol mediante hidrogenación de fenol
La elección de los catalizadores metálicos en la hidrogenación de fenol determina la distribución del producto, ya sea ciclohexanol, ciclohexanona o una mezcla de ambos.
El ciclohexanol se puede producir con altos rendimientos mediante la hidrogenación de fenol tanto en fase de vapor como en fase líquida.
El ciclohexanol se produce con un rendimiento del 98 % mediante la hidrogenación de fenol en fase de vapor utilizando catalizadores a base de níquel, a menudo soportados sobre alúmina o sílice.
En la Figura 1 se muestra un diagrama de flujo de la hidrogenación de fenol en fase de vapor.
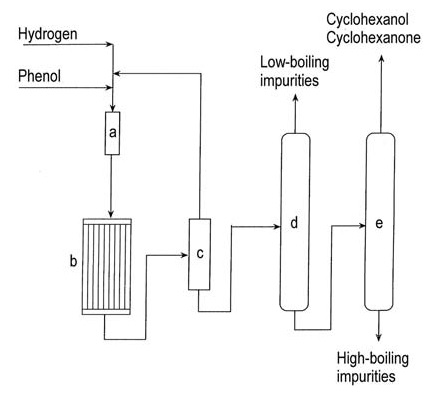
a) Evaporador de fenol; b) Reactor de hidrogenación; c) Condensador; d) Columna de eliminación de compuestos de bajo punto de ebullición; e) Columna de recuperación de ciclohexanol/ciclohexanona
La hidrogenación comercial en fase líquida de fenol en condiciones suaves con un catalizador de níquel Raney logra una selectividad del 99,9 % para el ciclohexanol.
3.2. Producción de ciclohexanol mediante oxidación en fase líquida de ciclohexano
La oxidación en aire en fase líquida de ciclohexano para formar ciclohexanol y ciclohexanona surgió en la década de 1940. Este proceso se lleva a cabo en reactores agitados a 140–180 °C y 0,8–2 MPa y utiliza catálisis de cobalto o condiciones no catalizadas.
El hidroperóxido de ciclohexilo es un intermediario que se forma durante la reacción y posteriormente se convierte en ciclohexanol y ciclohexanona.
La elección del catalizador influye en la relación ciclohexanol-ciclohexanona, y los catalizadores de cobalto producen una relación de ciclohexanol-ciclohexanona de 3,5. Se producen diversos compuestos oxigenados como subproductos.
El rendimiento de ciclohexanol se puede mejorar manteniendo altos niveles de hidroperóxido en el efluente del oxidante.
Los métodos y condiciones utilizados para descomponer los intermediarios de hidroperóxido influyen en la relación ciclohexanol-ciclohexanona obtenida. (ver Tabla 2)
| Solución/Modificación | Catalizador | Temperatura (°C) | Relación (ciclohexanol:ciclohexanona) |
|---|---|---|---|
| A | ninguno | 155 | 0,8 |
| A | Cr | 155 | 0,4 |
| A | Ni | 155 | 1,4 |
| A | V | 155 | 1,4 |
| A | Co | 155 | 3,0 |
| A | Mn | 155 | 3,3 |
| B | Co | 160 | 2,5 |
| A - hidrogenación de hidroperóxido de ciclohexilo | Pd | 150 | 5 - 10 |
| A - fase acuosa cáustica separada | Co | 120 | 0,2 |
* A = hidroperóxido de ciclohexilo en ciclohexano; B = hidroperóxido de ciclohexilo en colas de oxidante de aire.
3.3. Producción de ciclohexanol mediante oxidación de ciclohexano modificada con ácido bórico
En la década de 1950, Scientific Design modificó el proceso de oxidación del ciclohexano con aire añadiendo ácido metabórico anhidro al primer reactor de oxidación (Figura 2). El hidroperóxido de ciclohexilo queda atrapado como un éster de perborato de ciclohexilo y luego reacciona con el ciclohexano para formar éster de borato y ciclohexanol.
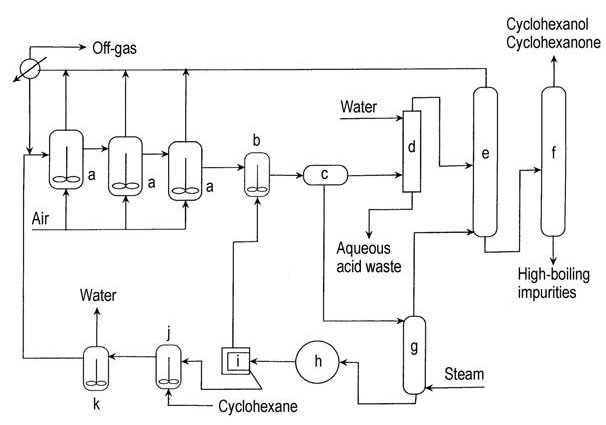
a) Oxidadores de aire; b) Recipiente de hidrólisis de ésteres; c) Decantador; d) Columna de extracción; e) Columna de recuperación de ciclohexano; f) Columna de refinación; g) Columna de desorción; h) Cristalizador de vacío; i) Centrífuga de ácido bórico; j) Tanque de suspensión de ácido bórico; k) Deshidratador
Este éster estable resiste la sobreoxidación y posteriormente se hidroliza a ciclohexanol y ácido bórico. El ácido bórico se deshidrata a ácido metabórico, que se recicla al oxidante de aire.
La química del proceso es similar a la oxidación catalizada por metales del ciclohexano, pero el anillo de ciclohexilo está protegido de la oxidación.
A pesar de los mayores costos de inversión y operación en comparación con otros métodos, el proceso del ácido bórico proporciona mayores rendimientos de ciclohexanol y ciclohexanona de hasta el 88%, con una alta selectividad del ciclohexanol del 91%. El Institut Francais du Petrole ha desarrollado aún más esta tecnología.
Los principales fabricantes actuales que utilizan este proceso son Solutia, DuPont (Reino Unido), Bayer y Mitsubishi. La planta original de Rhône-Poulenc basada en esta tecnología ahora está cerrada.
3.4. Producción de ciclohexanol mediante hidratación de ciclohexeno
En 1972 se patentó por primera vez la hidrogenación selectiva de benceno para formar ciclohexeno. Posteriormente, se patentaron la hidratación de ciclohexeno para formar ciclohexanol utilizando diversos catalizadores.
Asahi comercializó este proceso en 1990 con una planta de 100 t/a. El proceso consta de tres etapas: hidrogenación selectiva de benceno, separación de ciclohexeno del benceno y ciclohexano no convertidos, e hidratación de ciclohexeno (Figura 3).
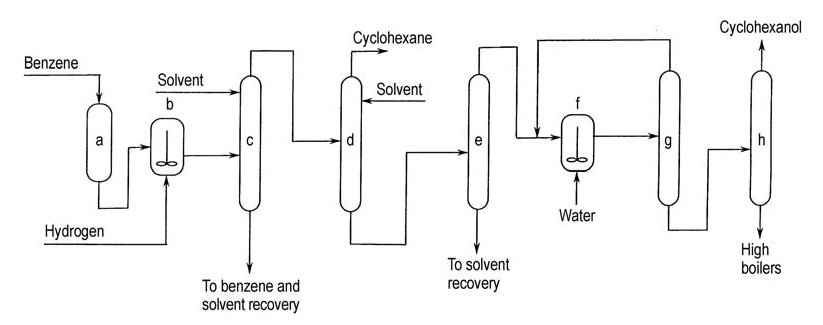
a) Purificación de benceno; b) Hidrogenación parcial; c) Separación de benceno no convertido de ciclohexeno y ciclohexano; d) Separación de ciclohexeno de ciclohexano; e) Separación de ciclohexeno de disolvente extractivo; f) Hidratación de ciclohexeno; g) Reciclado de ciclohexeno no convertido; h) Purificación de ciclohexanol
La hidrogenación del benceno utiliza un catalizador heterogéneo de níquel especializado y funciona a una conversión de aproximadamente el 50% para producir una mezcla de aproximadamente el 35% de ciclohexeno, el 15% de ciclohexano y el 50% de benceno sin convertir.
Las impurezas como el azufre y el hierro afectan significativamente la selectividad, por lo que es necesario utilizar benceno purificado y revestir el recipiente de hidrogenación con un material inerte.
La mezcla de ciclohexano-ciclohexeno-benceno se somete a dos destilaciones extractivas sucesivas. El ciclohexano recuperado se puede convertir nuevamente en benceno o venderse a otros productores de caprolactama y ácido adípico.
La hidratación del ciclohexeno a ciclohexanol también emplea un catalizador heterogéneo en un reactor de lodo. El equilibrio limita la conversión a aproximadamente el 14%.
El rendimiento de benceno a ciclohexanol es excepcionalmente alto, probablemente superando el 95%. Si bien los subproductos son mínimos, la inversión supera a las plantas convencionales de oxidación de ciclohexano.
4. Usos del ciclohexanol
El ciclohexanol se utiliza industrialmente en la producción de ácido adípico, principalmente, que se utiliza en la fabricación de nailon-6,6 y ciclohexanona, que es un precursor de la caprolactama.
En 1992, el mercado estadounidense de ciclohexanol (excluidos los intermediarios del nailon) alcanzó las 10.000 toneladas.
Las principales aplicaciones del ciclohexanol son:
- Como disolvente para lacas, barnices, aceites, resinas alquídicas, gomas, lacas, etilcelulosa, colorantes ácidos y resinas naturales.
- En la preparación de ésteres para plastificantes, por ejemplo, ftalato de diciclohexilo.
- En la industria de la lavandería y en jabones y detergentes sintéticos, como homogeneizador y estabilizador.
- En quitapinturas y barnices.
- En la producción de ciclohexilamina, que es un inhibidor de corrosión.
- En las industrias de insecticidas, fragancias, pulimentos y cemento de caucho.
- En la industria textil como disolvente de tintes y auxiliar de ebullición de kier.
5. Toxicología del ciclohexanol
El ciclohexanol presenta una baja toxicidad oral y una leve irritación cutánea. La exposición ocular induce una irritación grave y un daño corneal transitorio. La inhalación de altas concentraciones de vapor (aproximadamente 1000 ppm) en conejos produce irritación conjuntival y respiratoria, letargo, falta de coordinación, narcosis y convulsiones leves.
Los estudios de toxicidad reproductiva en ratones indican un aumento de la mortalidad de las crías tras el consumo materno de ciclohexanol durante la gestación. Se ha informado de atrofia testicular con pérdida de células espermatogénicas en ratas y jerbos tras la administración subcutánea repetida.
Se produjeron efectos similares en conejos tras la exposición oral. Sin embargo, un estudio no logró demostrar atrofia testicular en ratas a pesar de la administración oral de dosis altas.
La ACGIH ha establecido un TLV-TWA de 50 ppm (aproximadamente 200 mg/m³) con una notación cutánea.
La manipulación adecuada del ciclohexanol requiere una ventilación adecuada, evitar la exposición prolongada, prevenir la ingestión y proteger los ojos.
Referencias
- Cyclohexanol and Cyclohexanone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_217.pub2
- Cyclohexanol and Cyclohexanone. – https://onlinelibrary.wiley.com/doi/full/10.1002/0471238961.0325031206091908.a01
- https://onlinelibrary.wiley.com/doi/10.1002/0471743984.vse2329.pub2
- https://www.sciencedirect.com/science/article/abs/pii/B9780323851596501093
- https://onlinelibrary.wiley.com/doi/abs/10.1002/recl.19630820107
- https://onlinelibrary.wiley.com/doi/10.1002/0471740039.vec0746
- https://www.sciencedirect.com/science/article/abs/pii/S1460156705800200
- https://pubchem.ncbi.nlm.nih.gov/compound/Cyclohexanol
