Ácido etilendiaminotetraacético (EDTA): propiedades, producción y usos
¿Qué es el ácido etilendiaminotetraacético?
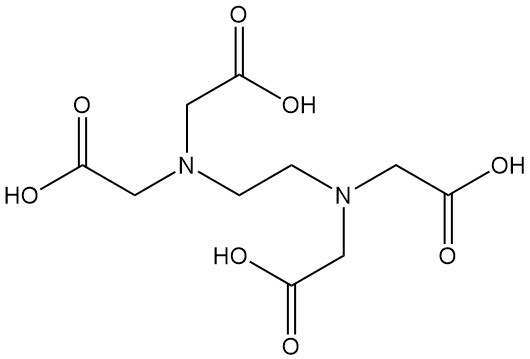
El ácido etilendiaminotetraacético, más conocido como EDTA, es un ácido aminopolicarboxílico con la fórmula C10H16N2O8. Es un sólido blanco insoluble en agua y es uno de los agentes quelantes más utilizados en diversas industrias.
El ácido etilendiaminotetraacético (EDTA), el ácido nitrilotriacético (NTA) y sus respectivas sales fueron sintetizados por primera vez en la década de 1930 por Ferdinand Munz en los laboratorios de I.G. Farbenindustrie. Desde entonces, han ganado una importancia significativa como agentes quelantes industriales.
Los ácidos aminopolicarboxílicos (como el EDTA), al igual que los aminoácidos, pueden formar sales con ácidos y bases fuertes. Además, poseen la capacidad de formar complejos fuertes solubles en agua con cationes divalentes y trivalentes. Estos complejos alteran significativamente la reactividad del ion metálico, lo que los convierte en compuestos valiosos en diversos procesos industriales.
La principal aplicación industrial del EDTA es prevenir o eliminar incrustaciones y depósitos insolubles que contienen calcio, bario, hierro y otros cationes.
Tabla de contenido
1. Propiedades físicas del ácido etilendiaminotetraacético (EDTA)
El ácido etilendiaminotetraacético es un sólido cristalino incoloro, ligeramente soluble en agua. En la siguiente tabla se enumeran las propiedades físicas importantes del EDTA.
| Propiedad | Valor |
|---|---|
| Número CAS | [60-00-4] |
| Fórmula química | C10H16N2O8 |
| Peso molecular | 292,24 g/mol |
| Punto de fusión | 245 °C (descomposición) |
| Densidad relativa | 0,86 g/cm3 |
| Solubilidad en agua a 20 °C | 0,1 g/L |
| pKa1 | 2 |
| pKa2 | 2,7 |
| pKa3 | 6,16 |
| pKa4 | 10,26 |
| Punto de inflamación | > 100 °C |
2. Propiedades químicas del ácido etilendiaminotetraacético
El EDTA forma complejos solubles en agua con cationes metálicos divalentes y trivalentes. Estos complejos presentan una estructura de anillo llamada quelato (del griego «chele», que significa garra), donde el ion metálico está fuertemente unido por el ligando disociado EDTA4-.
La fuerza de este complejo se cuantifica mediante la constante de estabilidad, que refleja las concentraciones de equilibrio del ion metálico (M) y del agente quelante (EDTA4-).
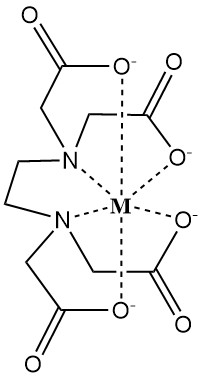
Los factores que afectan la fuerza de la quelación son el pH, los aniones que compiten y los aniones que precipitan.
Un pH más alto favorece la quelación, ya que aumenta la concentración de aniones quelantes completamente disociados (p. ej., EDTA4-), mejorando su capacidad de unión. Sin embargo, este efecto puede ser contrarrestado por iones hidroxilo (OH–) a un pH alto, que pueden alterar los quelatos metálicos si el metal forma hidróxidos insolubles (p. ej., precipitación de Fe3+ por encima de un pH de 5,5).
Los aniones como el carbonato, el fosfato y el oxalato pueden competir con el agente quelante, reduciendo la fuerza efectiva del complejo metal-agente quelante.
En general, los agentes quelantes como el EDTA forman complejos 1:1 con iones metálicos. Sin embargo, aumentar la concentración del agente quelante más allá de 1:1 puede mejorar aún más la estabilidad.
La conversión de cationes metálicos en complejos metálicos aniónicos altera su interacción con otras especies. Por ejemplo, el complejo [Fe(III)(EDTA)]– con carga negativa puede moverse más fácilmente a través del suelo en comparación con el catión Fe3+ absorbido.
La quelación reduce la concentración de iones metálicos libres (M) mediante la formación de complejos, lo que aumenta de manera efectiva el potencial de oxidación efectivo. Este principio es la base de varios procesos industriales importantes.
3. Producción de ácido etilendiaminotetraacético (EDTA)
El ácido etilendiaminotetraacético (EDTA) se produjo comercialmente mediante la reacción de etilendiamina, ácido cloroacético e hidróxido de sodio. Este proceso dio como resultado un producto contaminado con cloruro de sodio y se abandonó debido a los desafíos de purificación.
Se exploraron otros métodos, como la oxidación catalítica de materiales de partida específicos, pero nunca se adoptaron comercialmente.
En la actualidad, dos procesos principales dominan la producción de EDTA y de agentes quelantes relacionados, ambos implican la cianometilación de la poliamina original.
3.1. La cianometilación alcalina de la etilendiamina
La cianometilación alcalina de la etilendiamina es el proceso más utilizado para sintetizar ácido etilendiaminotetraacético.
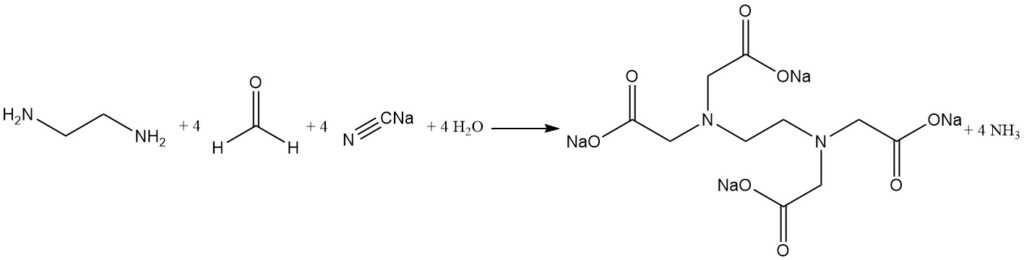
El cianuro de sodio y el formaldehído reaccionan con etilendiamina para producir EDTA con altos rendimientos (más del 90%). El amoníaco es el subproducto principal y se elimina continuamente durante la reacción. Sin embargo, pequeñas cantidades de amoníaco reaccionan para formar sales de subproductos no deseados como el ácido nitrilotriacético y la glicina.
Las sales de ácido glicólico también se pueden formar a partir de la reacción entre los materiales de partida. Estas impurezas tienen un impacto mínimo en la mayoría de las aplicaciones de agentes quelantes.
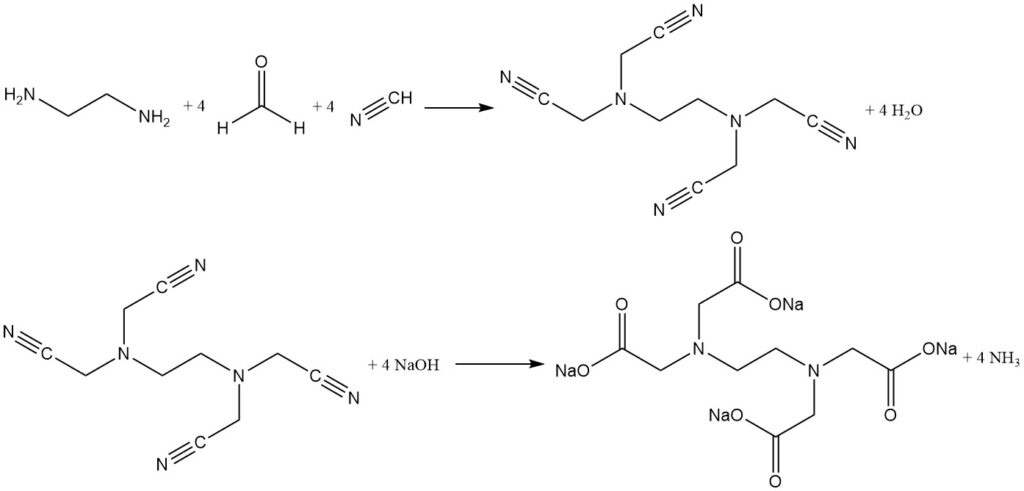
3.2. La síntesis de Singer en dos pasos
La síntesis de Singer en dos pasos separa el paso de cianometilación de la reacción de hidrólisis. Aquí, el cianuro de hidrógeno y el formaldehído reaccionan con etilendiamina para formar un producto intermedio de alto rendimiento (más del 96%), (etilendinitrilo)tetraacetonitrilo.
Este intermedio insoluble se aísla, se lava y luego se hidroliza con hidróxido de sodio para producir EDTA tetrasódico puro con amoníaco como subproducto. La separación de la reacción en dos pasos minimiza la formación de impurezas y produce un agente quelante altamente purificado.
Este enfoque de dos pasos también se utiliza para la producción eficiente de ácido nitrilotriacético puro utilizando amoníaco.
4. Usos del ácido etilendiaminotetraacético (EDTA)
Los agentes quelantes como el EDTA, con su capacidad única para unir e inactivar iones metálicos, encuentran aplicaciones en diversas industrias.
Los agentes quelantes de tipo EDTA evitan cambios de color no deseados en los tintes al formar complejos con contaminantes metálicos traza de fibras, productos químicos y agua.
El EDTA mejora el brillo de la pulpa de papel blanqueada con peróxido de hidrógeno o ditionito. Actúa como estabilizador y agente de control de iones metálicos durante las etapas de fabricación de pulpa y blanqueo.
El EDTA se utiliza para limpiar los depósitos de sarro de las calderas y evitar la formación de sarro de calcio y magnesio al formar complejos con estos iones metálicos. Sin embargo, es importante controlar la dosis adecuada para evitar que el exceso de agentes quelantes provoque corrosión.
A veces se utilizan polímeros junto con agentes quelantes para minimizar su potencial corrosivo.
El EDTA se puede utilizar para ayudar a limpiar superficies metálicas al disolver las películas de óxido adheridas, lo que permite un enjuague completo. Las soluciones de enchapado de metales a menudo agregan agentes quelantes como el EDTA para formar iones metálicos complejos, lo que da como resultado recubrimientos metálicos más suaves y uniformes.
Los detergentes para ropa, los limpiadores de superficies duras y los limpiadores de baño agregan EDTA, que mejora su poder de limpieza.
El EDTA altera la pared celular externa de ciertas bacterias, particularmente las bacterias gramnegativas, lo que aumenta la eficacia de los agentes desinfectantes. También actúa como potenciador de conservantes en cosméticos, champús y productos oftálmicos al aumentar su actividad bactericida.
El ácido etilendiaminotetraacético previene la rancidez oxidativa en emulsiones grasas como la mayonesa y los aderezos para ensaladas al formar complejos con iones metálicos que pueden acelerar el deterioro. Además, previene la decoloración causada por el hierro en alimentos como las papas.
La quelación con EDTA se usa comercialmente en la polimerización en emulsión de caucho de estireno-butadieno y el blanqueo de películas fotográficas. Los quelatos de hierro se emplean para controlar las emisiones industriales de sulfuro de hidrógeno y como absorbentes reversibles para óxidos de nitrógeno.
Los iones metálicos traza pueden interferir con los procesos químicos. Los agentes quelantes como el EDTA eliminan estos metales no deseados para garantizar la eficiencia del proceso y cumplir con las especificaciones del producto.
Los micronutrientes como el hierro, el zinc, el manganeso y el cobre se agregan a los fertilizantes en formas queladas. Esto evita que interactúen con los fosfatos y otros componentes del suelo que pueden causar precipitaciones y reducir su absorción por las plantas.
La quelación permite que estos micronutrientes se muevan más fácilmente a través del suelo hasta la zona de la raíz para la absorción de la planta.
El EDTA se usa ampliamente en métodos titrimétricos debido al cambio rápido en la concentración de iones metálicos libres en el punto de equivalencia. También se usa como agente enmascarador en algunos métodos espectrofotométricos para eliminar la interferencia de los iones metálicos.
El EDTA es el agente quelante dominante y representa casi la mitad del consumo total en Europa occidental (78.000 toneladas métricas en 2004). Los principales productores incluyen a Dow Chemical, BASF y AkZO.
5. Toxicología del EDTA
El EDTA y sus sales tienen una larga historia de uso seguro en diversas aplicaciones, incluidos aditivos alimentarios, productos farmacéuticos y cosméticos. Los primeros estudios toxicológicos sugieren una toxicidad relativamente baja.
Los estudios en ratas indican una dosis letal alta (LD50) para Na2EDTA (sal disódica), que varía de 2,0 a 2,2 gramos por kilogramo de peso corporal.
Los estudios que utilizaron Na2EDTA en una proporción del 0,5% al 5,0% en la dieta no mostraron efectos adversos significativos, excepto diarrea y reducción de la ingesta de alimentos en la dosis más alta. El EDTA trisódico no parece ser un sensibilizador de la piel.
Si bien el EDTA puede interactuar con el material genético, su relevancia para la genotoxicidad humana (causar daño genético) parece mínima. Los estudios sobre el Na3EDTA (sal trisódica) no han demostrado ninguna carcinogenicidad relacionada con el compuesto.
Referencia
- Ethylenediaminetetraacetic Acid and Related Chelating Agents; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a10_095.pub2
