o-Kresol: Eigenschaften, Reaktionen, Herstellung und Verwendung

Was ist o-Kresol?
o-Kresol, auch bekannt als 2-Methylphenol, ist eine organische Verbindung mit der chemischen Formel C7H8O. Es ist bei Raumtemperatur ein farbloser, kristalliner Feststoff mit phenolischem Geruch und ist in den meisten organischen Lösungsmitteln gut löslich.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von o-Kresol
Reines o-Kresol ist bei Raumtemperatur ein farbloser, kristalliner Feststoff; nach längerer Lagerung verfärbt es sich jedoch gelb bis braun. o-Kresol hat einen phenolischen Geruch und absorbiert Feuchtigkeit aus der Luft.
o-Kresol ist gut löslich in Phenol und vielen organischen Lösungsmitteln wie aliphatischen Alkoholen, Ethern, Chloroform und Glycerin und weniger gut wasserlöslich als Phenol.
o-Kresol lässt sich mit Wasserdampf destillieren und bildet Azeotrope mit einer Reihe von Verbindungen, z. B. Decan, 1-Decen, 1-Undecen, Dodecan, 1,2,4,5-Tetramethylbenzol, Divinylbenzol, Ethylenglykol, Diethylenglykolmethyl und Ethylether.
Wichtige physikalische Eigenschaften von o-Kresol sind in der folgenden Tabelle zusammengefasst:
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [95-48-7] |
| Chemische Formel | C7H8O |
| Molekulargewicht | 108,14 g/mol |
| Schmelzpunkt bei 101,3 kPa | 30,99 °C |
| Siedepunkt bei 101,3 kPa | 191,00 °C |
| Dichte bei 25 °C | 1,135 g/cm3 |
| Dichte bei 50 °C | 1,0222 g/cm3 |
| Viskosität bei 50 °C | 3,06 mPa·s |
| Brechungsindex bei 50 °C | 1,5310 |
| Dielektrizitätskonstante bei 50 °C | 6,00 |
| Spezifische Leitfähigkeit bei 50 °C | 0,43×10-10 S/cm |
| Oberflächenspannung bei 50 °C | 34,4×10-6 N/m |
| Dissoziationskonstante bei 25 °C | 4,8×10-11 |
| Kritische Temperatur | 424,4 °C |
| Kritischer Druck | 5,01 MPa |
| Kritische Dichte | 384 kg/m3 |
| Wärmekapazität cp bei 25 °C (Gas) | 127,3 J mol-1 K-1 |
| Wärmekapazität cp bei 25 °C (Feststoff) | 154,7 J mol-1 K-1 |
| Wärmekapazität cp bei 50 °C (Flüssigkeit) | 237,9 J mol-1 K-1 |
| Schmelzenthalpie ΔHm am Schmelzpunkt, 101,3 kPa | 15,830 kJ/mol |
| Sublimationsenthalpie ΔHsub bei 25 °C, 101,3 kPa | 76,07 kJ/mol |
| Verdampfungsenthalpie ΔHv am Siedepunkt, 101,3 kPa | 45,222 kJ/mol |
| Verbrennungsenthalpie ΔH°c bei 25 °C, 101,3 kPa | - 3696 kJ/mol |
| Bildungsenthalpie ΔH°f bei 25 °C, 101,3 kPa | - 204,8 kJ/mol |
| ΔH°f bei 25 °C (Gas), 101,3 kPa | - 128,7 kJ/mol |
| Freie Bildungsenergie ΔG°f bei 25 °C, 101,3 kPa | - 55,7 kJ/mol |
| ΔG°f bei 25 °C (Gas) und 101,3 kPa | - 33,0 kJ/mol |
| Entropie S bei 25 °C und 101,3 kPa | 165,5 J mol-1 K-1 |
| Entropie S° bei 25 °C (Gas) und 101,3 kPa | 352,8 J mol-1 K-1 |
| Wasserlöslichkeit bei 25 °C | 2,6 Gew.-% |
| Wasserlöslichkeit bei 100 °C | 4,8 Gew.-% |
| Verteilungskoeffizient log P Octanol/Wasser bei 25 °C | 1,95 |
| Dampfdichte (Luft = 1) | 3,72 |
| Flammpunkt (geschlossener Tiegel) | 81 °C |
| Zündtemperatur | 555 °C |
| Entzündbarkeitsgrenze, untere, in Luft bei 20 °C, 101,3 kPa | 1,3 Vol.-% |
2. Chemische Reaktionen von o-Kresol
o-Kresol ähnelt chemisch Phenol. Es ist eine schwache Säure und löst sich in wässriger Lauge zu wasserstabilen Salzen, den sogenannten o-Kresolaten. Daher können diese aus nicht wassermischbaren Lösungsmitteln in Natronlauge extrahiert werden.
Die Hydroxygruppe von o-Kresol kann mit Alkylhalogeniden, Dialkylsulfaten, Dialkylcarbonaten und Toluolsulfonsäureestern verethert werden und mit Acylanhydriden oder Acylchloriden zu den entsprechenden Tolylestern reagieren, die üblicherweise als „o-Kresylester“ bezeichnet werden.
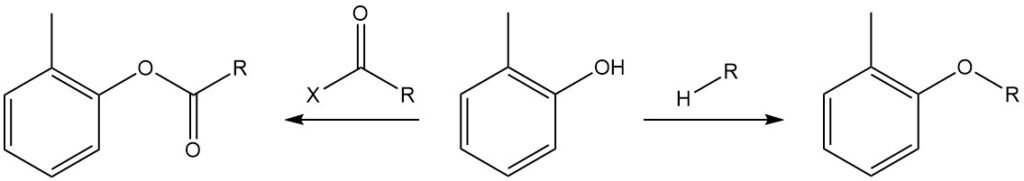
Die OH-Gruppe des o-Kresols reagiert mit Isocyanaten zu Urethanen.
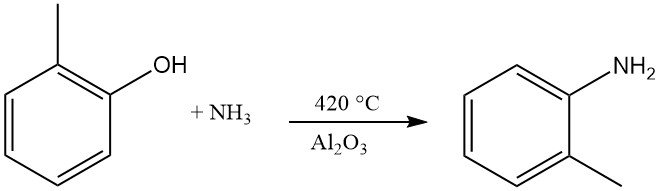
o-Toluidin entsteht durch die Reaktion von o-Kresol mit Ammoniak bei 420 °C und in Gegenwart von Al2O3.
Durch den Austausch der Hydroxygruppe von o-Kresol können verschiedene 2-Halogentoluole erhalten werden. Beispiele hierfür sind die Reaktion mit Schwefeloxytetrafluorid bei 150 °C, mit Diphenylphosphintrichlorid bei 220 °C oder mit Phosphortribromid bei 280 °C zur Bildung des entsprechenden 2-Fluor-, 2-Chlor- bzw. 2-Bromtoluols.
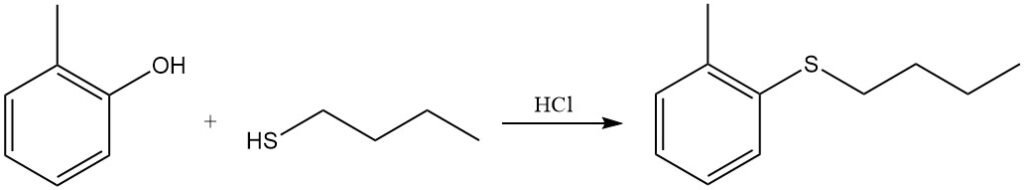
Die phenolische OH-Gruppe von o-Kresol kann durch Reaktion mit Butanthiol in Salzsäure durch eine Thiobutylgruppe ersetzt werden.
Toluol wird durch Destillation von Kresol mit Zinkpulver hergestellt und kann auch durch Hydrierung in der Dampfphase bei 300–400 °C unter Druck (bis zu 8 MPa) in Gegenwart von Katalysatoren (Übergangsmetalle und Aluminiumoxid) gebildet werden.
Die Hydrodealkylierung von o-Kresol zu Phenol kann mit Katalysatoren bei 400–500 °C oder rein thermisch bei 500–700 °C erfolgen.
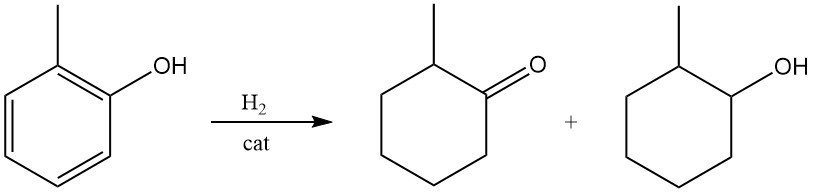
2-Methylcyclohexanon oder 2-Methylcyclohexanol kann unter milden Bedingungen durch Hydrierung von o-Kresol an Raney-Nickel oder Edelmetallkatalysatoren gebildet werden.
o-Kresol ist oxidationsempfindlich und führt je nach Oxidationsmittel und Reaktionsbedingungen zu einer Vielzahl von Verbindungen wie Hydrochinonen, Chinolen, Chinonen, cyclischen Ketonen, Furanen, dimeren und trimeren Kresolen sowie Tolylethern.
Ist die Hydroxygruppe des o-Kresols durch Veresterung oder Veretherung geschützt, kann die Methylgruppe selektiv mono-, di- oder trichloriert oder mit saurer Permanganatlösung selektiv zu einer Formylgruppe (z. B. mit Mangandioxid oder Sauerstoff) oder zu einer Carboxylgruppe (Salicylsäure) oxidiert werden.
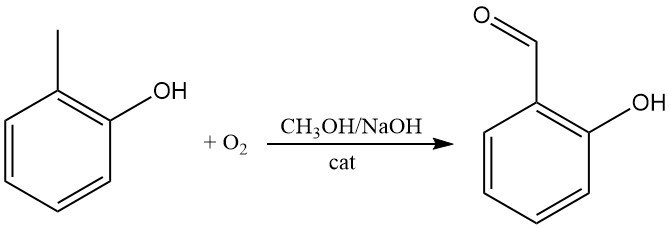
O-Kresol kann direkt mit Sauerstoff zu 2-Hydroxybenzaldehyd oxidiert werden, z. B. in methanolischer Natronlauge in Gegenwart katalytischer Mengen von Eisentetraarylporphinen.
Die alkalische Schmelze von o-Kresol in Gegenwart von Bleioxid oder Mangandioxid erzeugt direkt 2-Hydroxybenzoesäure.
Ähnlich wie Phenol unterliegt o-Kresol leicht elektrophilen Substitutionen, hauptsächlich in den o- und p-Positionen zur Hydroxygruppe. Daher kann es auch mit verdünnter Salpetersäure nitriert werden.
Nitrosierung, Halogenierung, Sulfonierung, Alkylierung und Acylierung erfolgen leicht. Beim Erhitzen von o-Kresol mit Friedel-Crafts-Katalysatoren wie AlCl3 isomerisiert es zu m-Kresol, dem thermodynamisch stabilsten Isomer.
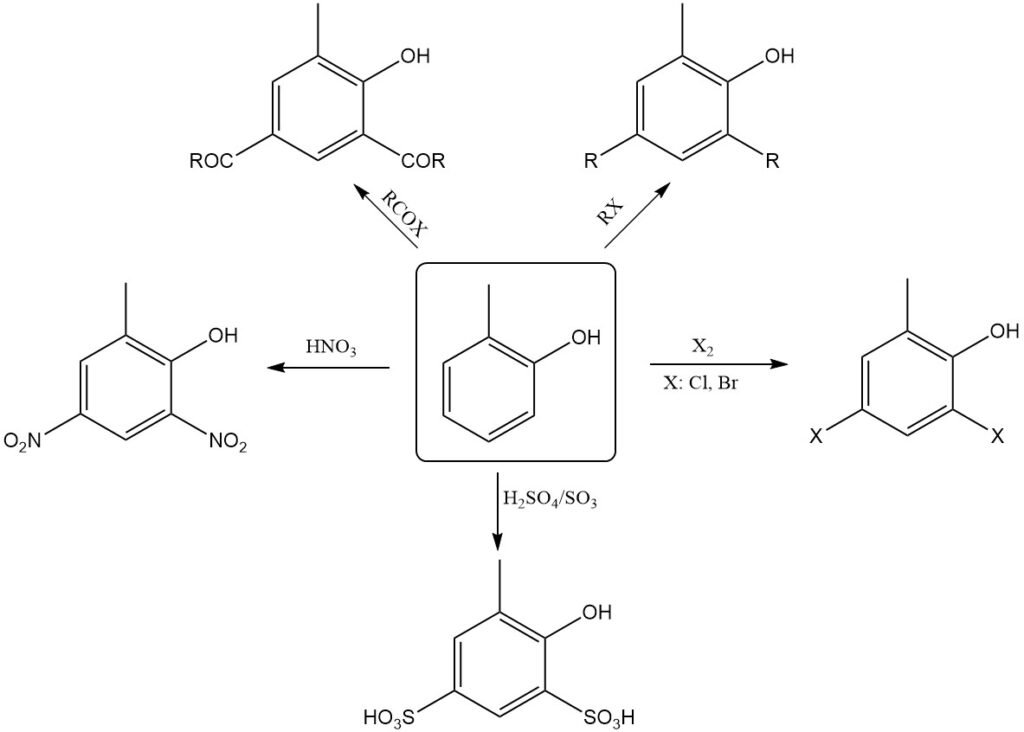
Das Erhitzen trockener Alkalimetall-o-Kresolate mit CO2 unter Druck erzeugt Hydroxy(methyl)benzoesäuren (Kolbe-Schmitt-Reaktion).
Die Reaktion von Formaldehyd mit o-Kresol in Gegenwart von Alkali bei Raumtemperatur erzeugt Hydroxy(methyl)benzylalkohole, die unter sauren Bedingungen oder bei erhöhten Temperaturen zu hochmolekularen Harzen kondensieren.
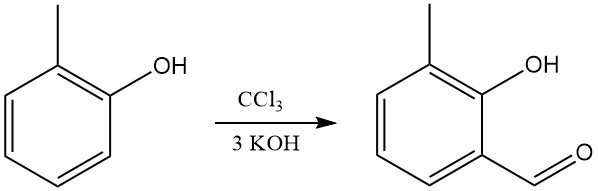
o-Kresol reagiert mit Chloroform und Alkali hauptsächlich zu o-Hydroxy(methyl)benzaldehyden (Reimer-Tiemann-Synthese).
o-Kresol zeigt aggressive korrosive Eigenschaften gegenüber verschiedenen Metallen, insbesondere bei erhöhten Temperaturen. Das Ausmaß der Korrosion wird durch den Wassergehalt der Kresollösung beeinflusst.
Chrom-Nickel-Edelstähle und Chromstähle bieten nur eine begrenzte Korrosionsbeständigkeit gegenüber o-Kresol. Nickel weist eine überlegene Korrosionsbeständigkeit auf, während Tantal als vollständig korrosionsbeständig gilt.
Aluminium und seine Legierungen sind anfällig für starke Korrosion, insbesondere bei niedrigem Wassergehalt. Kupfer- und Messinglegierungen sollten aufgrund ihrer Korrosionsanfälligkeit vermieden werden.
3. Bildung und Isolierung von Kresol
Kresole (ein Gemisch aus Ortho-, Meta- und Para-Isomeren) wurden früher ausschließlich aus Steinkohlenteer gewonnen. Nach dem Zweiten Weltkrieg kamen Altlaugen aus Raffinerien als zusätzliche Quelle hinzu. Seit Mitte der 1960er Jahre nimmt die synthetische Kresolproduktion deutlich zu.
Derzeit deckt synthetisches Kresol etwa 60 % des Bedarfs in den USA, Europa und Japan. Natürliches Kresol, das aus Kohlenteer und verbrauchten Raffinerielaugen gewonnen wird, macht nur etwa 40 % aus.
Eine Mischung aus Kresolen, Xylenolen und einer Vielzahl anderer phenolischer Verbindungen findet sich im Abwasser von Crackprozessen, in Teeren und teerähnlichen Produkten, die beim thermischen, oxidierenden und hydrierenden thermischen Cracken von natürlichen Materialien wie Steinkohle, Braunkohle, Ölschiefer, Torf, Holz, Lignin und anderen Biomaterialien entstehen.
Die Ausbeute und die relativen Mengen an produzierten Kresolen, Xylenolen und anderen Phenolen hängen nicht nur vom Ausgangsmaterial, sondern auch von den Prozessbedingungen wie Temperatur, Verweilzeit, Reaktortyp und Betriebsart ab.
Bei Steinkohle liefert die Hydrierung die höchsten Mengen, gefolgt von der Niedertemperaturverkokung, während die Hochtemperaturverkokung die niedrigsten Ausbeuten liefert. Bei der Vergasung von Braunkohle entstehen im Vergleich zu Steinkohle deutlich mehr Phenole, Kresole und Xylenole.
Geringe Mengen an Kresolen, Xylenolen und anderen Phenolderivaten entstehen auch beim katalytischen und thermischen Cracken von Erdölfraktionen, insbesondere beim thermischen Cracken durch Verkokung.
Derzeit werden Kresole und Xylenole hauptsächlich aus Kohlenteeren isoliert, die durch Hochtemperaturverkokung, Niedertemperaturverkokung, Lurgi-Druckvergasung von Kohle und verbrauchte Raffinerielaugen gewonnen werden.
3.1. Isolierung von Kresol aus Kohlenteeren

Steinkohlenteer war historisch eine bedeutende Quelle für Kresole und Xylenole. Seine Produktion ist jedoch in den letzten vier Jahrzehnten stetig zurückgegangen; die geschätzte Jahresproduktion liegt bei 30.000 bis 40.000 Tonnen.
Hochtemperatur-Koksofenteer, ein Nebenprodukt der metallurgischen Koksproduktion, enthält etwa 0,4–0,6 % Phenol, 0,8–1 % Kresole und 0,2–0,5 % Xylenole.
Im Vereinigten Königreich wurden Kresole auch aus Niedertemperatur-Steinkohlenteeren hergestellt, die bei der Herstellung rauchfreier Brennstoffe anfielen. Die Verfügbarkeit dieser Teere nahm jedoch bis in die 1990er Jahre deutlich ab.
Die größte Quelle für „natürliche“ Kresole sind derzeit die flüssigen Nebenprodukte der Vergasung von Steinkohle im Lurgi-Verfahren. Dieses Verfahren wird hauptsächlich in Südafrika zur Herstellung von Synthesegas für Fischer-Tropsch-Anlagen eingesetzt.
Die flüssigen Nebenprodukte dieses Prozesses, deren Zusammensetzung Tieftemperaturteeren ähnelt, liefern jährlich schätzungsweise 35.000 bis 55.000 Tonnen Kresole und Xylenole.
In den USA sind die flüssigen Nebenprodukte der Lurgi-Vergaser der Dakota Gasification Company, die Braunkohle zur Herstellung von synthetischem Erdgas vergast, eine bedeutende Quelle für natürliche Kresole. Die geschätzte Jahresproduktion aus dieser Quelle beträgt etwa 5.000 Tonnen o-Kresol und 11.000 Tonnen m/p-Kresol.
Zur Isolierung von Kresolen und Xylenolen aus Kohlenteer wird üblicherweise die Extraktion mit Natronlauge eingesetzt. Im Lurgi-Phenoraffin-Verfahren werden Karbolöl (Siedepunkt 180–210 °C) und das Filtrat des Naphthalinöls extrahiert, um die Phenole zu gewinnen.
Die in der Rohphenolatlauge enthaltenen Kohlenwasserstoffe und Pyridinbasen werden durch Wasserdampfdestillation entfernt, gefolgt von der Freisetzung des Rohphenols mit Kohlendioxid.
Phenolatlaugen aus Kokereiabwässern, die hauptsächlich Phenol und Kresol sowie geringe Mengen an Xylenolen enthalten, werden häufig in den Extraktionsprozess einbezogen. Dies kann zu einer stark variierenden Zusammensetzung des resultierenden Rohphenols führen.
Beispielsweise kann Rohphenol aus deutschem Hochtemperatur-Koksofenkohlenteer 15 % Wasser, 30 % Phenol, 12 % o-Kresol, 18 % m-Kresol, 12 % p-Kresol, 8 % Xylenole und 5 % Trimethylphenole sowie höhersiedende Phenole enthalten.
Um die Kresolsäurefraktionen weiter von Neutralölen, Teerbasen, Schwefelverbindungen und unerwünschten Phenolen zu reinigen, wurde von der Dakota Gasification Co. eine extraktive Destillation mit Diethylenglykol entwickelt.
Unternehmen wie Sasol Phenolics, Merichem Co., Coalite Chemicals, Rütgers-VfT AG, DEZA Corporation und mehrere japanische Unternehmen nutzen dieses Verfahren zur Isolierung von Kresolen und Xylenolen aus Kohlenteer.
3.2. Rückgewinnung von Kresol aus verbrauchten Raffinerie-Ätzmitteln
In den USA werden Kresole und Xylenole aus Naphtha-Fraktionen gewonnen, die beim katalytischen und thermischen Cracken in der Erdölindustrie entstehen. Diese Fraktionen enthalten etwa 0,1 % C6-C8-Phenole. Beim Waschprozess zur Entfernung von Schwefelverbindungen aus diesen Fraktionen werden Kresole und Xylenole ebenfalls mit konzentrierten alkalischen Lösungen extrahiert.
Die aus diesem Prozess gewonnenen verbrauchten Kresylat-Ätzlaugen variieren stark in ihrer Zusammensetzung und enthalten typischerweise 20–25 % C6-C8-Phenole und 10–15 % Schwefelverbindungen.
Bis Anfang der 1990er Jahre wurden diese Ätzlaugen von spezialisierten Unternehmen gesammelt und wiederaufbereitet. Aufgrund der zunehmenden Konkurrenz durch Hersteller synthetischer o-Kresole, strengerer Umweltvorschriften und Rohstoffknappheit haben jedoch viele dieser Unternehmen ihren Betrieb eingestellt.
Merichem ist derzeit der einzige große Verarbeiter verbrauchter Raffinerie-Ätzlaugen in den USA.
Bei Northwest Petrochemical, einem ehemaligen Verarbeiter, wurden Thiole in der alkalischen Lösung mit Luft zu Disulfiden oxidiert, die anschließend dekantiert wurden. Die verbleibenden Phenole wurden mit Kohlendioxid ausgefällt und dekantiert. Verbleibende Phenole wurden mit einem organischen Lösungsmittel extrahiert und anschließend mit einer wässrigen alkalischen Phase erneut extrahiert.
Dieses Verfahren ergab ein Phenolgemisch mit etwa 20 % Phenol, 18 % o-Kresol, 22 % m-Kresol, 9 % p-Kresol, 28 % Xylenol und 3 % höheren Phenolen. Dieses Gemisch wurde anschließend destillativ getrennt.
The Merichem Company verwendet Schwefelwasserstoff, ein Abfallprodukt von Raffinerien, anstelle von Kohlendioxid zur Ausfällung von Phenolen. Die gewonnene Sulfidlösung wird konzentriert, um Natriumsulfid für die Papierindustrie und die Erzaufbereitung herzustellen.
Das dabei entstehende Wasserdampfkondensat wird mit Erdgas gestrippt, um Geruchsstoffe zu entfernen, und anschließend durch einen Kühlturm geleitet. Das Erdgas dient als Brennstoff in der abschließenden Prozessluftverbrennungsanlage.
Das Wasser der Anlage wird in einem integrierten System recycelt, wobei der Großteil des Wassers als Wasserdampf aus den Kühltürmen in die Umwelt abgegeben wird.
Die Pittsburgh Consolidated Chemical Company nutzte zuvor ein Verfahren, bei dem verbrauchte Raffinerielaugen direkt mit kohlendioxidhaltigem Rauchgas behandelt wurden. Das ausgefällte Rohphenol wurde anschließend destilliert und mit wässrigem Methanol-Leichtbenzin extrahiert.
Nach der Entfernung von Thiol- und Basenrückständen mit einem Ionenaustauscherharz wurden die Kresylsäuren durch fraktionierte Destillation zurückgewonnen.
Die Kresolkapazität von Merichem lag 1996 bei rund 55.000 Tonnen pro Jahr. Diese Zahl umfasst jedoch auch Phenol, Xylenole und andere Alkylphenole. Merichem hat seine Aktivitäten um die Verarbeitung von Kresolen aus verschiedenen Quellen, einschließlich Kohlevergasungsanlagen, erweitert.
Die Rückgewinnung von Kresolen und Xylenolen aus Altlaugen aus der Raffinerie beschränkte sich bislang hauptsächlich auf die USA. In Deutschland sind verschiedene Raffinerieverfahren und die Produktion kresolhaltiger Altlaugen möglicherweise nicht für eine wirtschaftliche Wiederaufbereitung geeignet. Zudem hat die Umstellung auf Hydrotreating und das Merox-Verfahren in Raffinerien die Produktion von Altlaugen und die Rückgewinnung von Kresolen reduziert.
4. Industrielle Produktion von o-Kresol
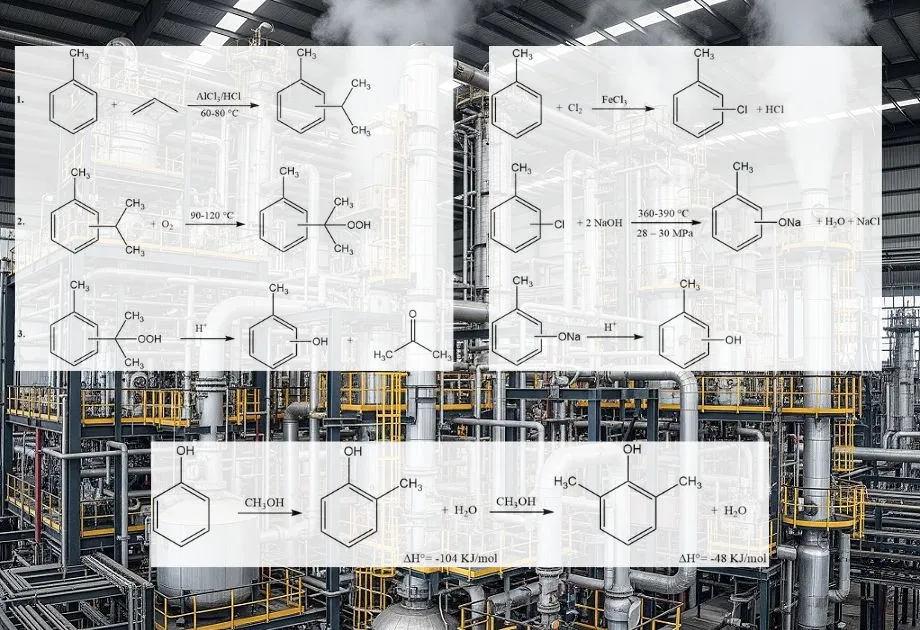
Orthokresol (o-Kresol) wird hauptsächlich synthetisch hergestellt, da die traditionelle Rückgewinnung aus Kohlenteer und Raffinerielaugen den weltweiten Bedarf nicht deckt. Diese Verfahren ergeben ein Gemisch von Kresol-Isomeren. Aus diesen Gemischen kann nur o-Kresol durch Destillation als reines Produkt abgetrennt werden.
Es gibt verschiedene industrielle Verfahren, die oft von Toluol oder Phenol ausgehen:
- Dampfphasenmethylierung von Phenol: Dies ist ein weit verbreitetes industrielles Verfahren. Phenol reagiert mit Methanol in der Gasphase an einem festen Säurekatalysator wie Aluminiumoxid, Magnesiumoxid oder Galliumoxid. Die Reaktion findet typischerweise bei erhöhten Temperaturen (z. B. 200–400 °C) statt. Dieses Verfahren liefert selektiv o-Kresol und 2,6-Xylenol.
- Alkalische Chlortoluolhydrolyse: Bei dieser Methode wird 2-Chlortoluol in alkalischem Medium hydrolysiert. Das Chloratom wird durch eine Hydroxygruppe ersetzt, wodurch o-Kresol entsteht. Dabei kann ein Gemisch von Kresol-Isomeren entstehen, wobei die Verhältnisse je nach den spezifischen Bedingungen und den verwendeten Katalysatoren variieren.
- Alkalische Fusion von Toluolsulfonaten: Dieses Verfahren verwendet Toluol als Ausgangsstoff, das zunächst zu Toluolsulfonsäure sulfoniert wird. Das Natriumsalz der Toluolsulfonsäure wird anschließend durch Alkalischmelzen (Reaktion mit geschmolzenem Natriumhydroxid) zu Natriumkresoloxid umgesetzt, das anschließend zu Kresol angesäuert wird.
- Spaltung von Cymolhydroperoxid: Dieser Prozess, ebenfalls ausgehend von Toluol, beinhaltet die Bildung von Cymol (Isopropyltoluol), das anschließend zu Cymolhydroperoxid oxidiert wird. Die anschließende säurekatalysierte Zersetzung (Spaltung) von Cymolhydroperoxid führt zu Kresol und Aceton.
Einen umfassenden und detaillierten Artikel zur Kresolproduktion finden Sie im folgenden Artikel.
5. Verwendung von o-Kresol
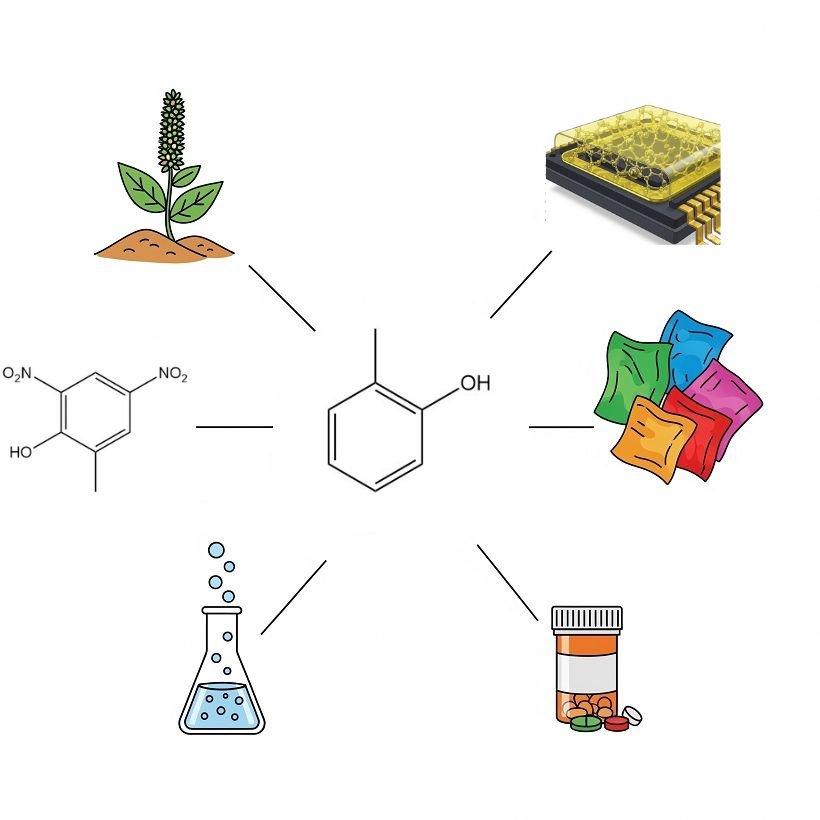
o-Kresol dient als vielseitiges chemisches Zwischenprodukt und Lösungsmittel in verschiedenen Industrien.
Eine Hauptanwendung in Europa ist die Chlorierung zu 4-Chlor-o-kresol, das als Vorstufe für Chlorphenoxyalkansäuren wie 4-Chlor-2-methylphenoxyessigsäure, 2-(4-Chlor-2-methylphenoxy)-propionsäure und γ-(4-Chlor-2-methylphenoxy)buttersäure dient, die alle als selektive Herbizide bekannt sind.
Eine geringere Menge o-Kresol wird nitriert, wodurch 4,6-Dinitro-o-kresol entsteht. Dieses Derivat weist sowohl herbizide als auch insektizide Eigenschaften auf. Es wird außerdem als Polymerisationsinhibitor bei der Herstellung und Destillation von Styrol eingesetzt.
Hochreines o-Kresol wird zunehmend, insbesondere in Japan, zur Herstellung von Epoxid-o-Kresol-Novolak-Harzen (ECN-Harze) eingesetzt. Diese Harze werden als Dichtungsmaterialien für integrierte Schaltkreise verwendet. o-Kresol in Standardqualität wird zur Modifizierung konventioneller Phenol-Formaldehyd-Harze eingesetzt.
o-Kresol ist zudem eine wichtige Vorstufe für verschiedene Farbstoffzwischenprodukte. Mengenmäßig am bedeutendsten ist die durch die Kolbe-Reaktion synthetisierte o-Kresotinsäure (o-Hydroxymethylbenzoesäure). Diese Säure wird anschließend in der Pharmaproduktion verwendet, während ihre Methylester als Färbehilfsmittel dienen.
Eine beträchtliche Menge o-Kresol wird entweder direkt oder nach Hydrierung zu 2-Methylcyclohexanol oder 2-Methylcyclohexanon als Lösungsmittel verwendet. Seine Carbonatesterform dient als Ausgangsstoff in der Cumarinsynthese.
Die Alkylierung von o-Kresol mit Propen erzeugt Carvacrol (3-Isopropyl-6-methylphenol), das als Antiseptikum und in Duftstoffen eingesetzt wird.
Geringe Mengen o-Kresol werden mit Isobuten alkyliert und dienen als Ausgangsstoff für verschiedene Antioxidantien, Komponenten für thermische Aufzeichnungsmaterialien und Pharmazeutika wie das Muskelrelaxans Mephenesin.
Referenzen
- Cresols and Xylenols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a08_025
- Cresols; Encyclopedia of Toxicology, Volume 1. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543002967
