Nitrilotriessigsäure: Eigenschaften, Herstellung, Verwendung und Toxikologie
Was ist Nitrilotriessigsäure?
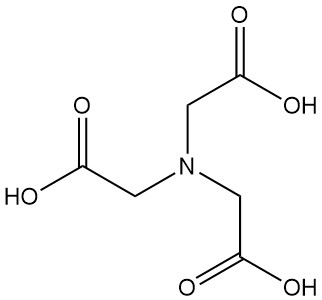
Nitrilotriessigsäure, auch bekannt als NTA oder N,N-Bis(carboxymethyl)glycin, ist eine Tricarbonsäure mit der Formel C6H9NO6. Es ist ein farbloser Feststoff, der zur Familie der Aminopolycarbonsäuren gehört und neben EDTA einer der wichtigsten Chelatbildner ist.
Sie wurde erstmals 1861 von Heintz durch die Reaktion von Ammoniak mit Chloressigsäure synthetisiert. Die großindustrielle Produktion begann 1936 in Ludwigshafen. Seitdem hat sich Nitrilotriessigsäure als Chelatbildner etabliert, der in verschiedenen industriellen Prozessen verwendet wird.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Nitrilotriessigsäure
Nitrilotriessigsäure ist eine Trisäure, die farblose, nadelartige Kristalle bildet, wenn sie aus einer wässrigen Lösung kristallisiert. Sie ist in Wasser und den meisten organischen Lösungsmitteln unlöslich; Alkalimetall-Nitrilotriacetate sind jedoch sehr gut wasserlöslich. Trinatriumnitrilotriacetat löst sich beispielsweise bis zu 640 g/l in Wasser.
Die wichtigsten physikalischen Eigenschaften von Nitrilotriessigsäure sind in der folgenden Tabelle aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [139-13-9] |
| Chemische Formel | C6H9NO6 |
| Molekularmasse | 191,14 g/mol |
| Schmelzpunkt | 242 °C (Zersetzung) |
| Wasserlöslichkeit | 0,13 g/100 g bei 5 °C 0,13 g/100 g bei 22,5 °C 0,95 g/100 g bei 80 °C 3,3 g/100 g bei 100 °C |
| pH-Wert der gesättigten Lösung | 2,3 |
| pK1 bei 25 °C | 1,80 |
| pK2 bei 25 °C | 2,48 |
| pK3 bei 25 °C | 9,65 |
2. Chemische Eigenschaften von Nitrilotriessigsäure
Nitrilotriessigsäure (NTA) ist hauptsächlich durch die Bildung wasserlöslicher Chelate mit mehrwertigen Metallkationen gekennzeichnet. Sowohl Carboxylgruppen als auch tertiärer Stickstoff fungieren als Ligandenstellen. Unbesetzte Koordinationspositionen von Metallionen können durch Wassermoleküle besetzt werden.
Während die oktaedrische Geometrie (Koordinationszahl 6) häufig Metall-NTA-Chelate darstellt, deuten neuere Strukturstudien durch Röntgenbeugung auf das Potenzial für höhere Koordinationszahlen in bestimmten Metallkomplexen hin. Beispielsweise weist Ca2+ im CaNTA–-Komplex eine Koordinationszahl von 7 auf.
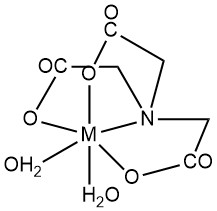
Im Allgemeinen bilden sich Metallkomplexe in einem Molverhältnis von 1:1 zwischen Metall und NTA, und ein Überschuss an NTA kann zu Komplexen von 1:2 führen. Stabilitätskonstanten (K1 für 1:1, K2 für 1:2) quantifizieren die Stabilität des Komplexes. Die Polarisierung der H-O-Bindung im Chelat verleiht 1:1-Komplexen die Eigenschaft einer schwachen Säure, die durch die Dissoziationskonstante Kd gekennzeichnet ist.
K1 = [MNTA]/[M][NTA]
K2 = [MNTA2]/[M][NTA]2
Kd = [MNTAOH][H+]/[MNTA]
Wobei M das mehrwertige Metallion ist, stellt NTA das Anion N(CH2COO–)3 dar.
Tabelle 2 listet einige der Stabilitätskonstanten für NTA-Chelate auf.
| Metallion | log K1 | log K2 | pKd |
|---|---|---|---|
| Al3+ | 11,4 | - | 5,09 |
| Ca2+ | 6,39 | 8,76 | - |
| Cd2+ | 9,78 | 14,39 | 11,25 |
| Co2+ | 10,38 | 14,33 | 10,80 |
| Cu2+ | 12,94 | 17,42 | 9,14 |
| Fe2+ | 8,33 | 12,80 | 10,60 |
| Fe3+ | 15,90 | 24,30 | 4,1-7,8 |
| Hg2+ | 14,60 | - | - |
| Mg2+ | 5,47 | - | - |
| Mn2+ | 7,46 | 10,94 | - |
| Ni2+ | 11,50 | 16,32 | 10,86 |
| Pb2+ | 11,34 | - | - |
| Zn2+ | 10,66 | 14,24 | 10,06 |
Die Komplexierung von Metall-Nitrilotriessigsäure konkurriert mit anderen Reaktionen. Metallkationen können mit Anionen wie Carbonat, Sulfid, Sulfat oder Oxalat schwerlösliche Niederschläge bilden. Darüber hinaus konkurrieren Wasserstoffionen mit Metallkationen um Nitrilotriessigsäure-Trianionen-Bindungsstellen. Folglich werden Nitrilotriessigsäuresysteme durch mehrere Gleichgewichte gesteuert.
Nitrilotriacetat-Chelate sind in einem weiten pH-Bereich stabil, der von der Chelatkonzentration und dem überschüssigen Komplexbildner abhängt; zum Beispiel Ca2+ (pH 9–12), Mg2+ (pH 7–10), Cu2+ (pH 3–12) und Fe2+ (pH 1,5–3).
3. Herstellung von Nitrilotriessigsäure
Die historische Herstellung von Nitrilotriessigsäure aus Ammoniak und Chloressigsäure wird nicht mehr angewendet. Die Oxidation von Triethanolamin ist nicht von industrieller Bedeutung.
Heute wird Nitrilotriessigsäure entweder durch einstufige alkalische oder zweistufige saure Cyanomethylierungsverfahren unter Verwendung von Ammoniak (oder Ammoniumsulfat), Formaldehyd und Natriumcyanid (oder Cyanwasserstoff) hergestellt.
3.1. Das alkalische Verfahren
Das alkalische Verfahren ist ein seit langem etabliertes Verfahren, bei dem Trinatriumnitrilotriacetat durch die Reaktion von Ammoniak, Formaldehyd und Natriumcyanid hergestellt wird. Die Hydrolyse des Nitrilotriacetats ergibt Nitrilotriacetatsalz.
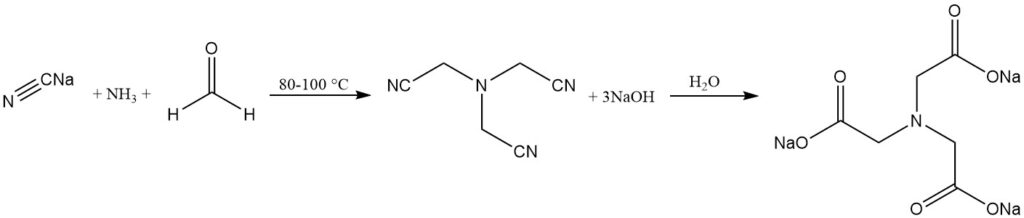
NH3 + 3 HCHO + 3 NaCN → N(CH2CN)3 + 3 NaOH
N(CH2CN)3 + 3 NaOH + 3 H2O → N(CH2COONa)3 + 3 NH3
Dieser Prozess kann chargenweise oder kontinuierlich durchgeführt werden und findet bei 80–100 °C statt. Bei hohem pH-Wert (ca. 14) wird Triscyanomethylamin in situ zu Trinatriumnitrilotriacetat hydrolysiert.
In einem industriellen kontinuierlichen Prozess wird eine wässrige Natriumcyanidlösung zusammen mit einer Formaldehydlösung in ein Kaskadenreaktorsystem eingespeist. Bei dieser Methode entsteht dreimal mehr Ammoniak als nötig, was begrenzt werden muss, um die Entstehung von Nebenprodukten mit niedrigem Carboxymethylierungsgrad wie Glycin und Iminodiessigsäure zu vermeiden.
Die Beseitigung des überschüssigen Ammoniaks während des Prozesses erfolgt durch kontinuierliche Destillation des Ammoniaks mit Dampf oder Luft während des gesamten Prozesses; die Bildung kleiner Mengen unerwünschter Produkte wie Glykolsäure und anderer zuvor erwähnter Produkte ist jedoch unvermeidlich.
Die fertige Lösung wird als 40%ige Lösung verkauft, in Pulverform überführt oder angesäuert, um Nitrilotriessigsäure zu bilden.
3.2. Das Säureverfahren
Um die Bildung von Nebenprodukten im alkalischen Verfahren zu begrenzen, haben einige Hersteller Anlagen auf Basis des Säureverfahrens gebaut; diese Methode erfordert jedoch aufgrund der Verwendung von Blausäure strenge Sicherheitsprotokolle, und es besteht auch das Korrosionsproblem.
Zunächst entsteht aus Ammoniak und Formaldehyd Hexamethylentetramin, das anschließend mit Blausäure in Schwefelsäure zu Triscyanomethylamin reagiert.
Das feste Triscyanomethylamin ist im Reaktionsmedium unlöslich, daher wird es abgefiltert, gewaschen und dann mit Natriumhydroxid verseift, um eine Lösung von Trinatriumnitrilotriacetat mit minimalen Nebenprodukten zu erhalten.
Diese Lösung wird auch als 40%iges Produkt verkauft oder zur Herstellung von pulverförmiger oder fester Nitrilotriessigsäure verwendet.
Handelsübliche Nitrilotriessigsäure wird unter verschiedenen Handelsnamen verkauft, darunter Dissolvine A-Qualitäten (Akzo), Masquol NTA-Qualitäten (Protex), Rexene NTA-Qualitäten (Akzo), Trilon A-Qualitäten (BASF) und Versene NTA-Qualitäten (Dow).
4. Verwendung von Nitrilotriessigsäure
Die Hauptverwendung von Nitrilotriessigsäure und ihren Salzen beruht auf ihrer Fähigkeit, Komplexe mit Metallionen zu bilden. Diese Komplexierungseigenschaften werden in verschiedenen Bereichen genutzt, um störende Metallionen zu binden, Niederschläge aufzulösen, Redoxpotentiale von Metallionen zu modulieren oder Metallionenpuffer zu erzeugen.
4.1. Verwendung von Nitrilotriessigsäure zur Wasserenthärtung
Nitrilotriessigsäure enthärtet Wasser effektiv, indem sie Calciumionen (Ca2+) und Magnesiumionen (Mg2+) in einem neutralen bis alkalischen pH-Bereich komplexiert. Die erforderliche Menge an Nitrilotriessigsäure oder Trinatriumnitrilotriacetat zur Wasserenthärtung variiert je nach Wasserhärte.
Branchen wie Papier, Textilien, Seife, Kosmetik, Reinigungsmittel, Kesselspeisewasseraufbereitung und chemische Verarbeitung (z. B. Fotografie, Galvanik) verwenden Nitrilotriessigsäure zur Wasserenthärtung.
4.2. Verwendung von Nitrilotriessigsäure als Phosphatersatz in Waschmitteln
Trinatriumnitrilotriacetat wird als Ersatz für Pentanatriumtriphosphat in phosphatarmen oder phosphatfreien Waschmitteln verwendet, oft in Verbindung mit Zeolithen oder Polycarboxylaten.
Anders als Pentanatriumtriphosphat ist Trinatriumnitrilotriacetat hydrolysebeständig und bleibt nach dem Sprühtrocknen und beim Waschen voll wirksam. Obwohl das Äquivalenzverhältnis von Trinatriumnitrilotriacetat zu Pentanatriumtriphosphat ungefähr 0,6 zu 1 beträgt, beeinträchtigt es weder die primäre noch die sekundäre Waschkraft.
4.3. Verwendung von Nitrilotriessigsäure als Tetrakaliumdiphosphatersatz in Reinigungsmitteln
Trinatriumnitrilotriacetat ersetzt Tetrakaliumdiphosphat in Reinigungsmitteln in einem günstigen Äquivalenzverhältnis von 1:3, wodurch häufig Hydrotrope oder Lösungsvermittler überflüssig werden. Synergistische Buildereffekte treten bei teilweiser Phosphatsubstitution auf.
4.4. Verwendung von Nitrilotriessigsäure zur Maskierung von Schwermetallionen
Obwohl weniger wirksam als EDTA, wird Nitrilotriessigsäure zur Maskierung von Schwermetallionen wie Fe3+, Cu2+ und Mn2+ verwendet. Branchen wie die Seifenherstellung, Textilbleiche, Oberflächenreinigung und verschiedene chemische Prozesse verwenden sie zu diesem Zweck.
4.5. Spezialanwendungen
Nitrilotriessigsäure wird auch in Spezialanwendungen wie der Trennung von Seltenerdelementen, komplexometrischen Titrationen und der Formulierung von landwirtschaftlichen Mikronährstoffen verwendet.
5. Toxikologie von Nitrilotriessigsäure
Nitrilotriessigsäure ist biologisch gut abbaubar und mineralisiert leicht zu anorganischen Endprodukten ohne persistente organische Metaboliten.
Umweltstudien, insbesondere nach der Einführung von Reinigungsmitteln mit Nitrilotriessigsäure, bestätigen ihre schnelle biologische Abbaubarkeit in Kläranlagen (>98%) und Oberflächengewässern (Halbwertszeit < 1 Tag). Nach begrenzter Infiltration sind minimale Spuren von Nitrilotriessigsäure im Grundwasser nachweisbar.
Während die Komplexierungsfähigkeit von Nitrilotriessigsäure potenziell Schwermetalle mobilisieren kann, minimiert ihre schnelle biologische Abbaubarkeit dieses Risiko. Studien an Kläranlagen und Flusssedimenten zeigen eine vernachlässigbare Remobilisierung von Schwermetallen unter realistischen Bedingungen.
Nitrilotriessigsäure weist eine geringe akute Toxizität für Wasserorganismen auf, mit LC50-Werten von etwa 100 bis über 10.000 mg/l, beeinflusst durch die Wasserhärte. Chronische Toxizitätsstudien an verschiedenen Organismen zeigen keine negativen Auswirkungen unter 1 mg/l, wobei bei viel höheren Konzentrationen signifikante Toxizitätsschwellenwerte auftreten.
Die akute Toxizität bei Säugetieren variiert je nach Art. Der orale LD50-Wert für Trinatriumnitrilotriacetat bei Nagetieren beträgt ungefähr 2000 mg/kg; diese Dosis löst bei Hunden und Affen Erbrechen aus.
Inhalationsstudien und Haut-/Augen-/Atemwegsreizungstests zeigen minimale Auswirkungen, ohne Anzeichen von Sensibilisierung oder Allergien. Nitrilotriessigsäure hat keine teratogenen Wirkungen, weder allein noch in Kombination mit Schwermetallen wie Cadmium und Quecksilber. Darüber hinaus liefern Mutagenitätstests negative Ergebnisse.
Säugetiere metabolisieren Nitrilotriessigsäure nicht; stattdessen scheiden die Nieren sie unverändert aus. Nierentubuli und Harnleiterzellen akkumulieren höhere Konzentrationen von Nitrilotriessigsäure.
Subchronische und chronische Studien bringen Nitrilotriessigsäure mit Nierentoxizität aufgrund von Störungen des Elektrolyt- und Eisenstoffwechsels in Verbindung. Hohe Dosen können Nieren-, Harnleiter- und Blasenepithelzellen schädigen und möglicherweise zur Bildung von Tumoren führen.
Es gibt jedoch einen signifikanten Schwellenwert unterhalb der Tumorentwicklung, der den No Adverse Effect Level (NOEL) von 14 mg/kg Körpergewicht pro Tag weit übersteigt.
Referenz
- Nitrilotriessigsäure; Ullmanns Enzyklopädie der technischen Chemie. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_377.pub3
