Herstellungsverfahren von Titandioxid
Kommerzielles Titandioxid wird nach zwei unterschiedlichen industriellen Verfahren hergestellt: dem Sulfatverfahren und dem Chloridverfahren.
Das Sulfatverfahren, ein älteres Verfahren, beginnt mit dem Aufschluss titanhaltiger Rohstoffe wie Ilmenit oder Titanschlacke (→ ausführlicher Artikel über Rohstoffe) in konzentrierter Schwefelsäure. Diese Reaktion findet bei 150–220 °C statt und führt zu einer Schwarzlauge, die gelöstes Titan, Eisen und verschiedene Verunreinigungen enthält.
Die anschließende Hydrolyse der Titanylsulfatlösung fällt relativ reines Titanoxidhydrat (TiO(OH)2 oder TiO2-Dihydrat) aus. Weitere Reinigungsschritte entfernen die verbleibenden Verunreinigungen. Das Titanoxidhydrat wird anschließend kalziniert, gemahlen und üblicherweise mit anorganischen Verbindungen beschichtet.
Beim Chloridverfahren werden titanhaltige Rohstoffe wie Ilmenit, Leukoxen, Rutil, Titanschlacke oder Anatas bei Temperaturen zwischen 700 und 1200 °C chloriert. Das entstehende Titantetrachlorid (TiCl4) wird anschließend bei 900 bis 1400 °C zu Titandioxid oxidiert, das anschließend gemahlen und mit anorganischen Verbindungen beschichtet wird.
Diese beiden Verfahren werden ausschließlich zur Herstellung von Titandioxidpigmenten eingesetzt. Es gibt auch andere Herstellungsverfahren für TiO2 ohne Pigmenteigenschaften, vor allem für die Synthese von Titandioxid-Nanopartikeln. Beispiele hierfür sind die Hydrolyse von Titanalkoholaten oder die pyrolytische Reaktion von TiCl4 mit Wasser (Aerosilverfahren).
Inhaltsverzeichnis
1. Herstellung von Titandioxid nach dem Sulfatverfahren
Die Herstellung von Titandioxid nach dem Sulfatverfahren umfasst mehrere aufeinanderfolgende Schritte, wie in Abbildung 1 dargestellt.
1.1. Mahlen
Titanhaltige Rohstoffe werden auf einen Feuchtigkeitsgehalt von unter 0,1 % getrocknet, um vorzeitige Reaktionen und Erhitzung beim Mischen mit Schwefelsäure zu vermeiden. Anschließend werden die Materialien in Kugel- oder Schüsselmühlen gemahlen, um eine mittlere Partikelgröße unter 40 μm zu erreichen.
1.2. Aufschluss
Der Batch-Aufschluss ist das Standardverfahren, bei dem gemahlene Rohstoffe (Ilmenit, Titanschlacke oder Mischungen) mit 80–98 %iger H2SO4 vermischt werden.
Die Reaktion kann durch Zugabe von Oleum zu 80 %iger Schwefelsäure oder durch Zugabe von Wasser und/oder Dampf zur Rohstoffsuspension in konzentrierter Schwefelsäure eingeleitet werden. In beiden Fällen löst die Mischungsenthalpie einen exothermen chemischen Aufschluss aus, der eine Maximaltemperatur von ca. 200 °C oder mehr erreicht.
Das Verhältnis von H2SO4 zu Rohstoffen wird so eingestellt, dass in der resultierenden Schwarzlauge ein Verhältnis von 1,8 zu 2,2 Gewichtsprozent Schwefelsäure zu Titandioxid (Säurezahl) erreicht wird.
Die Reaktion im Aufschlussbehälter (f) beginnt mit der Zugabe von Wasser, verdünnter Schwefelsäure, Oleum oder Dampf. Ein anfänglicher Temperaturanstieg auf 50–70 °C wird durch die Säurehydratationswärme verursacht. Die anschließende exotherme Sulfatbildung treibt die Temperatur auf 170–220 °C.
Das zugesetzte und durch die Reaktion entstandene Wasser verdampft vollständig und bildet einen festen Aufschlussrückstand. Bei verdünnter Säure oder schwerlöslichen Rohstoffen kann eine externe Heizung erforderlich sein.
Nach Erreichen der Maximaltemperatur benötigt das feste Reaktionsgemisch eine Reifungszeit von 1–12 Stunden, wobei die Dauer vom Rohstoff abhängt. Die Reifung maximiert die Löslichkeit titanhaltiger Komponenten. Luftbewegung während des Temperaturanstiegs beeinflusst die Ausbeute des Aufschlusses positiv.
Es gibt kontinuierliche Aufschlussverfahren. Ein etabliertes Verfahren besteht darin, ein Ilmenit-Wasser-Gemisch mit Schwefelsäure kontinuierlich in eine Doppelpaddel-Förderschnecke zuzuführen. Nach kurzer Verweilzeit (weniger als 1 Stunde) bildet sich ein krümeliger Kuchen. Dieses Verfahren eignet sich für hochreaktive Rohstoffe.
1.3. Nachverdauung
Aufgrund der hohen Kosten titanhaltiger Rohstoffe wurden Versuche unternommen, feste Aufschlussrückstände (mit 40–65 % Titandioxid) wiederzuverwenden. Diese Entwicklungen konnten aufgrund der komplexen und teuren Ausrüstung oder der Verarbeitungsbedingungen bisher nicht im großen Maßstab umgesetzt werden.
Ein Nachverdauungsverfahren mit Standardausrüstung und -technologie wurde 2001 vorgeschlagen.
1.4. Auflösung und Reduktion
Der Aufschlussrückstand wird in kaltem Wasser oder recycelter verdünnter Säure bei einer Temperatur unter 85 °C aufgelöst, um eine vorzeitige Hydrolyse, insbesondere bei Ilmenitprodukten, zu verhindern. Während der Auflösung wird Luft zur Bewegung zugeführt. Bei Ilmenit beträgt die Konzentration der Titandioxidlösung 8–12 Gew.-%, bei Schlacke 13–18 Gew.-%.
Das dreiwertige Eisen (Fe3+) wird zusammen mit Titanverbindungen hydrolysiert und haftet am Titanoxidhydrat. Daher muss das gesamte Fe3+ während der Auflösung des Ilmenitprodukts oder in einem nachfolgenden Schritt mithilfe von Eisenschrott zu Fe2+ reduziert werden.
Um eine Reoxidation des Eisens während der nachfolgenden Verarbeitung zu verhindern, wird eine geringe Menge Ti3+ bis zum Abschluss der Hydrolyse zurückgehalten. Ti3+ entsteht durch den Einsatz von überschüssigem Eisenschrott bei der Reduktion von Fe3+. Unter optimierten Bedingungen kann auch Ti4+ teilweise zu Ti3+ reduziert werden. Diese konzentrierte Ti3+-Lösung wird anschließend der Hauptreaktionslösung zugegeben.
Aus Titanschlacke gewonnene Lösungen enthalten bereits höhere Mengen an Ti3+, die durch Oxidation mit Luftsauerstoff reduziert werden müssen, um Ausbeuteverluste während der Hydrolyse zu vermeiden. Das im Schlackenaufschluss vorhandene Ti3+ reduziert Schwefelsäure teilweise zu SO2 oder H2S, die eine umfangreiche Abgasreinigung erfordern, insbesondere wenn die Schlacke Schwermetalle enthält.
Ein gemischter Aufschluss von Ilmenit und Titanschlacke ist möglich, wobei das Ti3+ aus der Schlacke das gesamte Fe3+ zu Fe2+ reduziert. Dies kann auch durch Mischen gelöster Produkte aus getrennten Ilmenit- und Titanschlackenaufschlüssen erreicht werden.
1.5. Klärung
Alle ungelösten Feststoffe müssen gründlich aus der Lösung entfernt werden, um eine Verunreinigung des Hydrolysats zu vermeiden. Die wirtschaftlichste Methode besteht in der Vorklärung in einem Eindicker (g) und der anschließenden Filtration des Sediments mit einem Rotationsvakuumtrommelfilter (h) oder einer Filterpresse.
Der Überstand des Eindickers wird ebenfalls durch Filterpressen (i) geleitet, um Feinanteile zu entfernen. Aufgrund seiner schlechten Filtereigenschaften fungiert der Rotationsfilter typischerweise als Anschwemmfilter. Die Zugabe von Chemikalien kann die Flockung und Sedimentation von Feinanteilen im Eindicker fördern.
Auch eine einstufige Klärung mit automatisierten Filterpressen wurde vorgeschlagen.
1.6. Kristallisation
Nach der Fe3+-Reduktion enthalten Lösungen aus dem Schlackenaufschluss 5–6 Gew.-% FeSO4 und solche aus dem Ilmenitaufschluss 16–20 Gew.-% FeSO4. Ilmenitlösungen werden unter Vakuum gekühlt, um zu kristallisieren und FeSO4·7 H2 (Kupferasen) abzutrennen (j), um das nach der Hydrolyse mit der Abfallsäure ausgetragene FeSO4 zu reduzieren. Dadurch erhöht sich die Titandioxidkonzentration in der Lösung um ca. 25 %.
Das Kupfersulfat wird durch Filtration oder Zentrifugation abgetrennt (k).
Eisensulfat wird hauptsächlich zur Wasseraufbereitung, als Chromatreduktionsmittel für Zement und als Rohstoff für Eisenoxidpigmente verwendet. Es kann auch zu FeSO4·H2O dehydratisiert oder thermisch zu Eisen(III)-oxid und Schwefeldioxid zersetzt werden.
1.7. Hydrolyse
Titanoxidhydrat wird durch Hydrolyse bei 94–110 °C ausgefällt. Gleichzeitig fallen weitere schwefelsäurelösliche Rohstoffkomponenten, hauptsächlich Niob als Oxidhydrat, aus. Die Hydrolyse erfolgt in gemauerten Rührbehältern (n) unter Dampfeinspritzung. Das resultierende Hydrolysat weist keine Pigmenteigenschaften auf.
Die Eigenschaften des Hydrolysats werden maßgeblich vom Flockungsgrad der Primärpartikel beeinflusst. Die Primärpartikelgröße des Hydrolysats beträgt ca. 5 nm, die des TiO2-Pigments 200–300 nm. Die Hydrolysateigenschaften werden von mehreren Faktoren beeinflusst:
1. Die Hydrolyse konzentrierter Titansulfatlösungen (170–230 g TiO2/L) verläuft ohne geeignete Keime, die die Hydrolyse beschleunigen, langsam und unvollständig. Keime werden hauptsächlich nach dem Mecklenburg- oder Blumenfeld-Verfahren hergestellt.
Beim Mecklenburg-Verfahren wird kolloidales Titanoxidhydrat mit Natriumhydroxid bei 100 °C gefällt. 1 % dieses Hydrats wird als Impfmaterial verwendet.
Beim Blumenfeld-Verfahren wird ein kleiner Teil der Sulfatlösung in kochendem Wasser hydrolysiert und anschließend der Gesamtlösung zugegeben. Die Anzahl der Keime beeinflusst die Partikelgröße des Hydrolysats und die Flockungseigenschaften.
2. Die Partikelgröße und der Flockungsgrad des Hydrolysats hängen auch von der Rührintensität während der Blumenfeld-Keimbildung und der anfänglichen Hydrolysephase ab.
3. Die Titansulfatkonzentration beeinflusst die Hydrolysatflockung erheblich und wird bei Bedarf durch Vakuumverdampfung während der Hydrolyse auf 170–230 g/l Titandioxid eingestellt. Niedrigere Konzentrationen führen zu gröberen Flockulaten.
4. Die Säurezahl sollte zwischen 1,8 und 2,2 liegen. Sie beeinflusst maßgeblich die TiO2-Ausbeute, die Partikelgröße des Hydrolysats und die Flockungsgröße. Hohe Säurezahlen führen zu geringerer Ausbeute und gröberem Hydrolysat. Eine normale Hydrolysedauer (3–6 Stunden) ergibt 93–96 % Titandioxid.
Andere Salzkonzentrationen, insbesondere FeSO4, beeinflussen die Hydrolysateigenschaften. Hohe Konzentrationen führen typischerweise zu feineren Flocken.
5. Die Temperatur beeinflusst hauptsächlich die Volumen-Zeit-Ausbeute und die Reinheit des Hydrolysats.
Die Hydrolysatstruktur ist komplex. Nanokristalline Anatas-Primärpartikel weisen eine Größe von etwa 5–6 nm auf (Elektronenmikroskopie, BET-Oberflächendaten). Konventionelle Partikelgrößenbestimmungen (z. B. Laserstreuung) ergeben je nach Dispersionsintensität Werte von Hunderten bis Tausenden von Nanometern.
Die Primärpartikel aggregieren zu Sekundärpartikeln von etwa 30 nm (Abbildung 3). Diese Sekundärpartikel bilden Tertiärstrukturen von etwa 1 μm Größe. Tertiärstrukturen bilden dann Quartärstrukturen von wenigen Mikrometern.
Mahlen oder hochintensive Ultraschalldispersion können Quartärstrukturen aufbrechen. Ausreichende Dispersionsenergie kann Tertiärstrukturen teilweise aufbrechen.
Während der Kalzinierung finden morphologische Veränderungen statt:
- Bei 300–600 °C sintern Primärpartikel. Ehemalige Sekundärpartikel bilden neue Primärpartikel aus kristallinem Anatas mit einer Größe von ca. 20 nm. Dies ist eine typische Größe für katalytisches Titandioxid.
- Bei 800–1000 °C sintern die 20 nm großen Partikel. Ursprüngliche Tertiärpartikel bilden neue Primärpartikel aus kristallinem Rutil oder Anatas mit einer Größe von ca. 200 nm. Dies ist eine typische Größe für pigmentiertes Titandioxid. Ursprüngliche quaternäre Strukturen bilden Pigmentpartikelagglomerate, die durch einen Mahlschritt getrennt werden.
1.8. Reinigung des Hydrolysats
Nach der Hydrolyse enthält die flüssige Phase 20–28 % Schwefelsäure und je nach Rohstoff unterschiedliche Mengen gelöster Sulfate. Titanoxidhydrat wird durch Filtration von der Lösung getrennt und anschließend mit Wasser oder verdünnter Säure gewaschen. Selbst beim Waschen mit Säure verbleiben zu viele Schwermetallionen am Titanoxidhydrat adsorbiert für die Weißpigmentherstellung.
Die meisten Verunreinigungen können durch Reduktion (Bleichen) entfernt werden. Der Filterkuchen wird bei 50–90 °C mit 3–10 % verdünnter Säure aufgeschlämmt und anschließend mit Zink- oder Aluminiumpulver (q) vermischt. Auch nichtmetallische Reduktionsmittel (z. B. HOCH2–SO2Na) können zum Bleichen verwendet werden.
Nach einer zweiten Filtration und Wäsche weist das Titanoxidhydrat geringe Konzentrationen an farbigen Verunreinigungen auf. Es enthält jedoch noch 5–10 % chemisorbierte Schwefelsäure, die durch Waschen nicht vollständig entfernt werden kann. Es wird durch Hochtemperaturerhitzung ausgetrieben.
1.9. Dotierung des Hydrats
Zur Herstellung von hochreinem Titandioxid wird das Titanoxidhydrat ohne Zusätze kalziniert. Dabei entsteht eine relativ grobe TiO2-Sorte mit einem von der Erhitzungstemperatur abhängigen Rutilgehalt. Zur Herstellung bestimmter Pigmentsorten muss das Titanoxidhydrat vor der Kalzinierung mit Alkalimetallverbindungen und Phosphorsäure behandelt werden.
Anataspigmente enthalten mehr Phosphorsäure als Rutilpigmente. Für Rutilpigmente werden Rutilkeime (weniger als 10 %, typischerweise 1–5 %) zugesetzt. Zur Stabilisierung der Kristallstruktur werden ZnO, Al2O3 und/oder Sb2O3 (weniger als 3 %) zugesetzt.
Rutilkeime werden durch Umwandlung von gereinigtem Titanoxidhydrat in Natriumtitanat erzeugt, das sulfatfrei gewaschen und anschließend mit Salzsäure behandelt wird. Rutilkeime können auch durch Fällung von Titantetrachloridlösungen mit Natronlauge hergestellt werden.
1.10. Kalzinierung
Dotiertes Titanoxidhydrat wird mit Rotationsvakuumfiltern oder Filterpressen (n) gefiltert, um Wasser zu entfernen. Rotationsvakuumfilter erreichen einen TiO2-Feststoffgehalt von ca. 30–40 %. Druckrotationsfilter oder automatische Filterpressen erzielen TiO2-Gehalte von ca. 50 % oder mehr.
Die Kalzinierung erfolgt in Drehrohröfen (t), die im Gegenstrom direkt mit Gas oder Öl beheizt werden. Etwa zwei Drittel der gesamten Verweilzeit (4–20 Stunden) entfallen auf die Materialtrocknung. Oberhalb von ca. 500 °C wird Schwefeltrioxid ausgetrieben und bei höheren Temperaturen teilweise zu Schwefeldioxid und Sauerstoff zersetzt.
Das Produkt erreicht je nach Pigmentart, Durchsatz und Ofentemperaturprofil eine Maximaltemperatur von 800–1100 °C. Rutilgehalt, Partikelgröße, Größenverteilung und Aggregatbildung hängen stark vom Ofenbetrieb ab.
Nach dem Verlassen des Ofens kann der Klinker indirekt oder direkt in Trommelkühlern (u) luftgekühlt werden. Die Abgastemperatur am Ofenausgang muss 300 °C überschreiten, um Schwefelsäurekondensation in den Rohrleitungen zu verhindern.
Energie lässt sich durch die Rückführung eines Teils des Gases in die Brennkammer des Ofens sparen. Dieses Gas kann als teilweiser Luftersatz mit Brenngasen gemischt oder zur Aufkonzentrierung der verdünnten Säure verwendet werden. Anschließend wird das Gas der Abgasreinigungsanlage zugeführt.
1.11. Mahlen
Agglomerate und Aggregate im Klinker werden durch Nass- oder Trockenmahlen auf Pigmentfeinheit reduziert. Die Grobzerkleinerung sollte in Hammermühlen (Raymond-Mühlen) oder Walzenmühlen erfolgen, bevor die Nassmahlung in Kugelmühlen oder Sandmühlen (unter Zugabe eines Dispersionsmittels) erfolgt.
Der Grobanteil kann durch Zentrifugieren oder Hydrozyklone aus der Suspension entfernt und den Mühlen wieder zugeführt werden. Hammermühlen, Schlagkreuzmühlen, Walzenmühlen und insbesondere Pendel- und Dampfstrahlmühlen eignen sich für die Trockenmahlung.
Spezielle Mahladditive können als Netzmittel bei der nachfolgenden Pigmentbehandlung oder zur Verbesserung der Dispergierbarkeit unbehandelter Pigmente eingesetzt werden.
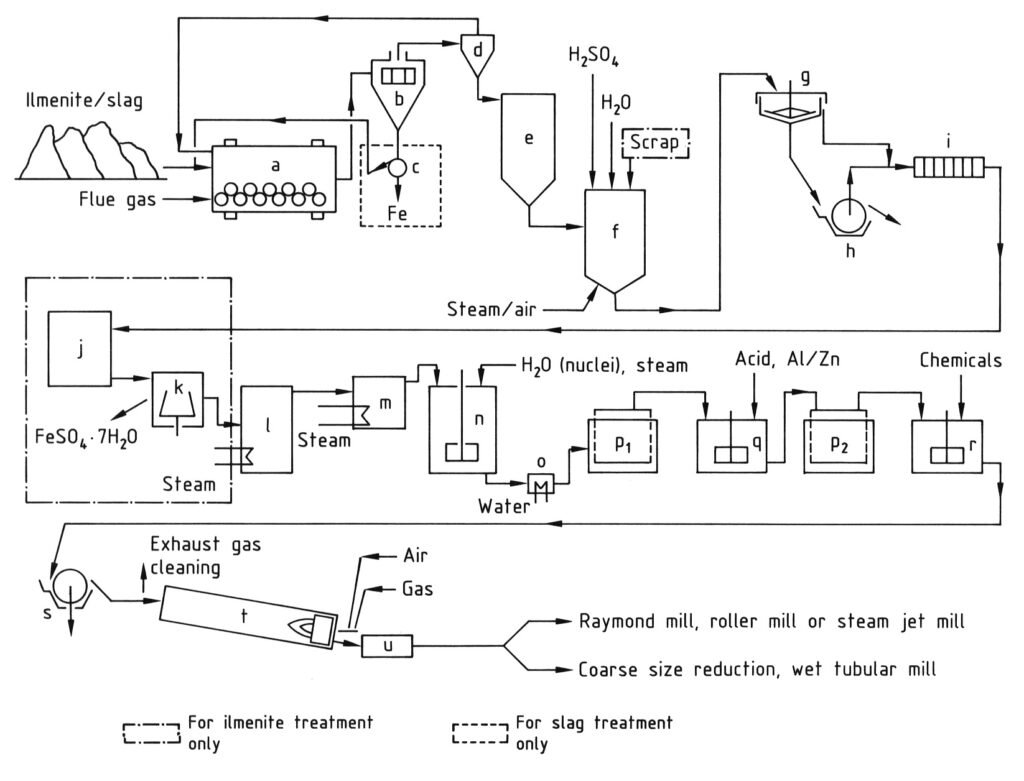
a) Kugelmühle/Trockner; b) Sieb; c) Magnetabscheider; d) Zyklon; e) Silo; f) Aufschlussbehälter; g) Eindicker; h) Rotationsfilter; i) Filterpresse; j) Kristallisator; k) Zentrifuge; l) Vakuumverdampfer; m) Vorwärmer; n) Rührbehälter zur Hydrolyse; o) Kühler; p) Moore-Filter; q) Rührbehälter zum Bleichen; r) Rührbehälter zum Dotieren; s) Rotationsfilter zur Entwässerung; t) Drehrohrofen; u) Kühler
2. Herstellung von Titandioxid nach dem Chloridverfahren
Die Herstellung von Titandioxidpigment nach dem Chloridverfahren ist in Abbildung 2 dargestellt.
2.1. Chlorierung
Titan aus den Rohstoffen wird in reduzierender Atmosphäre zu Titantetrachlorid umgewandelt. Als Reduktionsmittel wird kalzinierter Petrolkoks mit extrem niedrigem Aschegehalt verwendet. Aufgrund des geringen Gehalts an flüchtigen Bestandteilen ist die HCl-Bildung minimal. Titandioxid reagiert exotherm nach folgender Gleichung:
TiO2 + 2 Cl2 + C → TiCl4 + CO2
Bei steigender Temperatur findet eine endotherme Reaktion zwischen Kohlendioxid und Kohlenstoff zu Kohlenmonoxid statt. Um die Reaktionstemperatur zwischen 800 und 1200 °C zu halten, muss Sauerstoff zusammen mit Chlor zugeführt werden. Der Koksverbrauch beträgt 250–300 kg pro Tonne Titandioxid. Bei Verwendung von CO2-haltigem Chlor aus der TiCl4-Verbrennung erhöht sich der Koksverbrauch auf 350–450 kg.
Die ältere Festbettchlorierung ist veraltet. Bei diesem Verfahren wird gemahlenes Titanrohmaterial mit Petrolkoks und einem Bindemittel vermischt. Es entstehen Briketts. Die Chlorierung erfolgte bei 700–900 °C in gemauerten Reaktoren.
Die Wirbelschichtchlorierung begann 1950. Titanrohmaterial (sandähnliche Partikelgröße) und Petrolkoks (mittlere Partikelgröße etwa fünfmal so groß wie Titandioxid) reagieren mit Chlor und Sauerstoff. Dies geschieht in einem gemauerten Wirbelschichtreaktor bei 800–1200 °C.
Die Rohstoffe müssen sehr trocken sein, um die Bildung von HCl zu verhindern. Der Chlorumsatz liegt bei 98–100 %. Die Titanumwandlung im Rohstoff beträgt 95–100 %. Die Effizienz dieses Prozesses hängt von der Reaktorkonstruktion und der Gasgeschwindigkeit ab. Verluste entstehen hauptsächlich durch Staubeintrag.
Magnesiumchlorid und Calciumchlorid können sich aufgrund ihrer geringen Flüchtigkeit im Wirbelschichtreaktor anreichern. Auch Siliziumdioxid und Zirkonsilikat reichern sich an, da sie bei Prozesstemperaturen sehr langsam chlorieren. Alle anderen Rohstoffbestandteile verflüchtigen sich als Chloride in den Reaktionsgasen.
Die keramische Auskleidung des Wirbelschichtreaktors ist anfällig für Abrieb und Korrosion. Bei Unterbrechung der Chlorierung besteht die Gefahr der Sinterung der Rohstoffe, was eine nachfolgende Fluidisierung verhindern kann.
2.2. Gaskühlung
Reaktionsgase werden mit flüssigem TiCl4 abgeschreckt. Die Kühlung kann indirekt oder direkt erfolgen (d).
Die Chloride der anderen Komponenten kristallisieren und neigen dazu, sich an Kühlflächen abzulagern, insbesondere große Mengen an Eisen(II)- und Eisen(III)-chloriden, die bei der Chlorierung von Ilmenit entstehen. In dieser ersten Phase werden die Reaktionsgase auf unter 300 °C abgekühlt, um die begleitenden Chloride durch Kondensation oder Sublimation von TiCl4 zu trennen (e).
Das Gas enthält hauptsächlich TiCl4. Es wird unter 0 °C abgekühlt, um den größten Teil des TiCl4 zu kondensieren (f). Die im Abgas verbleibenden geringen Mengen an TiCl4 und Chlor (CO2, CO und N2) werden durch alkalische Wäsche entfernt (t).
2.3. Reinigung von TiCl4
Die festen Chloride und der mitgerissene Staub werden durch einfache Verdampfung (Destillation) von TiCl4 abgetrennt (j). Gelöstes Chlor wird durch Erhitzen oder Reduktion mit Metallpulvern (Fe, Cu oder Sn) entfernt.
Die destillative Abtrennung von Vanadiumtetrachlorid und Vanadiumoxychlorid aus TiCl4 ist komplexer, da ihre Siedepunkte sehr nahe beieinander liegen. Daher werden sie zu festen, niedervalenten Vanadiumchloriden reduziert (i).
Zahlreiche Reduktionsmittel wurden empfohlen. Beispiele hierfür sind Kupfer, Titantrichlorid, Schwefelwasserstoff, Kohlenwasserstoffe, Seifen, Fettsäuren und Amine. Nach der anschließenden Verdampfung (j) sollte Titanchlorid weniger als 5 ppm Vanadium enthalten.
Phosgen und SiCl4 können durch fraktionierte Destillation entfernt werden.
2.4. Oxidation von TiCl4 und Rückgewinnung von TiO2
Das Titandioxidpigment und Chlor entstehen durch die Reaktion von Titantetrachlorid mit Sauerstoff bei 900–1400 °C. Gereinigtes TiCl4 wird verdampft (k) und der Dampf indirekt auf ca. 500–1000 °C erhitzt (l).
TiCl4 + O2 → 2 Cl2 + TiO2
Diese Reaktion ist mäßig exotherm und erfordert eine hohe Reaktionstemperatur. Daher muss Sauerstoff mithilfe einer elektrischen Plasmaflamme auf über 1000 °C erhitzt werden, indem ein Teil des Sauerstoffs mit Kohlenmonoxid oder einem anderen Brennstoff reagiert.
Heißes TiCl4 und heißer Sauerstoff (110–150 % stöchiometrische Menge) werden separat in eine Reaktionskammer eingeleitet. Für eine hohe Reaktionsgeschwindigkeit müssen sie schnell und vollständig vermischt werden. Zahlreiche Reaktordesigns wurden bereits vorgeschlagen und eingesetzt.
Ähnliche Überlegungen gelten für die Kühleinheit (o). Das Pigment muss mithilfe von Kühlzonen unterschiedlicher Geometrie schnell auf unter 600 °C abgekühlt werden. Anhaftendes Material an den Wänden wird üblicherweise durch die Zugabe von Schleifpartikeln wie Sand, groben TiO2-Partikeln, Natriumchlorid oder anderen Materialien verhindert.
Bei der Herstellung von Titandioxid nach dem Chloridverfahren sind neben den Prozessparametern die Auslegung des Oxidationsreaktors und die Wahl geeigneter Materialien von entscheidender Bedeutung. Zahlreiche Patente belegen umfangreiche Optimierungsbemühungen für diesen Prozessschritt. Nur wenige Unternehmen verfügen über das erforderliche Know-how für den industriellen Maßstab.
Das Reaktionsgemisch, bestehend aus Gasen (Cl2, O2, CO2) und Titandioxidpigment, kann während der Feststoffabtrennung vom Pigment entweder indirekt oder direkt weiter gekühlt werden (p). TiO2 wird durch Schwerkraftabscheidung, Zyklone, Filter oder eine Kombination dieser Vorrichtungen vom Gasstrom getrennt.
Der Gasstrom wird in die Kühlzone des Oxidationsreaktors (o) und in den Chlorierungsprozess zurückgeführt. Er wird als sauerstoffhaltiges Chlor über die Verflüssigungseinheit (u) oder direkt als Gas zurückgeführt. Am Titandioxidpigment adsorbiertes Chlor kann durch Erhitzen, Spülen mit Stickstoff oder Luft oder nasschemische Behandlung entfernt werden.
Die Nasstrennung durch Abschrecken des pigmenthaltigen Gasgemisches (Cl2, O2 und CO2) in Wasser hat bisher keine großtechnische Anwendung gefunden.
Die Qualität des Titandioxidpigments (Partikelgröße und -größenverteilung) hängt von der Reaktionstemperatur, den Additiven, dem Sauerstoffüberschuss und den rheologischen Bedingungen im Reaktor ab. Für jeden Reaktor müssen anspruchsvolle Bedingungen geschaffen werden.
Die Anwesenheit von Wasser und/oder Alkaliverbindungen während der TiCl4-Verbrennung erzeugt Keime, die die kontrollierte Bildung fein verteilter Pigmentpartikel mit hohem Streuvermögen fördern. Additive können direkt dem Sauerstoff zugesetzt oder durch Verbrennung wasserstoffhaltiger Materialien erzeugt werden.
Die Anwesenheit von Aluminiumchlorid fördert die Rutilbildung und eine feinere Pigmentverteilung. Es wird in Mengen von 0,2–2,0 Gew.-% zugesetzt. Die Zugabe von PCl3 und SiCl4 unterdrückt die Rutilbildung, wodurch Anataspigment entsteht. Dieser Pigmenttyp hat jedoch für das Chloridverfahren keine große Bedeutung erlangt.
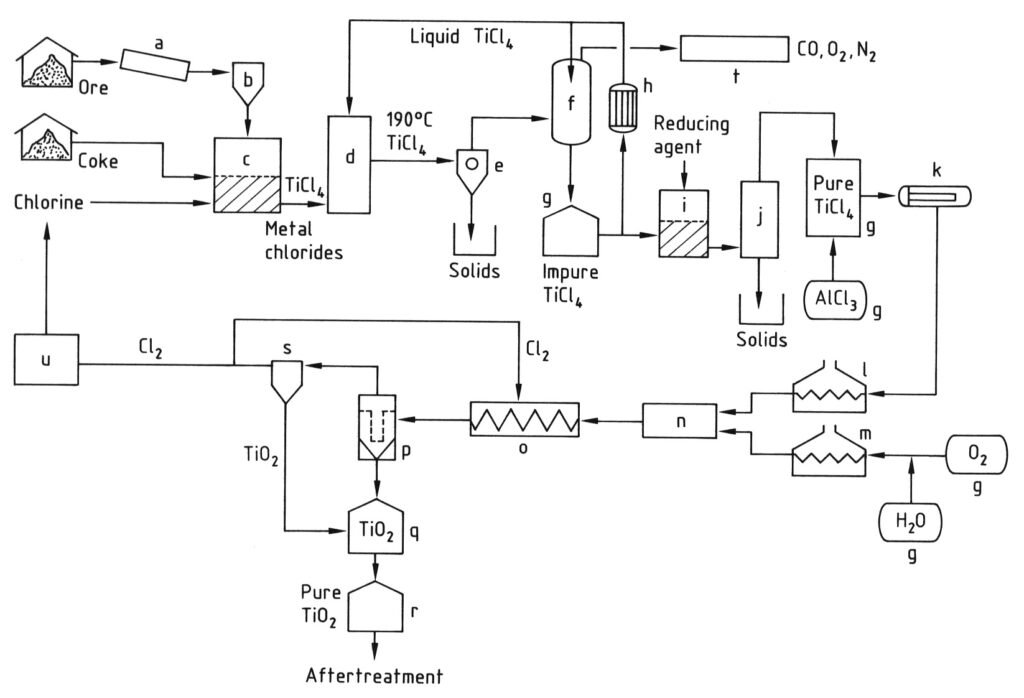
a) Mühle; b) Silo; c) Wirbelschichtreaktor; d) Kühlturm; e) Abtrennung der Metallchloride; f) TiCl4-Kondensation; g) Tank; h) Kühler; i) Vanadiumreduktion; j) Destillation; k) Verdampfer; l) TiCl4-Überhitzer; m) O2-Überhitzer; n) Brenner; o) Kühlschlange; p) Filter; q) TiO2-Reinigung; r) Silo; s) Gasreinigung; t) Abgasreinigung; u) Cl2-Verflüssigung
3. Chloridverfahren vs. Sulfatverfahren zur Titandioxidproduktion
Die weltweite Produktionskapazität für Titandioxid verteilt sich nahezu auf die beiden Hauptverfahren. Derzeit deckt das Sulfatverfahren etwa 47 % der Kapazität ab, das Chloridverfahren etwa 53 %.
Die tatsächlichen Produktions- und Verkaufszahlen sprechen eher für das Chloridverfahren, da einige Sulfatanlagen, insbesondere in China, unter ihrer vollen Kapazität arbeiten. Der deutliche Aufwärtstrend beim Chloridverfahren, der 1996 mit rund 57 % seinen Höhepunkt erreichte, hat sich aufgrund des deutlichen Kapazitätsausbaus bei neuen Sulfatverfahren in China zuletzt stabilisiert.
TiO2-Pigmente, die im Chloridverfahren hergestellt werden, weisen im Vergleich zum Sulfatverfahren im Allgemeinen eine höhere Helligkeit und einen neutraleren Vollton auf. Sie verfügen oft über ein besseres Streuvermögen und eine längere Haltbarkeit. Für viele Anwendungen sind diese beiden Pigmenttypen jedoch austauschbar.
In bestimmten Anwendungen, beispielsweise für Fasern und Druckfarben, können Sulfatpigmente überlegene Eigenschaften bieten. Dies wird oft auf ihre weniger abrasiven Eigenschaften zurückgeführt. Titandioxidpigmente für anspruchsvolle Anwendungen werden fast immer anorganisch nachbehandelt.
Anataspigmente und technische Titandioxide, die eine Anatasmodifizierung benötigen, darunter solche für Katalysatoren, kosmetische Nanopartikel, photokatalytische Anwendungen und Elektrokeramik, werden ausschließlich im Sulfatverfahren hergestellt.
Das Chloridverfahren gilt oft als umweltfreundlicher. Diese Bewertung konzentriert sich auf die Menge der vor Ort in der Titandioxidanlage anfallenden Abfälle, ohne Abfälle aus der Rohstoffaufbereitung.
Einige große Sulfatanlagen haben ein vollständiges Recycling schwacher Säuren erreicht, und die meisten oder alle eisenhaltigen Nebenprodukte werden verkauft oder verarbeitet. Im Gegensatz dazu werden Abfälle aus vielen Chloridanlagen weiterhin auf Deponien oder in Tiefbrunnen entsorgt.
| Pigmentklasse | TiO2 (min.), Gew.-% | Wasserlösliche Salze, Gew.-% | Flüchtige Stoffe (max.), Gew.-% |
|---|---|---|---|
| Anatas A 1 (Typ A) | 98 | 0,6 | 0,5 |
| Anatas A 2 | 92 | 0,5 | 0,8 |
| Rutil R 1 (Typ R) | 97 | 0,6 | 0,5 |
| Rutil R 2 | 90 | 0,5 | 1,5 |
| Rutil R 3 | 80 | * | * |
4. Abfallmanagement bei der Titandioxidproduktion
4.1. Wässrige Abfälle
Das Sulfatverfahren verbraucht je nach Rohstoff 2,4–3,5 Tonnen konzentrierte Schwefelsäure pro Tonne produziertem Titandioxid. Während der Verarbeitung wandelt sich ein Teil der Schwefelsäure in Sulfate um, hauptsächlich Eisen(II)-sulfat. Die verbleibende Schwefelsäure fällt als freie Schwefelsäure (schwache Säure) an.
Fraktionierte Filtration und Wäsche der Hydrolysatsuspension ergeben 70–95 Gew.-% SO42- in einer schwachen Säurefraktion, die etwa 20–25 % freie Säure enthält. Die verbleibenden 5–30 % Sulfat werden mit Waschwasser stark verdünnt.
Historisch war die direkte Einleitung von Säure in offene Gewässer oder Küstengewässer gängige Praxis. Das Problem der schwachen Säure löste erhebliche politische Kontroversen aus. Infolgedessen ordnete die Europäische Gemeinschaft die Einstellung der Einleitung schwacher Säuren in offene Gewässer bis 1993 an.
Europäische Titandioxidhersteller entwickelten verschiedene Abwasserbehandlungsverfahren, um die Umweltvorschriften einzuhalten. Zu den wichtigsten Verfahren gehören die Gipsfällung aus schwachen Säuren sowie die Konzentration/Rückgewinnung von freier und gebundener Säure.
Im Gipsverfahren wird das saure Abwasser zunächst mit fein verteiltem CaCO3 behandelt, um Weißgips auszufällen. Dieser wird gefiltert, gewaschen und getrocknet und anschließend zur Herstellung von Gipsplatten verwendet. In einem zweiten Schritt werden die im Filtrat verbleibenden Metallsulfate zusammen mit weiterem Gips durch Zugabe von Calciumhydroxid als Metallhydroxide ausgefällt. Dieses Gemisch, der sogenannte Rotgips, muss deponiert werden.
Auch die Herstellung von Eisenoxidpigmenten aus Eisensulfatlösung, die nach teilweiser Neutralisation schwacher Säuren mit CaCO3 oder metallischem Eisen gewonnen wird, wurde vorgeschlagen.
Im Recyclingprozess können sowohl freie als auch gebundene Schwefelsäure (als Metallsulfate) aus schwacher Säure durch Konzentration und thermisches Cracken in einem Wirbelschichtofen gewonnen werden (k, Abbildung 3). Der Prozess umfasst zwei Stufen:
- Konzentration und Rückgewinnung der freien Säure durch Verdampfung.
- Abtrennung und thermische Zersetzung der Metallsulfate und Schwefelsäureherstellung aus dem entstehenden Schwefeldioxid.
Aus Energiegründen ist nur Säure mit einem Schwefelsäuregehalt von über 20 % durch Verdampfung wirtschaftlich rückgewinnbar. Schwache Säure wird mit minimalem Wärmebedarf von ca. 20–25 % auf ca. 28 % konzentriert, indem Abwärme aus der Schwefelsäureproduktion im Kontaktprozess oder aus den Abgasen von Titandioxid-Kalzinierungsöfen genutzt wird.
Nach der Vorverdampfung erfolgt die weitere Konzentration in Vakuumverdampfern. Der Wasserdampfdruck nimmt mit steigender H2SO4-Konzentration stark ab. Durch Eindampfen entsteht eine Suspension von Metallsulfaten in 60–70 %iger Schwefelsäure (Stufe 1 in Abbildung 3).
Die Suspension wird in einer Reihe von Rührbehältern (Stufe 2, d) auf 40–60 °C abgekühlt, um ein Produkt mit guten Filtereigenschaften und eine für den Aufschlussprozess geeignete Säure zu erhalten. Die Filtration (Stufe 3, e) erfolgt üblicherweise mit Druckfiltern, um einen Filterkuchen mit geringem Restflüssigkeitsgehalt zu erhalten.
Die Konzentrationsanforderungen der in den Aufschlussprozess zurückgeführten Säure hängen von der Qualität der titanhaltigen Rohstoffe ab. Bei Rohstoffen mit hohem Titangehalt muss die von den Metallsulfaten abgetrennte 65–70 %ige Schwefelsäure weiter auf 80–87 %ige Säure (Stufe 5) konzentriert werden.
Die Konzentration kann in dampfbeheizten Vakuumverdampfern erfolgen. Alternativ kann die Wärme aus Titandioxid-Kalzinierungsöfen genutzt werden. Durch Abkühlen der Säure nach diesem Konzentrationsprozess entsteht eine Metallsulfatsuspension in Schwefelsäure. Diese Säure kann direkt für den Rohstoffaufschluss verwendet werden.
Die in Stufe 3 (üblicherweise durch Filtration, daher auch „Filtersalz“) aus der Schwefelsäure gewonnenen und abgetrennten Metallsulfate enthalten etwa 15–30 % Schwefelsäure mit einer Konzentration von 60–70 %. Sie können durch Reaktion mit Calciumverbindungen in ein entsorgbares Material umgewandelt werden.
Die thermische Zersetzung von Metallsulfaten zu Metalloxiden, Schwefeldioxid, Wasser und Sauerstoff ist energieintensiv, jedoch ökologisch vorteilhaft. Der Energiebedarf beträgt ca. 4 × 109 J pro Tonne Filterkuchen. Die thermische Zersetzung erfolgt bei 850–1100 °C in einem Wirbelschichtofen (Stufe 6).
Die Energie wird durch Kohle, Pyrit oder Schwefel bereitgestellt. Das bei der thermischen Zersetzung entstehende Schwefeldioxid wird nach Standardverfahren gereinigt, getrocknet und in Schwefelsäure oder Oleum umgewandelt. Diese reine Säure bzw. dieses Oleum wird mit rückgewonnener Schwefelsäure vermischt und im Aufschlussprozess eingesetzt.
Die durch thermische Zersetzung erzeugten Metalloxide enthalten alle ursprünglich im Rohstoff vorhandenen Elemente mit Ausnahme des in Pigmente umgewandelten Titans. Dieses Metalloxidgemisch, hauptsächlich Eisenoxid, kann als Zusatzstoff in Baustoffen oder der Zementindustrie eingesetzt werden.
Die steigende Nachfrage nach umweltfreundlichen Industrieprozessen hat die Entwicklung von Techniken vorangetrieben, mit denen die 5–30 % Sulfat, die in saurem Waschwasser verbleiben, recycelt werden können. Moderne Verfahren können bis zu 99 % der Schwefelsäure in der Produktion zurückgewinnen und wiederverwenden.
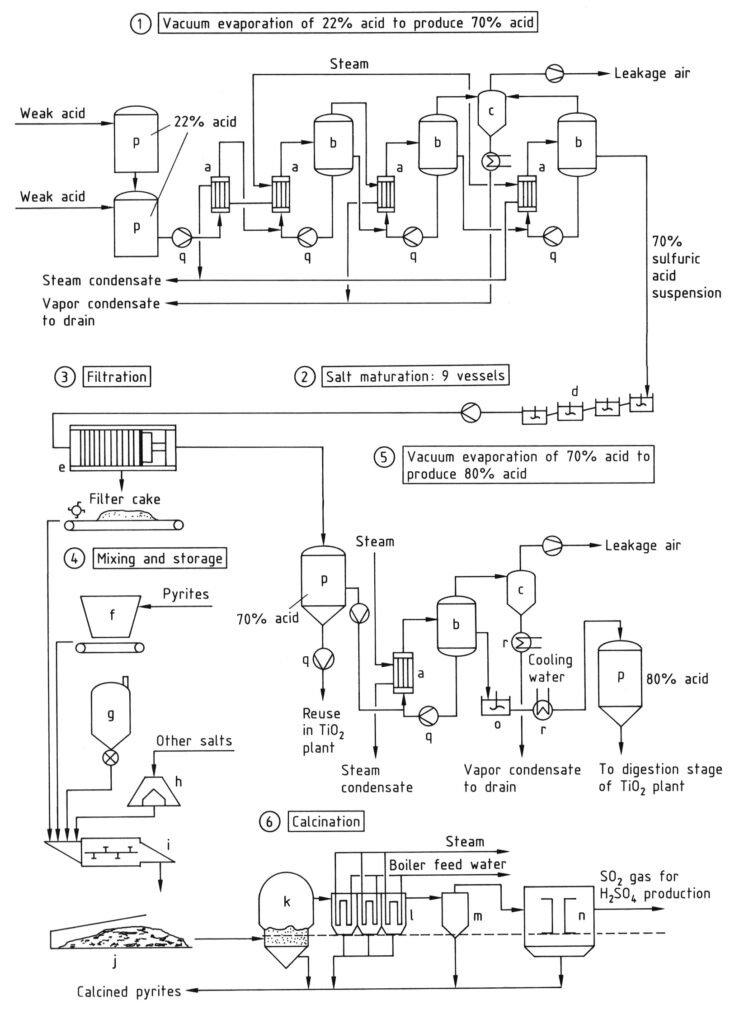
a) Wärmetauscher; b) Verdampfer; c) Einspritzkondensator; d) Rührwerks-Reifebehälter; e) Filterpresse; f) Bunker für Pyrit; g) Kohlensilo; h) Bunker; i) Mischschneckeneinheit; j) Abgedeckter Lagerraum für gemischten Filterkuchen; k) Kalzinierofen; l) Abhitzekessel; m) Zyklon; n) Elektrofilter; o) Rührbehälter; p) Lagertank; q) Pumpe; r) Kühler
4.2. Feste Abfälle
Feste Rückstände aus der Aufschlussreaktion werden nach der Neutralisation häufig entsorgt. In den 1990er Jahren begann man, diese Rückstände als Titanquelle in Hochöfen zu verwenden, um die Innenauskleidung zu stabilisieren und die Lebensdauer des Hochofens zu verlängern. Weitere mögliche Verwendungsmöglichkeiten sind Asphaltfüller (als Kalksteinersatz), Deponieabdeckung oder Baumaterial. Auch Anwendungen als Schleifmittel wurden vorgeschlagen.
Eisensulfatheptahydrat (FeSO4·7 H2O, Kupfersulfat), das aus der Kristallisation und Trennung von Schwarzlauge oder schwacher Säure gewonnen wird, wird hauptsächlich zur Wasserreinigung, Abwasserbehandlung und als Rohstoff für Eisenoxidpigmente verwendet.
Seit 1980 wird FeSO4·7 H2O in Skandinavien als Chromatreduzierer in Zement eingesetzt. FeSO4·H2O, Monohydrat (aus der thermischen Trocknung von Heptahydrat), hat aufgrund seiner ungünstigen Leistung und Kosten keine größere Verwendung gefunden.
Metallsulfate (Filtersalz), die durch Filtration aus schwacher Säure nach der Konzentrierung gewonnen wurden (Hauptbestandteil: Eisen(II)-sulfat in reiner Monohydratform), wurden viele Jahre lang in der Düngemittelherstellung, beim thermischen Cracken zur Schwefelsäureproduktion oder auf Deponien eingesetzt.
Filtersalz wurde erstmals 2003 als Chromatreduktionsmittel vorgeschlagen. In der Folge untersuchten und meldeten große europäische Titandioxidhersteller zahlreiche Patente zu verschiedenen Aspekten der Verwendung von Filtersalzderivaten als Chromatreduktionsmittel an.
Filtersalz weist hervorragende Eigenschaften wie Rheologie, Hitzebeständigkeit und Langzeitstabilität auf und kann direkt in Zementmühlen eingesetzt werden. Daher werden in der Zementindustrie zunehmend aufbereitetes Filtersalz (z. B. neutralisiert mit Kalkstein) als Cr6+-Reduktionsmittel eingesetzt.
Diese Entwicklungen sowie die steigende Nachfrage nach Chromatreduzierern für Zement aufgrund der EU-Gesetzgebungsänderungen von 2005 machten Eisensulfatabfälle von einem unerwünschten Material zu einem kommerziellen Produkt.
Beim Chloridverfahren können Abwasserprobleme auftreten, insbesondere wenn der Rohstoff weniger als 90 % Titandioxid enthält. Metallchloridnebenprodukte werden manchmal in Lösung mittels Tiefbrunneninjektion entsorgt.
Metallchloridlösungen werden über tiefe Bohrungen in poröse geologische Schichten gepumpt. Spezielle geologische Formationen sind notwendig, um eine Grundwasserkontamination durch Verunreinigungen zu verhindern.
Auch für das Chloridverfahren gelten zunehmende Einschränkungen. Es gibt Bemühungen, Eisenchloridnebenprodukte beispielsweise in der Wasseraufbereitung und als Flockungsmittel zu nutzen. Ein Verfahren, bei dem Metallchloride mit Zement und alkalischen Verbindungen behandelt werden, um gesteinsartige Zuschlagstoffe für den Straßenbau herzustellen, wurde vorgeschlagen.
Eine weitere Methode ist die Umwandlung von Eisenchlorid in Eisenoxid mittels Ruthner-Verfahren unter Rückgewinnung von Salzsäure. Bis vor Kurzem mussten viele Chlorid-Prozessanlagen ihre Metallchlorid-Abfälle neutralisieren und anschließend das entstehende Eisenhydroxid entsorgen.
4.3. Abgas
Die Gase aus dem Kalzinierungsofen werden in einem Wärmetauscher gekühlt. Mitgeführtes Titandioxidpigment wird entfernt, gewaschen und dem Prozess wieder zugeführt. Die bei der Kalzinierung entstehenden SO2 und SO3 können anschließend aus den Gasen ausgewaschen werden, um verdünnte Schwefelsäure zu bilden, die wiederverwendet wird.
Referenzen
- Pigments, Inorganic, 2. White Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n01.pub2
- Production of titanium dioxide. – https://ena-norm.eu/wp-content/uploads/2024/04/V.pl_.3.pdf
- A new method for production of titanium dioxide pigment. – https://www.sciencedirect.com/science/article/abs/pii/S0304386X12002423
- A Review of the Production Cycle of Titanium Dioxide Pigment. – https://www.scirp.org/journal/paperinformation?paperid=46456
- Titanium Dioxide. – https://www.ncbi.nlm.nih.gov/books/NBK524874/
- Process for manufacturing titanium dioxide pigments using ultrasonication. – https://patents.google.com/patent/US9353266B2/en
- Process for manufacturing titanium dioxide. – https://patents.google.com/patent/US4288418A/en
- An updated review of industrially relevant titanium dioxide and its environmental health effects. – https://www.sciencedirect.com/science/article/pii/S2666911023000114
