Herstellung von wasserfreiem Natriumhydroxid
Wasserfreies Natriumhydroxid

Festes Natriumhydroxid, auch Natronlauge genannt, wird durch Eindampfen der Natronlauge gewonnen, bis der Wassergehalt unter 0,5 – 1,5 Gew.-% fällt.
Die effizienteste Energienutzung wird mit mehrstufigen Anlagen erreicht, wie das Flussdiagramm einer von Bertrams in Basel, Schweiz, errichteten Anlage zeigt (Abbildung 1).
In der ersten Stufe wird eine 50 Gew.-%ige Lösung in einer Vorkonzentrationseinheit unter Nutzung der Dampfwärme des Hauptkonzentrators vakuumverdampft, bis die Konzentration etwa 60 Gew.-% erreicht.
In der zweiten Stufe wird durch Erhitzen der Lösung mit einem geschmolzenen Salzwärmeträgermedium (NaNO2 – NaNO3 – KNO3) auf Temperaturen über 400 °C in einem Fallfilmverdampfer eine Konzentration von ca. 99 Gew.-% erreicht.
Das konzentrierte Produkt wird dann einem Flash-Verdampfer zugeführt, der als Gasliftpumpe arbeitet, wo geschmolzenes NaOH durch Vakuum in ein beheiztes Steigrohr befördert wird, wodurch das restliche Wasser verdampft. Die Dampfblasen heben das geschmolzene NaOH an den höchsten Punkt des Systems, wo der Dampf abgepumpt wird.
Die nahezu wasserfreie Schmelze gelangt über ein Fallrohr in den Vorratsbehälter und wird von dort zur Aufbereitungsanlage gepumpt.
Um eine vorzeitige Kristallisation zu verhindern, müssen der Vorratsbehälter, die Pumpen und die Rohre beheizt werden.
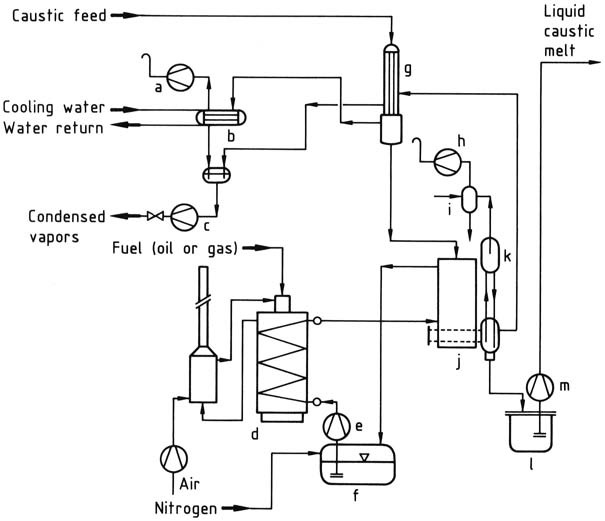
a) Vakuumpumpe; b) Kondensator; c) Kondensatpumpe; d) Ofeneinheit; e) Salzschmelzpumpe; f) Beheizter Salzschmelztank; g) Vorkonzentrationseinheit; h) Vakuumpumpe; i) Kondensator; j) Fallfilmkonzentrator; k) Flash-Verdampfer; l) Beheizter Natronschmelztank; m) Laugenschmelzpumpenformung
Bildung
Um ein Zusammenbacken durch nicht erstarrtes Monohydrat zu verhindern, muss die Abkühlung und Erstarrung der NaOH-Schmelze schnell erfolgen und dabei sowohl den Erstarrungspunkt von NaOH (322 °C) als auch den des Monohydrats NaOH · H2O (62 °C) überschreiten.
Auf dem Markt sind verschiedene Formen von festem Natriumhydroxid erhältlich, z. B. Flocken, Prills, Gussblöcke, Tabletten, Briketts und Granulat.
Flocken haben eine Dicke von ca. 1,5 mm, einen Durchmesser von 5 – 20 mm und eine Schüttdichte von ca. 0,9 kg/dm3. Sie neigen dazu, leicht zu brechen, was bei der Handhabung zu Staubbildung führt.
Die Schüttdichte der Prills liegt über 1 kg/dm3 und sie haben die Form von Kugeln mit einem Durchmesser von 0,1 – 0,8 mm (Mikroprills) oder 0,5 – 2,5 mm.
1. Flocken

Bei der Herstellung von Flocken wird geschmolzenes NaOH in einen Trog geleitet, der eine teilweise eingetauchte, innen gekühlte Trommel enthält, die rotiert. Die geschmolzene Substanz erstarrt auf der Trommeloberfläche und wird dann mit einem Messer abgeschabt.
Die resultierende NaOH-Schicht wird in Flocken gebrochen, die dann zu einem Zwischenlagersilo transportiert werden. Um Brückenbildung zu vermeiden, wird das Material in kleinen Silos gelagert und schnellstmöglich in Säcke oder Stahlfässer verpackt.
2. Prillen
Prills werden hergestellt, indem geschmolzenes NaOH bei etwa 360 °C versprüht wird, um Tröpfchen zu erzeugen. Mithilfe einer rotierenden Scheibe oder eines rotierenden Korbs werden diese fein verteilten Tröpfchen erzeugt, die aufgrund der Oberflächenspannung gleichmäßige Kugeln bilden.
Während die Prills durch einen Schacht fallen, wird Luft nach oben geblasen, um sie auf etwa 250 °C abzukühlen. Das fertige Produkt wird in einem Trichter gesammelt und in eine Kühltrommel überführt, wo es auf etwa 50 °C abgekühlt wird.
Prills neigen weniger zum Zusammenbacken als Flocken, sind rieselfähig und nahezu staubfrei, was sie ideal für die Lagerung und den Transport in Silos oder Containern macht.
3. Gussblöcke
Bei Gussblöcken wird geschmolzenes NaOH direkt in Eisenfässer oder ähnliche Behälter gegossen. Um eine weitere Kontamination durch Eisen zu verhindern, werden die Fässer von außen mit einem Wasserstrahl gekühlt, der sofort einen festen Natriumhydroxidfilm an den Behälterwänden bildet.
4. Sonderformen
Tabletten, Pillen oder Pellets werden im Tröpfchenverfahren hergestellt, bei dem geschmolzenes NaOH aus einem speziellen Gerät aus Silber auf einen langsam rotierenden, gekühlten Tisch oder ein Förderband getropft wird.
Bei diesem Verfahren entsteht ein Produkt mit einem geringen Gehalt an metallischen Verunreinigungen, was es ideal für die Herstellung kleiner Mengen für analytische Zwecke macht.
Referenz
- „Sodium Hydroxide“. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.- https://onlinelibrary.wiley.com/doi/10.1002/14356007.a24_345.pub2
