Benzolsulfonsäure: Herstellung, Reaktionen und Verwendungen

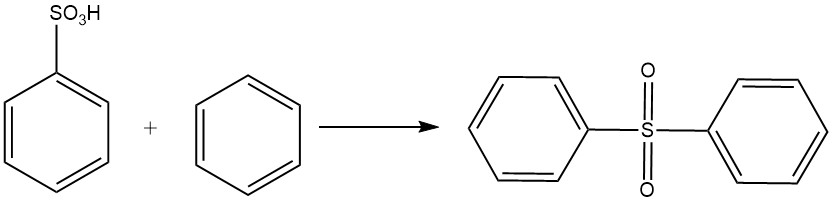
Benzolsulfonsäure ist eine chemische Verbindung mit der Formel C6H5SO3H und einem Molekulargewicht von 158,17 g/mol. Es wurde erstmals 1834 von E. Mitscherlich durch die Reaktion von Benzol und konzentrierter Schwefelsäure synthetisiert, wobei Benzolsulfonsäure und Diphenylsulfon entstanden.
Eine bemerkenswerte industrielle Anwendung von Benzolsulfonsäure ist die Herstellung von Phenol durch Alkalifusion, eine Reaktion, die 1867 von A. Wurtz und A. Kekulé entwickelt und später 1878 von P. O. Degener verfeinert wurde.
Historisch gesehen spielte Benzolsulfonsäure eine wichtige Rolle bei der Phenolproduktion. In jüngster Zeit haben jedoch alternative Phenolsynthesemethoden in industriellen Prozessen an Bedeutung gewonnen.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Benzolsulfonsäure
Durch die Kristallisation von Benzolsulfonsäure aus einer wässrigen Lösung entsteht ein Hydrat mit 1,5 Wassermolekülen, wodurch zerfließende Nadeln mit einem Schmelzpunkt von 43–44 °C entstehen. Das Monohydrat hat einen Schmelzpunkt von 45–46 °C.
Die wasserfreie Säure ist bei 171–172 °C (0,13 mbar) ohne Zersetzung destillierbar. Es zeigt eine hohe Löslichkeit in Wasser und Ethanol, eine mäßige Löslichkeit in Benzol und eine Unlöslichkeit in Diethylether und Schwefelkohlenstoff.
Natriumbenzolsulfonat zersetzt sich bei etwa 450 Grad Celsius. Es ist in 1,75 Teilen Wasser bei 30 °C und 0,8 Teilen kochendem Wasser löslich. Durch Kristallisation aus wässrigen Lösungen entsteht das Salz mit einem Mol Kristallwasser. Auch die Calcium- und Bariumsalze sind wasserlöslich.
| Eigenschaft | Wert |
|---|---|
| Aussehen | Weiße zerfließende Kristalle oder wachsartiger Feststoff |
| Molekulargewicht | 158,17 g/mol |
| Dichte | 1,48 g/cm³ |
| Schmelzpunkt (Hydrat) | 43-44 °C |
| Schmelzpunkt (Monohydrat) | 45-46 °C |
| Schmelzpunkt (wasserfrei) | 65-66 °C |
| Siedepunkt | 274 °C (zersetzt sich) |
| Destillationspunkt (wasserfrei) | 171-172 °C (0,13 mbar) |
| Flammpunkt | 113 °C |
| Löslichkeit in Wasser | Hoch |
| Löslichkeit in Alkohol | Hoch |
| Löslichkeit in Benzol | Mäßig |
| Löslichkeit in Diethylether | Unlöslich |
| Löslichkeit in Schwefelkohlenstoff | Unlöslich |
| Dielektrizitätskonstante (wässrige Lösung) | 0,2 |
| pKa | −2,8 |
| Geruch | Stechend |
| Zersetzungstemperatur (Natriumbenzolsulfonat) | 450 °C |
| Löslichkeit von Natriumbenzolsulfonat in Wasser | 1,75 Teile bei 30 °C 0,8 Teile bei Siedetemperatur |
| Löslichkeit von Calcium- und Bariumsalzen in Wasser | Wasserlöslich |
| Gefahren | Ätzend auf Augen, Haut und Atemwege |
2. Chemische Reaktionen von Benzolsulfonsäure
Benzolsulfonsäure zeigt typische Reaktionen einer starken aromatischen Sulfonsäure. Saure Hydrolyse bei 175 °C ergibt Benzol und Schwefelsäure.

Durch weitere Sulfonierung mit rauchender Schwefelsäure entsteht 1,3-Benzoldisulfonsäure, die in 1,3,5-Benzoltrisulfonsäure und Diphenylsulfondisulfonsäure umgewandelt werden kann.

Benzolsulfonsäure reagiert mit Benzol in einer Friedel-Crafts-Reaktion zu Diphenylsulfon.
Benzolsulfonsäure reagiert mit alkalischem Natriumhydroxid bei 320–350 °C zu Natriumphenolat gemäß der folgenden Gleichung:
C6H5SO3Na + 2 NaOH → C6H5ONa + Na2SO3 + H2O
Diese Reaktion bildete die Grundlage für die erste industrielle Produktion von Phenol.

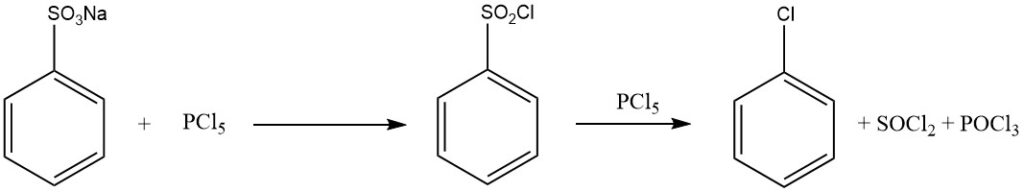
Die Behandlung von Benzolsulfonsäure mit Phosphorhalogeniden (PCl5 , PBr5), Chlorschwefelsäure, Thionylchlorid oder Phosgen ergibt Sulfonylhalogenide:
C6H5SO2OH + PCl5 → C6H5SO2Cl + POCl3 + HCl
Bei Verwendung eines PCl5 -Überschusses entsteht Chlorbenzol nach:
C6H5SO2Cl + PCl5 → C6H5Cl + SOCl2 + POCl3
Benzolsulfonsäureanhydrid wird durch Reaktion von Benzolsulfonsäure mit P2O5, SOCl2, oder SO3 synthetisiert. Es kann auch als Nebenprodukt bei der Herstellung von Benzolsulfonsäure oder Benzolsulfonylchlorid entstehen. Aufgrund ihrer schnellen Hydrolyse in wässriger Säure werden sie in diesen Fällen jedoch häufig nicht beobachtet.

Benzolsulfonsäureester entstehen durch die Reaktion von Sulfonsäure oder Sulfonylchloriden mit Alkoholen oder Ethern.
3. Herstellung von Benzolsulfonsäure
Benzolsulfonsäure entsteht durch eine exotherme Reaktion zwischen Benzol und Schwefelsäure, wie durch die Gleichung beschrieben:
C6H6 + H2SO4 → C6H5SO3H + H2O

CROOKS und WHITE untersuchten diese Reaktion und untersuchten den Einfluss der Temperatur und der Zusammensetzung der Sulfonierungsmischung auf die Reaktionsgeschwindigkeit. Es ist zu beachten, dass die Reaktion bei einer bestimmten Schwefelsäurekonzentration endet, typischerweise zwischen 74 und 78 %, je nach Temperatur und Wasserbildung.
Im industriellen Umfeld bleibt ein Teil der Schwefelsäure (im klassischen Verfahren meist 45 %) unumgesetzt und dient als Lösungs- und Verdünnungsmittel. Dies begrenzt die Bildung von Nebenprodukten, insbesondere Diphenylsulfon, auf eine geringe Ausbeute. Überschüssige Säure kann industriell durch Zugabe von Calciumcarbonat entfernt werden.
Um überschüssige Schwefelsäure zu reduzieren und die Sulfonbildung zu steigern, wurden verschiedene Methoden eingesetzt:
- Verwendung von Oleum oder Schwefeltrioxid anstelle von Schwefelsäure.
- Extrahieren von Benzolsulfonsäure aus der Reaktionsmischung mit Benzol.
- Reaktionswasser azeotrop mit Benzol entfernen.
A. Der klassische Prozess umfasste die Sulfonierung von Benzol zur Herstellung von Benzolsulfonsäure, die in der Phenolsynthese verwendet wurde. Anschließend wurde das gebildete Nebenprodukt Sulfit zur Neutralisierung von Benzolsulfonsäure verwendet. Dieser Vorgang ist nur von historischem Interesse.
B. Ein modernerer Ansatz ist die kontinuierliche Sulfonierung mit Oleum, auch bekannt als Monsanto-Verfahren. Dabei werden Benzol und Oleum in eine Kaskade aus sechs Sulfonierungsbehältern gepumpt. Diese durch Überlaufrohre verbundenen Gefäße ermöglichen den Fluss der Reaktionsmischung von einem zum nächsten.
Die ersten beiden Gefäße werden gekühlt, während die anderen beheizt werden. Durch Neutralisieren der Reaktionsmischung mit Natriumsulfit oder Natronlauge wird überschüssige Schwefelsäure entfernt. Natriumsulfat fällt aus und kann in Zentrifugen abgetrennt werden. Die resultierende Natriumbenzolsulfonatlösung kann konzentriert und direkt in Phenol umgewandelt oder getrocknet werden.
Bei diesem Verfahren wird Oleum mit 35,6 % Schwefeltrioxid verwendet und bestimmte Temperaturbedingungen eingehalten. Dabei wird nur etwa 1 % des Benzols in Diphenylsulfon umgewandelt.
C. Eine weitere Methode ist der kontinuierliche Extraktionsprozess, bei dem überschüssiges Benzol und Schwefeltrioxid unter kräftigem Rühren in ein Gefäß eingebracht werden. Im oberen Teil des Behälters bildet sich eine mit Benzolsulfonsäure gesättigte Benzolschicht, die in einem zweiten Rührbehälter kontinuierlich mit Wasser oder Natronlauge gewaschen wird.
Das abgetrennte Benzol kann in den Reaktionsbehälter zurückgeführt werden. Dabei beträgt der Schwefelsäureverbrauch pro 1000 kg umgesetztes Benzol 1260 kg und die Diphenylsulfonbildung liegt unter 2 %.
D. Bei der Methode der azeotropen Entfernung von Reaktionswasser wird Schwefelsäure mit einer Konzentration von beispielsweise 79 % auf 170 °C in einem Sulfonierungsgefäß erhitzt und fein verteilter Benzoldampf eingeleitet.
Dieser Prozess sulfoniert einen Teil des Benzoldampfes, während der nicht umgewandelte Teil kontinuierlich Wasser aus der Reaktionsmischung entfernt. Das kondensierte Gemisch aus Benzol und Wasserdampf kann getrennt werden und das Benzol wird in den Verdampfer zurückgeführt.
Der kontinuierliche Betrieb dieses Prozesses ergibt ein Endprodukt mit 80,2 % Benzolsulfonsäure und 14,3 % Schwefelsäure, während der diskontinuierliche Betrieb ein Endprodukt mit 93,1 % Sulfonsäure und 4,8 % Schwefelsäure ergibt. Durch die Zugabe von Natriumbenzolsulfonat zur Sulfonierungsmischung kann die Sulfonbildung unter 2 % gehalten werden.
4. Verwendung von Benzolsulfonsäure
Benzolsulfonsäure wird für verschiedene Anwendungen in verschiedenen Industrien wie folgt verwendet:
Phenolproduktion: Benzolsulfonsäure wird zur Herstellung von Phenol durch Fusion mit Natriumhydroxid oder Hydrolyse seiner Salze, typischerweise des Natriumsalzes, verwendet.
Tensidsynthese: Benzolsulfonsäure ist eine Schlüsselkomponente bei der Herstellung von Tensiden, insbesondere in Kombination mit Metall- oder Aminsalzen. Salze der Benzolsulfonsäure, wie Natriumbenzolsulfonat (Ludigol) und Monoethanolaminbenzolsulfonat, werden als Tenside in Waschmittelformulierungen eingesetzt.
Synthese pharmazeutischer Arzneimittel: Benzolsulfonsäure ist an der Synthese pharmazeutischer Arzneimittel beteiligt, bei der diese Arzneimittel als Benzolsulfonatsalze hergestellt werden. Diese Salze werden unter dem International Nonproprietary Name als Besilate oder unter dem United States Adopted Name als Besylate bezeichnet.
Säurekatalysator: Die saure Natur von Benzolsulfonsäure macht sie als Säurekatalysator bei verschiedenen chemischen Reaktionen wertvoll.
Farbstoffstandardisierung: Das Natriumsalz der Benzolsulfonsäure spielt eine Rolle bei der Standardisierung von Farbstoffen und gewährleistet die Genauigkeit von Färbeprozessen.
Surfactant-enhanced Oil Recovery (SEOR): Benzolsulfonsäure ist bei der SEOR von wesentlicher Bedeutung, einer Technik, bei der Tenside eingesetzt werden, um die Gewinnung von Öl aus Lagerstätten zu erleichtern, was auch als Surfactant Flushing bezeichnet wird.
5. Toxikologie von Benzolsulfonsäure
Tödliche Dosis 50 (LD50) bei Ratten (oral): 1170 Milligramm pro Kilogramm
Kurzfristige Expositionseffekte:
Benzolsulfonsäure ist eine ätzende Substanz, die schwere Schäden an Augen, Haut und Atemwegen verursachen kann. Es ist außerdem ätzend, wenn es verschluckt wird.
Symptome einer Exposition:
Einatmen: Husten, Halsschmerzen, Kurzatmigkeit, Atembeschwerden, Brennen, Kopfschmerzen, Übelkeit
Haut: Rötung, Brennen, Schmerzen, Hautverbrennungen
Augen: Rötung, Schmerzen, schwere tiefe Verbrennungen
Verschlucken: Halsschmerzen, Brennen im Hals und in der Brust, Bauchschmerzen, Schock oder Kollaps
Verweise
- Benzenesulfonic Acids and Their Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_507
- BENZENESULFONIC ACID – ILO
- https://www.acs.org/molecule-of-the-week/archive/b/benzenesulfonic-acid.html
- https://en.wikipedia.org/wiki/Benzenesulfonic_acid
- Benzenesulfonic Acid (Surfactant)
