Butadiene: proprietà, reazioni, produzione e usi
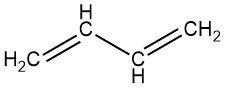
Il 1,3-butadiene è un gas incolore con un odore simile alla benzina. È il membro più semplice della serie di dieni coniugati, che contengono la struttura C=C-C=C, dove C è il carbonio.
Il butadiene si riferisce in genere al 1,3-butadiene [106-99-0], un idrocarburo C4 insaturo altamente significativo. La sua controparte termodinamicamente meno stabile, 1,2-butadiene [590-19-2], ha una rilevanza industriale trascurabile.
- 1,3-butadiene: CH2=CH–CH=CH2
- 1,2-butadiene: CH2=C=CH–CH3
Il butadiene è un prodotto petrolchimico cruciale, con una produzione globale che supera i 10 milioni di tonnellate all’anno.
Sommario
1. Proprietà fisiche del butadiene
Il butadiene è un gas incolore in condizioni normali. Alcune proprietà fisiche sono riassunte nella seguente tabella:
| Proprietà | Valore |
|---|---|
| Formula chimica | C4H6 |
| Massa molare | 54,09 g/mol |
| Punto di ebollizione | -4,4 °C |
| Punto di fusione | -108,9 °C |
| Temperatura critica | 425 K |
| Pressione critica | 4,32 MPa |
| Volume molare critico | 221 cm³/mol |
| Densità (liquido, 0 °C) | 0,646 g/cm³ |
| Densità (liquido, 25 °C) | 0,616 g/cm³ |
| Densità (liquido, 50 °C) | 0,582 g/cm³ |
| Densità del gas (relativo all'aria) | 1,87 |
| Pressione di vapore (-4,4°C) | 101,3 kPa |
| Pressione di vapore (0 °C) | 120,0 kPa |
| Pressione di vapore (25 °C) | 273,6 kPa |
| Pressione di vapore (50 °C) | 537,9 kPa |
| Pressione di vapore (75 °C) | 986,7 kPa |
| Pressione di vapore (100 °C) | 1733 kPa |
| Viscosità (liquido, 0 °C) | 0,25 mPa·s |
| Viscosità (liquido, 50 °C) | 0,20 mPa·s |
| Entalpia di vaporizzazione (25 °C) | 20,86 kJ/mol |
| Entalpia di vaporizzazione (-4,4 °C) | 22,47 kJ/mol |
| Entalpia di formazione (gassoso, 298 K, 101,3 kPa) | 110,0 kJ/mol |
| Entalpia libera di formazione (gassoso, 298 K, 101,3 kPa) | 151,5 kJ/mol |
| Entalpia di combustione (gassoso, 298 K, 101,3 kPa) | 2541,5 kJ/mol |
| Entalpia di idrogenazione a butano (gassoso, 298 K, 101,3 kPa) | 235,7 kJ/mol |
| Entropia di formazione (liquido, 298 K, 101,3 kPa) | 199,0 J·mol⁻¹·K⁻¹ |
| Entalpia di fusione (164,2 K, 101,3 kPa) | 7,988 kJ/mol |
Il butadiene ha una solubilità limitata in acqua. È solubile in metanolo ed etanolo, ed è altamente solubile in solventi polari ad alto punto di ebollizione come il metilpirrolidone.
Diverse proprietà tecniche sono importanti per una manipolazione sicura del butadiene. Queste includono:
- Punto di infiammabilità: -85 °C
- Temperatura di accensione: 415 °C
Il butadiene non stabilizzato o non sufficientemente stabilizzato può reagire con l’ossigeno atmosferico per formare perossidi esplosivi.
2. Proprietà chimiche del butadiene
Il butadiene, che possiede due doppi legami coniugati, partecipa a diverse reazioni, tra cui addizioni 1,2 e 1,4 con se stesso (polimerizzazione) e altri reagenti, dimerizzazione lineare, trimerizzazione e formazione di anelli.
La reazione più significativa per il butadiene comporta la polimerizzazione tramite addizione 1,2 e 1,4, che porta a una varietà di polimeri. La natura di questi polimeri dipende dai metodi di preparazione e dal sistema di catalizzazione impiegato, con conseguenti gomme sintetiche e resine polimeriche di importanza industriale.
Il butadiene subisce addizione 1,2 o 1,4 con vari reagenti, con le proporzioni dei prodotti di addizione che dipendono dalle condizioni di reazione. Questi prodotti di addizione servono come intermedi cruciali nella produzione di sostanze come cloroprene ed esametilendiammina.
Reazioni specifiche
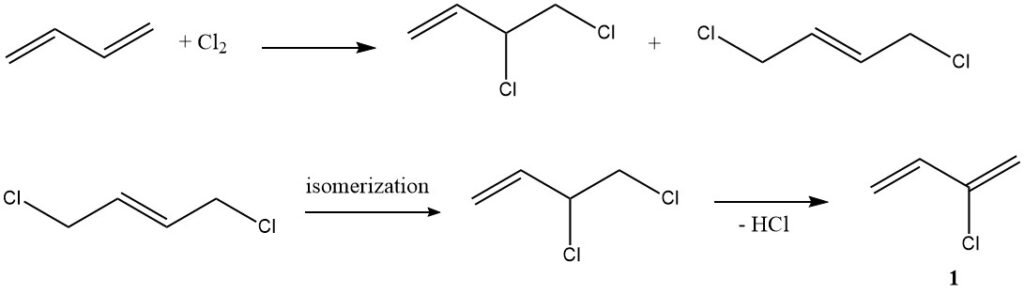
1. Clorurazione (produzione di cloroprene): in un tipico esempio di addizione elettrofila, il butadiene reagisce con il cloro per produrre cloroprene (1), un composto con molteplici applicazioni industriali.
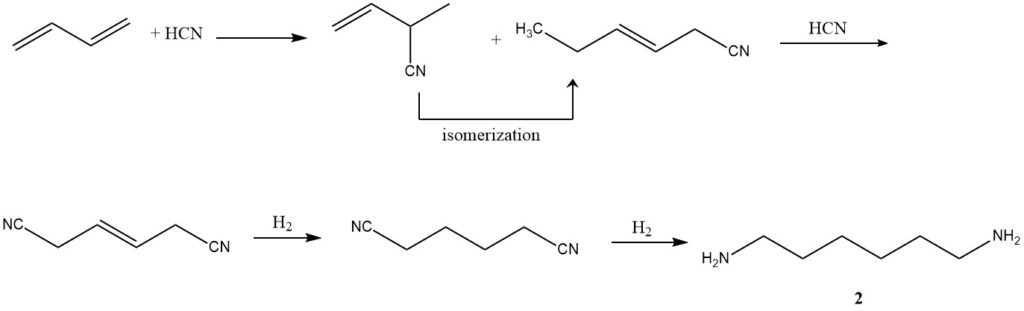
2. Idrocianurazione (Produzione di adiponitrile): Utilizzando un processo in tre fasi sviluppato da Du Pont, il butadiene subisce idrocianurazione per formare una miscela di nitrili di pentene isomerici lineari e ramificati. La successiva isomerizzazione e ulteriore idrocianurazione danno origine all’adiponitrile (2).
3. Carboalcossilazione (produzione di ε-caprolattame): DSM e Du Pont hanno esplorato un processo alternativo per la produzione di ε-caprolattame dal butadiene. Questo processo multi-step coinvolge carboalcossilazione, idroformilazione e amminazione riduttiva. Sebbene non sia ancora implementato su scala industriale, rappresenta una promettente strada per lo sviluppo futuro.
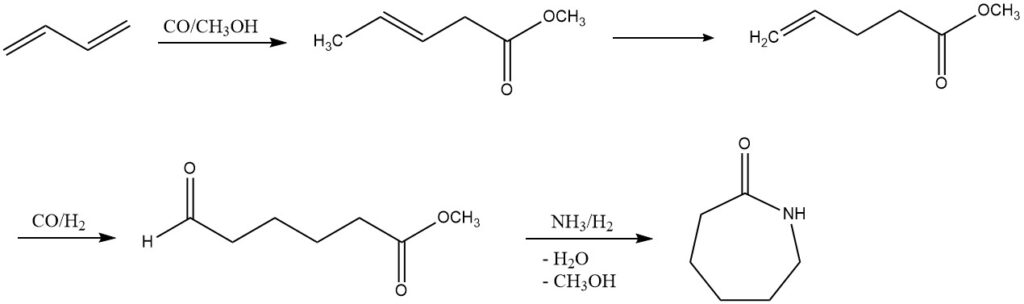
4. Acetossilazione (produzione di 1,4-butandiolo o tetraidrofurano): tramite acetossilazione, il butadiene porta alla sintesi di 1,4-diacetossi-2-butene, che, in un processo Mitsubishi in più fasi, viene convertito in 1,4-butandiolo o tetraidrofurano. Questi processi, sotto l’influenza di catalizzatori specifici, mostrano il potenziale per diverse trasformazioni chimiche.
5. Altre reazioni di ossidazione: processi innovativi, come il processo Toyo Soda e l’ossidazione diretta con aria o ossigeno, rappresentano metodi economici per la produzione di vari derivati C4. L’introduzione di 3,4-epossi-1-butene tramite ossidazione apre le porte alla creazione di preziosi intermedi chimici.
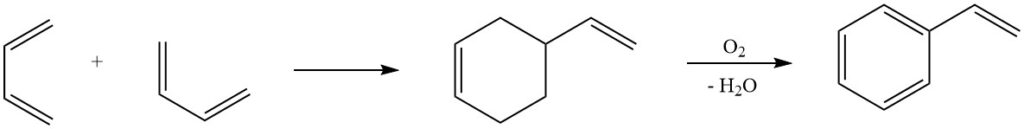
6. Reazione di Diels-Alder: una delle reazioni più note del butadiene, la reazione di Diels-Alder, svolge un ruolo cruciale nei processi industriali per la produzione di stirene. La dimerizzazione del butadiene e la successiva conversione in stirene evidenziano la versatilità di questa reazione nella sintesi di preziosi composti chimici.
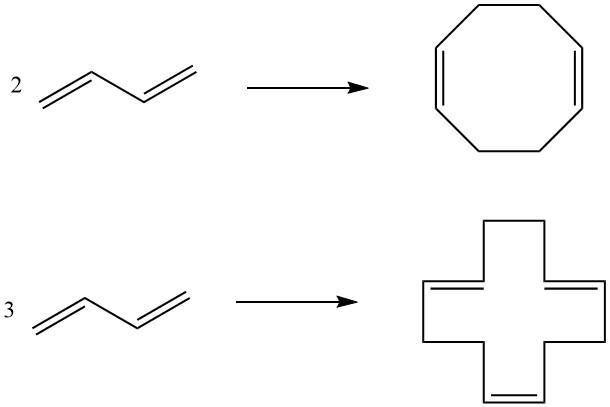
7. Ciclodimerizzazione, Ciclotrimerizzazione: due molecole di butadiene possono subire la ciclodimerizzazione per produrre 1,5-cicloottadiene, mentre tre molecole danno come risultato 1,5,9-ciclododecatriene. Questi composti ciclici, facilitati da catalizzatori specifici, servono come intermedi nella produzione di poliammidi superiori.
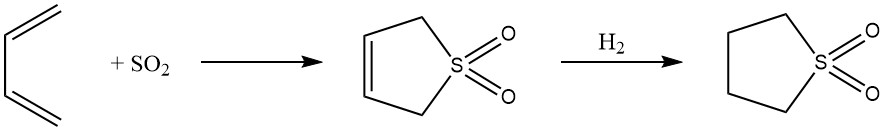
8. 1,4-Cicloaddizione: l’addizione 1,4 reversibile di butadiene con anidride solforosa porta alla formazione del solfone ciclico 2,5-diidrotiofene-1,1-diossido, ulteriormente convertito in solfolano. Questo processo mette in mostra l’adattabilità del butadiene nella sintesi di solventi altamente polari.
9. Dimerizzazione e trimerizzazione lineare; Telomerizzazione: sotto l’influenza di catalizzatori Ni, Co, Pd o Fe, il butadiene subisce una dimerizzazione o trimerizzazione lineare. Gli oligomeri lineari risultanti, separati in base alla lunghezza della catena, offrono composti diversi, come l’1,3,7-ottatriene.
La reazione di telomerizzazione è la di- e oligomerizzazione di un 1,3-diene con aggiunta di un composto nucleofilo. È catalizzata da Pd, Ni o Pt e produce un ampio spettro di prodotti a seconda del nucleofilo utilizzato.
10. Idrogenazione: l’idrogenazione selettiva del butadiene genera 1-butene o 2-butene e un’attenta regolazione delle condizioni di reazione assicura una conversione sufficiente senza sovra-idrogenazione in n-butano. I processi commerciali di aziende come Axens, UOP e Lummus forniscono approcci personalizzati per massimizzare la resa di specifici isomeri del butene.
11. Formazione di complessi: il butadiene forma complessi con vari composti metallici, come i sali di Cu(I). Sebbene storicamente utilizzato nell’estrazione del butadiene, le moderne tecniche di distillazione estrattiva hanno ampiamente sostituito questo metodo. I complessi con altri metalli di transizione come Fe, Ni, Co, Pd e Pt sono ben consolidati e contribuiscono agli studi meccanicistici nella catalisi della polimerizzazione delle alfa-olefine.
3. Produzione di butadiene
Storicamente, esistevano diversi metodi per la produzione di butadiene. Oggi, rimangono quattro percorsi principali:
- Cracking della nafta: Questo percorso dominante cattura il butadiene come sottoprodotto della produzione di etilene.
- Deidrogenazione del butano/butene: Questo processo svolge un ruolo minore, basato sulla campagna, a seconda delle materie prime e dei prezzi del butadiene.
- Produzione da etanolo: Questo metodo ha perso importanza.
- Produzione da acetilene: Questo percorso non è più commercialmente praticabile.
Sono in fase di esplorazione nuovi approcci basati sulla biologia.
L’economia della produzione di butadiene è fortemente influenzata dalla produzione accoppiata di etilene e propilene. Quando queste olefine C2 e C3 sono poco costose, la produzione dedicata di butadiene da buteni e butano diventa più attraente.
3.1. Produzione di butadiene dall’acetilene
Storicamente, per produrre butadiene dall’acetilene venivano impiegati due percorsi. Entrambi sono ormai obsoleti a causa della natura costosa e ad alta intensità energetica della produzione di acetilene. Solo i passaggi iniziali del processo Reppe, che portano a 1,4-butandiolo e tetraidrofurano, rimangono commercialmente rilevanti.
3.2. Produzione di butadiene dall’etanolo
Il processo IPATJEW e OSTROMISLENSKY, successivamente modificato da LEBEDEW, un tempo fungeva da fonte chiave di butadiene, specialmente in Germania e nell’Europa orientale durante la seconda guerra mondiale. Questo processo è illustrato dalla reazione:
2 CH3CH2OH → CH2=CHCH=CH2 + 2 H2O + H2
e fatto funzionare a temperature comprese tra 370 e 450 °C utilizzando catalizzatori MgO – SiO2 o SiO2 – Al2O3, raggiunge selettività fino al 70%.
Sebbene non sia più competitivo per la produzione su larga scala, potrebbe comunque essere praticabile in regioni con etanolo a basso costo o alcol agricolo in eccesso.
3.3. Deidrogenazione di butano e buteni
La deidrogenazione di butano e buteni per produrre butadiene presenta sfide uniche a causa della sua natura endotermica. Per massimizzare la resa e la selettività, è necessario affrontare diverse considerazioni chiave:
Principio di Le Chatelier: l’abbassamento della pressione parziale dei prodotti desiderati, butadiene e idrogeno, fa avanzare la reazione. Ciò può essere ottenuto tramite un’operazione sotto vuoto o aggiungendo vapore alla miscela di reazione.
Vantaggi del vapore:
- Il vapore aiuta a mitigare la disattivazione del catalizzatore impedendo la formazione di coke sulla superficie del catalizzatore.
- La natura endotermica della reazione di deidrogenazione richiede un apporto di calore esterno. Il vapore si condensa facilmente, rilasciando calore significativo per guidare la reazione.
- Il vapore condensato può essere facilmente separato dal flusso di prodotto, garantendo una contaminazione minima.
Sebbene temperature più elevate favoriscano la formazione di butadiene, aumentano anche il rischio di reazioni collaterali indesiderate come cracking, isomerizzazione e polimerizzazione. Trovare l’equilibrio di temperatura ottimale tra resa e selettività è fondamentale.
I composti sensibili alle suddette reazioni collaterali vengono rimossi prima del processo di deidrogenazione per minimizzarne l’influenza.
Poiché la reazione di deidrogenazione non procede fino al completamento, il flusso di prodotto richiede la separazione per isolare il butadiene. I materiali di partenza non reagiti vengono riciclati nel processo per massimizzare l’efficienza.
Controllando attentamente questi aspetti, la deidrogenazione di butano e buteni può essere ottimizzata per una produzione di butadiene efficiente e selettiva.
3.3.1. Deidrogenazione di n-butano
Esistono due metodi importanti per la deidrogenazione di n-butano in butadiene:
1. Processo Houdry-Catadiene:
Questo consolidato processo in un unico passaggio è operativo a livello commerciale dal 1943. Più reattori a letto impaccato, disposti in parallelo, vengono fatti passare tra le fasi di reazione e rigenerazione. Un catalizzatore di ossido di alluminio contenente il 20% di ossido di cromo facilita la deidrogenazione di n-butano puro o della sua miscela con n-buteni a 550-650 °C e 10-25 kPa.
Le alte temperature favoriscono la produzione di butadiene ma generano anche sottoprodotti indesiderati come idrocarburi C1-C3, idrogeno e coke che sporca il catalizzatore.
Dopo ogni ciclo di reazione (5-15 minuti), il reattore subisce una rigenerazione: bruciando il deposito di coke si libera calore, immagazzinato nel catalizzatore e nel materiale inerte, per la successiva fase di reazione.
Questo processo produce una concentrazione di butadiene del 15-18% all’uscita del reattore. Le successive fasi di recupero, tra cui tempra, compressione, strippaggio e separazione, aumentano la concentrazione di butadiene al 30-50%. Da 1000 tonnellate di n-butano, si ottengono circa 550 tonnellate di butadiene. Il butadiene puro può essere isolato tramite distillazione estrattiva.
2. Processo Phillips Petroleum:
Questo processo in due fasi offre vantaggi come una maggiore durata del catalizzatore e rese di butadiene più elevate.
- Deidrogenazione a butene: l’n-butano subisce una deidrogenazione catalitica a butene a 600 °C e 1 bar su un catalizzatore Cr2O3-Na2O-Al2O3.
- Separazione del butene: gli n-buteni vengono estratti utilizzando ausiliari come acetone, acetonitrile o furfurale.
- Formazione del butadiene: gli n-buteni separati vengono deidrogenati a butadiene in un reattore tubolare isotermico. Il reattore viene riscaldato dai gas di combustione a 600 °C e funziona a 1 bar di pressione con aggiunta di vapore surriscaldato su un catalizzatore Fe2O3-K2O-Al2O3.
- Recupero e purificazione del butadiene: la distillazione estrattiva con gli ausiliari sopra menzionati recupera e purifica il butadiene.
Il processo Phillips vanta tempi di esecuzione più lunghi (nessuna rigenerazione del catalizzatore) e una resa del butadiene del 65% basata su n-butano, dimostrando la sua efficienza e la sua migliore selettività rispetto al processo Houdry-Catadiene.
3.3.2. Deidrogenazione di n-buteni
Gli n-buteni, comunemente presenti nella benzina crackizzata, nella produzione di olefine e nella deidrogenazione di GPL, sono spesso presenti come parte di una miscela di idrocarburi C4. Mentre le paraffine C4 possono essere separate dalle olefine C4 tramite distillazione estrattiva (come nel recupero del butadiene), la separazione di isobutene e n-butene rappresenta una sfida unica a causa dei loro punti di ebollizione vicini.
Diversi metodi affrontano questo ostacolo alla separazione:
1. Processo BASF: utilizza il 40-45% di H2SO4 per convertire selettivamente l’isobutene in terz-butanolo, consentendo una separazione più semplice.
2. L’isobutene può essere convertito in metil terz-butil etere o oligomeri di isobutene per un’ulteriore elaborazione e separazione.
3. Distillazione con idroisomerizzazione: processi come Isopure di Axens e CD DeIB di CD-Tech combinano la distillazione con l’idroisomerizzazione di 1-butene in 2-butene. Poiché il 2-butene presenta un punto di ebollizione distinto dall’isobutene, la distillazione diventa fattibile.
4. Processo Dow: impiega la deidrogenazione di n-buteni con vapore su un catalizzatore fosfato Ca/Ni stabilizzato con Cr2O3. Il vapore surriscaldato fornisce il calore necessario per la reazione, ottenendo il 50% di conversione del butene e fino al 90% di selettività del butadiene.
5. Approccio con reattore parallelo: poiché il processo Dow richiede la rigenerazione del catalizzatore dopo 15 minuti, vengono impiegati reattori paralleli, consentendo un funzionamento continuo.
Processi simili sono stati sviluppati anche da Shell e Phillips Petroleum, evidenziando i diversi approcci disponibili per la deidrogenazione del n-butene e la produzione di butadiene.
3.3.3. Deidrogenazione ossidativa di n-buteni
La deidrogenazione ossidativa (ODH) offre diversi vantaggi rispetto ai processi di deidrogenazione convenzionali per la produzione di butadiene. Rimuovendo l’idrogeno dall’equilibrio tramite ossidazione, l’ODH migliora significativamente la conversione e la selettività:
2 C4H8 + O2 → 2 C4H6 + 2 H2O
Questa reazione esotermica fornisce calore per la deidrogenazione endotermica, riducendo ulteriormente i requisiti energetici. Inoltre, la presenza di ossigeno e vapore aiuta a ridurre al minimo la coking del catalizzatore.
Processi ODH storici:
- Processo Oxo-D (Petro-Tex): questo processo, impiegato dal 1965, utilizza un catalizzatore di ferrite e funziona a bassa pressione. I vantaggi includono un basso consumo di vapore e di energia di riscaldamento, elevata conversione/selettività, lunga durata del catalizzatore e nessuna necessità di rigenerazione.
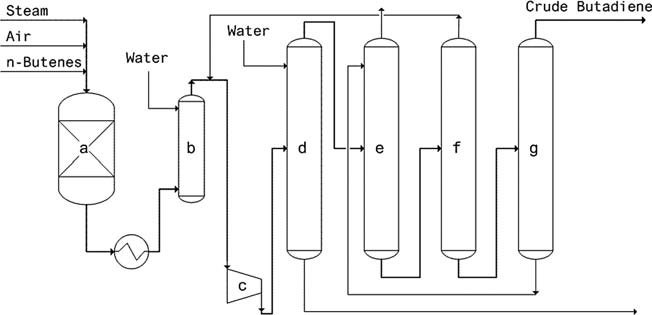
a) Reattore, b) Torre di tempra, c) Compressore, d) Scrubber, e) Assorbitore, f) Degasatore, g) Stripper
- Processo O-X-D (Phillips): operativo dal 1976, questo processo impiega un catalizzatore Li-Sn-P-O e raggiunge il 75-80% di conversione del butene con l’88-92% di selettività del butadiene.
Nuovi sviluppi in ODH:
- Processo Nippon-Zeon: questo processo utilizza una miscela di n-butene/butano e aria/gas di scarico come alimentazione, offrendo flessibilità nella composizione dell’alimentazione. Un catalizzatore di ossido di metallo misto raggiunge l’85% di resa di butadiene in base ai buteni.
- Processo chimico Mitsubishi: questo processo utilizza un catalizzatore Mo/Bi/Co e converte una miscela C4 contenente il 70% di n-butene con aria, vapore e azoto. L’aggiunta di azoto consente un elevato rapporto ossigeno/butano, riducendo al minimo la coking. Conversione del butadiene superiore all’80% con una selettività superiore al 90%.
- Altri sviluppi: Asahi Kasai e Mitsui Chemicals hanno anche sviluppato processi ODH con risultati promettenti, tra cui reattori a letto fluido e strategie di conversione etilene-butadiene.
Vantaggi generali dell’ODH:
- Maggiore conversione e selettività rispetto ai processi di deidrogenazione convenzionali.
- Riduzione dei requisiti energetici grazie alla reazione di ossidazione esotermica.
- Minore coking del catalizzatore.
- Potenziale per l’utilizzo di flussi C4 misti come materia prima.
Limitazioni:
- I processi ODH sono generalmente più complessi della deidrogenazione convenzionale.
- Le alte temperature richieste possono portare alla formazione di sottoprodotti indesiderati se si utilizza ossigeno con butano
3.4. Isolamento del butadiene dalle frazioni di steam cracking C4
Il butadiene viene isolato principalmente dalle frazioni C4 generate durante il cracking a vapore degli idrocarburi. La scelta della materia prima, come la nafta nell’Europa occidentale e il GPL negli Stati Uniti, gioca un ruolo significativo nel processo, mentre la gravità del cracking influenza principalmente la composizione della frazione C4.
La separazione del butadiene da questa miscela presenta una sfida a causa del suo comportamento azeotropico con il butano. Di conseguenza, sono necessarie tecniche specializzate.
Il processo dell’acetato di ammonio rameoso, utilizzando la sua capacità di formare un complesso con il butadiene, affronta questo problema per le frazioni con basso contenuto di butadiene e acetilene C4. Tuttavia, livelli più elevati di acetileni richiedono un pretrattamento tramite idrogenazione selettiva.
La distillazione estrattiva emerge come il metodo preferito per l’isolamento del butadiene. Questa tecnica sfrutta le diverse affinità di diversi componenti verso specifici solventi organici in base al loro grado di insaturazione.
I solventi più comuni includono acetonitrile (di Shell/KBR e LyondellBasell), N-metilpirrolidone (di BASF), dimetilformammide (di Nippon Zeon Chemicals) e furfurale (di ConocoPhillips).
Questi processi, che prevedono uno o due passaggi di distillazione estrattiva abbinati alla distillazione convenzionale, separano il butadiene e altri componenti ad alta affinità da butani e buteni meno solubili. Ulteriori passaggi di purificazione rimuovono le impurità rimanenti per ottenere la purezza del butadiene.
Il processo BASF (Figura 2), che impiega NMP come solvente, vanta non corrosività e alte rese di butadiene, mentre il processo Nippon Zeon DMF presenta vantaggi simili. I recenti progressi in questo campo includono la tecnologia delle pareti divisorie, che combina due fasi di distillazione in un’unica unità per aumentarne l’efficienza, nonché il miglioramento dei componenti interni della distillazione e del controllo del processo per incrementare la capacità e le prestazioni delle unità esistenti.
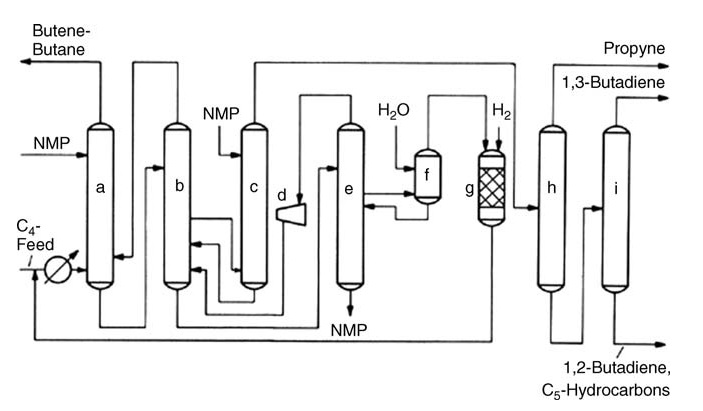
a) Lavatrice principale; b) Raddrizzatore; c) Lavatrice successiva; d) Compressore centrifugo; e) Torre di degasaggio; f) Lavatrice ad acqua; g) Reattore di idrogenazione; h) Prima distillazione; i) Seconda distillazione
Approcci alternativi come l’idrogenazione selettiva degli acetileni C4 offrono vari vantaggi. Il processo KLP di UOP rimuove gli acetileni prima dell’estrazione, semplificando il processo e aumentando la resa di butadiene. Il processo CDHYDRO di CDTECH offre flessibilità consentendo livelli variabili di conversione dell’acetilene, riducendo al minimo la perdita di butadiene.
3.5. Butadiene da risorse di origine biologica
La crescente tendenza a utilizzare risorse rinnovabili per la produzione petrolchimica si estende al butadiene. Sebbene esistano vari percorsi, i percorsi che utilizzano i bioalcoli sono i più promettenti.
La produzione di bioetanolo, avviata tramite fermentazione di canna da zucchero, mais o materiale lignocellulosico, ha raggiunto 68 milioni di tonnellate a livello globale nel 2011. Le tecnologie esistenti possono convertire il bioetanolo in butadiene.
Sebbene al momento non esista una produzione di biobutadiene su larga scala, il crescente interesse per il biobutanolo come additivo per carburante alimenta lo sviluppo di processi in corso. Disidratazione e deidrogenazione del biobutanolo in n-butene.
Un altro percorso potenziale prevede la fermentazione gassosa del monossido di carbonio, ottenuto dalla gassificazione di materiale organico o dai gas di scarico industriali. Questo processo batterico produce 2,3-butandiolo, un precursore del butadiene. Tuttavia, questa tecnologia è ancora nelle sue fasi iniziali.
Attualmente, la produzione di butadiene di origine biologica non è competitiva economicamente rispetto alla via petrolchimica. Tuttavia, l’aumento dei prezzi del petrolio e del gas naturale, insieme a ulteriori progressi tecnologici, potrebbero favorire le vie di biotrasformazione in futuro.
4. Usi e importanza economica del butadiene
Il butadiene è utilizzato principalmente come monomero o comonomero nella produzione di gomma sintetica. Contribuisce alla gomma stirene-butadiene, alla gomma polibutadiene, alla gomma acrilonitrile-butadiene e alla gomma cloroprene.
Oltre alla produzione di gomma, il butadiene svolge un ruolo cruciale in diverse materie plastiche. Costituisce la struttura portante del polistirene antiurto, un sistema bifase che combina polistirene e polibutadiene. Inoltre, il butadiene contribuisce ai polimeri ABS, una miscela di acrilonitrile, butadiene e stirene, e ai copolimeri MBS, utilizzati come modificatori per il cloruro di polivinile.
Inoltre, il butadiene funge da intermedio in varie sintesi chimiche.
Negli Stati Uniti, in Giappone e nell’Europa occidentale, l’industria automobilistica costituisce il principale consumatore di gomma butadiene.
I prezzi del butadiene hanno subito un calo significativo nei primi anni ’90 a causa dell’eccesso di offerta dovuto all’aumento delle capacità di cracking. Ciò ha portato all’idrogenazione del butadiene e al suo utilizzo come materia prima per i cracker.
Dalla fine degli anni ’90, la crescente domanda di prodotti in gomma e polimeri, in particolare in Asia, ha alimentato un aumento esponenziale della domanda di butadiene e un costante aumento dei prezzi.
La recessione economica globale del 2008 ha innescato un drastico calo della domanda di butadiene, seguito da una ripresa. I prezzi del butadiene hanno superato quelli dell’etilene, un evento raro, fino a quando la volatilità ha portato a picchi superiori a 2.000 euro a tonnellata.
Queste fluttuazioni dei prezzi possono essere attribuite all’arrivo dei cracker a base di etano in Medio Oriente e al passaggio dei cracker statunitensi a una materia prima a gas più leggera. Questi cambiamenti hanno portato a una riduzione della resa di butadiene nonostante l’aumento della domanda globale.
5. Tossicologia del butadiene
Esposizione e tossicità:
- L’esposizione professionale al butadiene è più elevata nelle industrie petrolchimiche, di purificazione e lavorazione del butadiene e nella fabbricazione di prodotti in gomma e plastica.
- Il butadiene entra nel corpo principalmente tramite inalazione, mentre il contatto con la pelle è un evento meno frequente.
- L’esposizione non professionale può verificarsi in prossimità di fonti puntuali come incendi, fumo di sigaretta ed emissioni di veicoli, sebbene a livelli molto inferiori rispetto agli ambienti lavorativi.
Studi sugli animali:
- Il butadiene presenta una bassa tossicità acuta, con dosi elevate che causano narcosi preceduta da eccitazione e iperventilazione.
- L’esposizione ripetuta a breve termine ad alte concentrazioni (4000-8000 ppm) provoca salivazione nei ratti ma non influisce sulla crescita, sul consumo di cibo o su altri parametri.
- I topi esposti a livelli simili mostrano una diminuzione del peso corporeo e un aumento della mortalità, con una maggiore sensibilità al butadiene rispetto ai ratti.
- L’esposizione a lungo termine nei ratti (fino a 111 settimane) porta a secrezione nasale transitoria, atassia e precoce mortalità alla concentrazione più elevata (8000 ppm). Aumenta anche il peso del fegato e suggerisce un potenziale di metaplasia nel polmone e una maggiore incidenza di alcuni tumori.
- I topi esposti a concentrazioni inferiori (625-1250 ppm) per 60-61 settimane presentano lesioni tossiche e proliferative nella cavità nasale, necrosi epatica e atrofia degli organi riproduttivi. In particolare, sviluppano vari tumori, tra cui neoplasie maligne, prima e a tassi più elevati rispetto ai controlli.
- Uno studio di due anni con concentrazioni ancora più basse (6,25-625 ppm) rivela lo sviluppo precoce di linfomi estesi, tumori cardiaci insoliti e tumori polmonari nei topi.
Metabolismo e mutagenicità:
- Il butadiene viene metabolizzato nel fegato per formare intermedi epossidici, che si sospetta siano i principali fattori che contribuiscono alla sua tossicità e cancerogenicità.
- La formazione di questi metaboliti è più pronunciata nei topi che nei ratti e negli esseri umani.
- Il butadiene mostra mutagenicità nel test di Ames solo in presenza di enzimi, suggerendo la formazione di un intermedio mutageno.
Dati umani:
- Sono disponibili dati umani limitati sugli effetti dell’esposizione al butadiene.
- I volontari esposti a una concentrazione molto elevata (8000 ppm) hanno manifestato irritazione temporanea, offuscamento della vista e sintomi respiratori, ma non sono stati osservati effetti cumulativi.
- Gli studi ematologici sui lavoratori esposti a livelli medi di 20 ppm di butadiene non hanno mostrato anomalie significative.
- Gli studi sulla mortalità precoce dei lavoratori nell’industria della gomma stirene-butadiene non hanno suggerito un aumento del rischio di cancro.
- Recenti revisioni di studi epidemiologici forniscono prove di un aumento del rischio di neoplasie ematolinfatiche, in particolare leucemia, con elevata esposizione al butadiene.
Classificazione e limiti di esposizione sul posto di lavoro:
- In base ai dati sugli animali e sugli esseri umani, il butadiene è classificato come cancerogeno di Gruppo 1 dall’Agenzia Internazionale per la Ricerca sul Cancro (IARC).
- I limiti di esposizione professionale variano leggermente tra i diversi enti normativi, con limiti che vanno da 0,5 a 4,4 mg/m³.
- Si stanno compiendo sforzi continui per ridurre i livelli di esposizione nei luoghi di lavoro in cui si maneggia butadiene.
Riferimento
- Butadiene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_431.pub2
