Cloruro di allile: proprietà, produzione, reazioni e usi

Cos’è il cloruro di allile?
Il cloruro di allile, noto anche come 3-cloropropene, è un composto organico con formula chimica C3H5Cl. È un liquido incolore o giallo pallido che ha un significato nel campo della chimica organica per la sua reattività e le applicazioni industriali.
Fu prodotto per la prima volta nel 1857 da Auguste Cahours e August Wilhelm Hofmann facendo reagire il cloruro di fosforo con alcol allilico. Il nome “allile” deriva dalla parola latina “allium”, che significa “aglio”. Il cloruro di allile ha un caratteristico odore di aglio che può essere rilevato anche in piccole quantità.
Alla fine degli anni ’30, IG Farbenindustrie e Shell Development Company svilupparono un processo per produrre cloruro di allile su larga scala mediante clorurazione del propene ad alte temperature. Questo processo consentiva alte rese di cloruro di allile e fu rapidamente adottato da altre aziende, tra cui Dow, Solvay e Asahi-Kashima.
Il cloruro di allile è utilizzato in una varietà di applicazioni, tra cui la produzione di epicloridrina, glicerina e pesticidi. È anche utilizzato come monomero nella produzione di materie plastiche e resine.
Sommario
1. Proprietà fisiche del cloruro di allile
Il cloruro di allile è un liquido incolore e mobile con un odore penetrante e pungente. Ha un peso molecolare di 76,53 e un punto di fusione di -134 gradi Celsius. Il suo punto di ebollizione a 101,3 kPa è di 44,4 gradi Celsius. Il suo indice di rifrazione a 25 gradi Celsius è di 1,413.
La tabella seguente mostra la dipendenza dalla temperatura delle proprietà fisiche del cloruro di allile
| Temperatura (°C) | Densità (g/cm³) | Capacità termica specifica (kJ kg⁻¹ K⁻¹) | Viscosità (mPa s) | Tensione superficiale (mN/m) |
|---|---|---|---|---|
| 10 | 0,950 | 1,633 | 368 | 28,2 |
| 15 | 0,944 | 1,666 | 347 | 27,4 |
| 20 | 0,938 | 1,700 | 336 | 26,7 |
| 25 | 0,931 | 1,733 | 315 | 25,9 |
| 30 | 0,925 | 1,771 | 307 | 25,2 |
| 40 | 0,911 | 1,816 | 282 | 24,4 |
| 50 | 0,898 | 1,868 | 257 | 23,7 |
La pressione di vapore del cloruro di allile può essere calcolata utilizzando la seguente equazione:
log(p) = 19,1403 – 2098 / T – 4,2114 × log(T)
dove p è la pressione di vapore in kPa e T è la temperatura in Kelvin.
Il cloruro di allile è miscibile con la maggior parte dei solventi di uso comune, come ottano, toluene e acetone. La solubilità del cloruro di allile in acqua a 20 gradi Celsius è dello 0,36% e la solubilità dell’acqua nel cloruro di allile è dello 0,08%.
I dati azeotropici per il cloruro di allile sono riportati nella Tabella 2.
| Componente | Punto di ebollizione a 101,3 kPa, °C | Cloruro di allile, frazione di massa, % |
|---|---|---|
| Acqua | 43 | 97,8 |
| Metanolo | 40 | 90 |
| Etanolo | 44 | 95 |
| 2-propanolo | 45 | 98 |
| Acido formico | 45 | 92,5 |
2. Reazioni chimiche del cloruro di allile
Il cloruro di allile è un composto molto reattivo che subisce una varietà di reazioni di addizione, polimerizzazione e sostituzione. L’atomo di cloro nel cloruro di allile può anche essere facilmente sostituito con altri gruppi. Ciò rende il cloruro di allile un materiale di partenza versatile per la sintesi di un’ampia gamma di composti.
2.1. Reazioni di addizione
Il cloruro di allile può aggiungersi a una varietà di composti, tra cui ossigeno, alogeni, alogenuri di idrogeno, silani, borani, carborani e tricloruro di fosforo. Queste reazioni possono essere utilizzate per preparare una varietà di derivati allilici.
Ad esempio, quando il cloruro di allile reagisce con l’ossigeno nella fase liquida a circa 120 °C e in presenza di acetati metallici o perossido di idrogeno, produce glicerolo monocloridrina.
Quando il cloruro di allile reagisce con gli alogeni, produce i corrispondenti composti trialogeni. La reazione con acido ipocloroso, che produce dicloridrine di glicerolo 2,3 e 1,3 (che vengono poi deidroclorurate con alcali per dare epicloridrina), è di grande importanza industriale.
Il cloruro di allile reagisce con gli alogenuri di idrogeno per formare composti di 1,2-dialogeno. In presenza di perossidi, la reazione con acido bromidrico produce 1-bromo-3-cloro-propano (effetto Kharasch), ma in una soluzione di perossido di idrogeno altamente concentrata, si forma 1,2-dibromo-3-cloropropano.
Sono note anche reazioni di addizione di silani, borani, carborani e tricloruro di fosforo, nonché cicloaddizioni di cationi allilici con alcheni. Il cloruro di allile polimerizza con anidride solforosa per formare polisolfoni.
2.2. Polimerizzazione
Il cloruro di allile può polimerizzare per formare poli(cloruro di allile), una resina dura e incolore. Questa resina è utilizzata in una varietà di applicazioni, tra cui vernici, adesivi e sigillanti.
2.3. Reazioni di sostituzione
L’atomo di cloro nel cloruro di allile può essere facilmente sostituito con altri gruppi, come ioduro, cianuro, isotiocianato, solfuro, polisolfuri e alchil tioli. Queste reazioni possono essere utilizzate per preparare una varietà di derivati allilici con proprietà diverse.
Ad esempio, quando il cloruro di allile reagisce con il solfito di sodio, produce sodio allil sulfonato. Il sodio allil sulfonato è un composto versatile che viene utilizzato in una varietà di applicazioni, tra cui cosmetici, prodotti farmaceutici e additivi alimentari.
Oltre a queste reazioni comuni, il cloruro di allile può anche subire una varietà di altre reazioni, come la carbonilazione, la formazione di policarbonati organici e la formazione di eteri allilici.
Il cloruro di allile è un composto pericoloso e deve essere maneggiato con cura. È un liquido infiammabile e può essere irritante per la pelle e gli occhi. È anche un sospetto cancerogeno. Se si lavora con il cloruro di allile, è importante indossare indumenti protettivi, come guanti, occhiali e un respiratore.
3. Produzione di cloruro di allile
3.1. Produzione di cloruro di allile mediante processo di clorurazione del propene
L’ampia produzione di cloruro di allile avviene mediante il processo di clorurazione ad alta temperatura (300 – 600 °C) del propene:
CH2=CH–CH3 + Cl2 → CH2=CH–CH2Cl + HCl (ΔH298 = -113 kJ/mol)
Durante queste temperature elevate, il processo di clorurazione procede tramite un meccanismo a catena di radicali liberi. Questo meccanismo sostituisce prevalentemente l’atomo di idrogeno situato nella posizione allilica con cloro, producendo così cloruro di allile.
3.1.1. Reazioni secondarie e sottoprodotti
A temperature inferiori a 200 °C, la reazione del propene con il cloro comporta principalmente l’aggiunta al doppio legame, con conseguente formazione di 1,2-dicloropropano. Quando la temperatura supera i 300 °C, si verifica la formazione di cloruro di allile, che produce 1,2-dicloropropano come sottoprodotto. Si formano anche altri prodotti di clorurazione in piccole quantità:
- CH3–CH=CH2 + Cl2 → CH3–CHCl–CH2Cl (ΔH298 = -184 kJ/mol)
- ClCH2–CH=CH2 + Cl2 → CH2Cl–CH=CHCl + HCl (ΔH298 = -101 kJ/mol)
- CH3–CH=CH2 + Cl2 → CH3–C(Cl)=CH2 + HCl (ΔH298 = -121 kJ/mol)
- CH3–CH=CH2 + Cl2 → CH3–CH=CHCl + HCl
3.1.2. Parametri di processo critici
Nella clorurazione su scala industriale del propene in cloruro di allile, i fattori più influenti sono la temperatura e il rapporto propene-cloro. La pressione e il tempo di residenza hanno un impatto minimo sulla resa del cloruro di allile.
Per impedire la produzione di 1,2-dicloropropano al di sotto di 200 °C, la temperatura di miscelazione di propene e cloro deve essere mantenuta al di sopra di 250 – 300 °C. Le rese più elevate di cloruro di allile si ottengono nei reattori industriali che operano a una temperatura di picco di 500-510 °C.
Se la temperatura supera questo intervallo, si verifica una pirolisi spontanea, che porta alla formazione di fuliggine e catrami altobollenti. In condizioni sperimentali a circa 600 °C, si forma il benzene, che causa una riduzione della resa di cloruro di allile.
3.1.3. Rapporto propene-cloro
Un aumento dell’eccesso di propene determina una riduzione della formazione di sottoprodotti. Tuttavia, amplifica le spese di lavorazione del propene. Di conseguenza, le condizioni di reazione ottimali sono modellate da fattori economici, tra cui la necessità di sottoprodotti di dicloruro da utilizzare come nematicidi. Questi sottoprodotti possono anche servire come materiali di partenza per la sintesi di solventi di tipo C1 o C2.
3.1.4. Pressione del reattore e tempo di residenza
La pressione del reattore ha un impatto minimo sulla resa e sulla distribuzione del prodotto. È determinato esclusivamente dal calo di pressione all’interno del sistema di circolazione del propene. Allo stesso modo, il tempo di residenza esercita un’influenza limitata sulla resa di cloruro di allile.
Il cloro reagisce completamente entro 1-3 secondi ad alte temperature da 300 a 600 °C e un tempo di residenza eccessivo porta alla decomposizione termica del cloruro di allile.
3.1.5. Progettazione del reattore e selezione dei materiali
I reattori su scala industriale funzionano principalmente in modo adiabatico, sebbene rese ottimali possano essere realizzate con un funzionamento isotermico. A causa della natura rapida ed esotermica della reazione, la perdita di calore attraverso le pareti del reattore è insignificantemente bassa.
Il tipo di reattore più semplice e tradizionale è il reattore a tubi, spesso dotato di funzionalità di dispersione del gas e rimozione della fuliggine. Sono riconosciute numerose altre configurazioni di reattori, ciascuna delle quali si sforza di facilitare una miscelazione rapida e completa dei reagenti per mitigare la formazione di 1,3-dicloropropene.
In condizioni di flusso altamente turbolento, propene e cloro vengono introdotti nella zona di reazione a velocità fino a 300 m/s. L’importanza di condizioni di miscelazione precise è sottolineata da un reattore a ciclone, in cui rese simili vengono raggiunte a un rapporto molare di 3:1 rispetto a un rapporto di 5:1 con progetti alternativi. Diversi reattori hanno camicie di raffreddamento.
Impiegando una cascata di reattori con cloro distribuito, è possibile ottenere tassi di conversione del cloro fino all’86%. Tale disposizione consente temperature di preriscaldamento elevate grazie a rapporti propene:cloro più elevati nel reattore iniziale.
3.1.6. Preparazione delle materie prime
La purezza del propene e del cloro è molto importante. Le impurità nel propene innescano la formazione di sottoprodotti e la perdita di cloro. In particolare, il propano incoraggia lo sviluppo di derivati del cloro (1-cloropropano, 2-cloropropano) che sono difficili da separare.
Per la materia prima, viene spesso impiegato propene di purezza di grado polimerico, pari a circa il 99,5%. Per garantire una purezza sufficiente, il cloro viene nuovamente vaporizzato. Tuttavia, ciò introduce tracce di gas inerti, che portano alla perdita di propene durante lo sfiato. Sia il propene che il cloro devono essere il più possibile privi di acqua.
3.1.7. Panoramica del processo
Un processo simile a quello impiegato da Shell è rappresentato nella Figura 1.
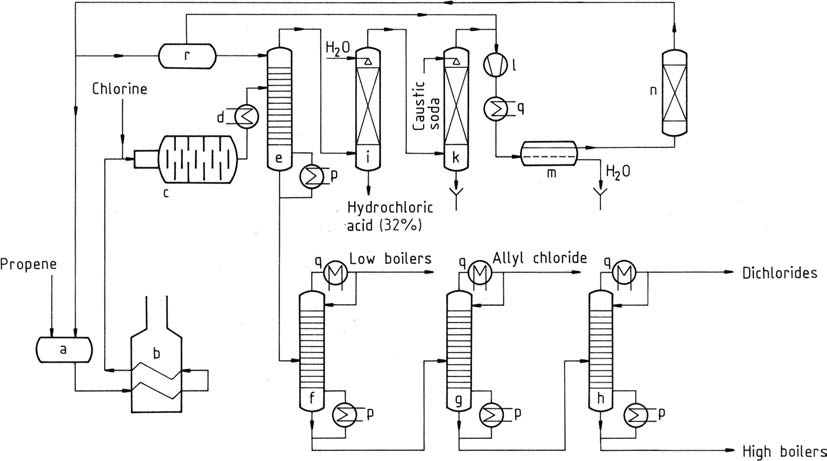
a) Recipiente di stoccaggio per propene liquido; b) Evaporatore e surriscaldatore per propene; c) Reattore; d) Refrigeratore; e) Prefrazionatore; f) Colonna di estremità leggere; g) Colonna di purificazione del cloruro di allile; h) Colonna di dicloropropene; i) Assorbitore di cloruro di idrogeno; k) Lavatrice a gas; l) Compressore; m) Decanter per la rimozione dell'acqua; n) Essiccatore del propene; p) Evaporatore; q) Condensatore; r) Recipiente di stoccaggio del propene freddo
Il propene liquido viene vaporizzato, seguito da un preriscaldamento a temperature di 350-400 °C (b). Questa miscela, insieme al cloro gassoso, viene introdotta nel reattore (c) tramite un getto di miscelazione.
La reazione completa del cloro aumenta la temperatura a 500-510 °C (in condizioni ottimali). Anche nelle circostanze migliori, si verifica una formazione minima di carbonio, catalizzando la clorurazione. Sulle pareti del reattore si forma una pellicola protettiva di carbonio vetroso.
Questo materiale, composto da sostanze altamente clorurate e catrame, necessita di una pulizia periodica ogni 4-8 settimane. Spesso, vengono impiegate catene di reattori paralleli per mantenere una produzione parziale durante la pulizia, oppure è possibile seguire il funzionamento alternato delle due catene.
Il flusso di gas che esce dal reattore di clorurazione subisce un preraffreddamento (d) e viene diretto a un prefrazionatore (e). La temperatura di testa di questo prefrazionatore, mantenuta a circa -40 °C, è gestita da un’alimentazione di propene liquido. Ciò separa gli idrocarburi clorurati, con il prodotto di fondo privo di propene e acido cloridrico.
La miscela gassosa di testa viene separata tramite assorbimento d’acqua (i), producendo acido cloridrico acquoso di qualità commerciale e propene. Il propene viene quindi lavato con soda caustica in uno scrubber (k) per eliminare tracce di acido cloridrico.
Dopo la compressione a 1,2 MPa (12 bar), il propene viene condensato in un condensatore (l, q). Il propene liquido viene essiccato tramite adsorbimento (n) e l’acqua viene rimossa (m), quindi riportato in magazzino (a).
Il prodotto di fondo del prefrazionatore contiene l’80% di cloruro di allile, il 3% di 2-cloro-1-propene e altri componenti bassobollenti, insieme al 16% di dicloruri (principalmente 1,2-dicloropropano e cis- e trans-1,3-dicloro-1-propene) e l’1% di 1,2,3-tricloropropano e altre frazioni altobollenti. Queste frazioni possono essere ulteriormente separate tramite distillazione (f, g, h).
3.1.8. Selezione dei materiali per la costruzione
La scelta dei materiali per la sintesi del cloruro di allile (circolazione del propene) dipende dalle specifiche del processo, dalla temperatura e dalla pressione. L’acciaio al carbonio standard può essere utilizzato dove i flussi di prodotto mantengono un basso contenuto di acqua.
Se il cloro non viene preriscaldato, l’acciaio al carbonio può essere impiegato anche nell’area del reattore. Tuttavia, nella zona del reattore, la resistenza al cloro ad alta temperatura richiede materiali come acciai al cromo-nichel, nichel e leghe di cupronichel.
I rivestimenti in grafite e PTFE sono ideali per l’assorbimento di acido cloridrico, mentre l’acciaio gommato si adatta allo scrubber di soda caustica. L’acciaio al carbonio è sufficiente per l’intero impianto di frazionamento degli idrocarburi clorurati, sebbene gli ambienti con volumi d’acqua significativi richiedano materiali costosi come nichel e cupronichel. Il cloruro di allile secco può essere conservato in recipienti di acciaio senza problemi di corrosione.
3.2. Altri processi di produzione
Sono stati proposti processi alternativi per la sintesi del cloruro di allile, ma nessuno di questi metodi è stato implementato su scala commerciale.
3.2.1. Produzione di cloruro di allile mediante clorurazione catalitica del propene
La clorurazione del propene in questo metodo utilizza catalizzatori contenenti tellurio, con conseguenti rese di cloruro di allile fino all’82%. Il sottoprodotto primario è il 17% di 2-cloropropano (cloruro di isopropile). Qualsiasi propene non reagito e l’acido cloridrico generato durante la reazione possono essere convertiti in cloruro di allile in una fase successiva che prevede l’ossiclorurazione.
3.2.2. Produzione di cloruro di allile mediante deidroclorurazione di 1,2-dicloropropano
Il processo di deidroclorurazione di 1,2-dicloropropano porta a una modesta resa di solo il 55% di cloruro di allile, accompagnato da una quantità significativa di monocloropropeni. Nonostante inizi con abbondanti quantità di dicloropropano, che vengono prodotte durante la produzione di ossido di propene, questo processo non ha usi commerciali.
3.2.3. Produzione di cloruro di allile mediante ossiclorurazione
L’ossiclorurazione è stata sviluppata come un approccio per produrre cloruro di allile utilizzando cloruro di idrogeno facilmente disponibile al posto del cloro come materia prima primaria. Sono stati proposti vari sistemi di catalizzatori, tra cui palladio, vanadio, tellurio, rame, litio, manganese, nonché i rispettivi cloruri, ossidi e combinazioni degli stessi.
Mentre molti di questi processi di ossiclorurazione iniziano dal propene, un paio iniziano dal propano.
Un processo, valutato in un impianto pilota da Hoechst, prevede la reazione di propene, cloruro di idrogeno, ossigeno e 2-cloropropano (che può essere prodotto all’interno di un reattore sussidiario o introdotto esternamente) in un reattore primario a letto fluido che funziona a temperature di 200-260 °C e 0,1 MPa (1 bar) di pressione relativa (ΔH = -218 kJ/mol).
La miscela di catalizzatori include tellurio, pentossido di vanadio, acido fosforico e un composto di azoto come promotore. Parte del flusso di catalizzatore viene trattata con aria e acido nitrico in un flusso laterale per eliminare la formazione di coke e mantenere una reattività costante.
In un reattore separato, il 2-cloropropano viene prodotto da propene, acido cloridrico e una soluzione di cloruro ferrico. Il propene non reagito, il 2-cloropropano e l’acido cloridrico vengono separati e riciclati.
La resa di cloruro di allile varia dall’88% al 94% in base all’input di propene. La purezza del propene non è altamente critica in questo caso.
Alcuni approcci di ossiclorurazione presentano svantaggi intrinseci. Ad esempio, le attività del catalizzatore diminuiscono rapidamente a causa della volatilità dei sali metallici impiegati, rendendo necessari grandi volumi di reattore a causa della bassa conversione per passaggio.
Inoltre, l’estrazione di cloruro di allile altamente diluito dalla miscela di reazione senza un’eccessiva perdita di propene per ossidazione pone delle sfide. Una soluzione a questo problema è l’utilizzo del biossido di manganese sia come catalizzatore che come trasportatore di ossigeno. Le principali reazioni che si verificano nel reattore primario sono le seguenti:
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
C3H6 + Cl2 → C3H5Cl + HCl
Il catalizzatore viene successivamente riossidato e attivato con ossigeno:
MnCl2 + O2 → MnO2 + Cl2
Questo processo raggiunge rese di cloruro di allile che vanno dal 71% all’81% in base al consumo di propene.
4. Utilizzi del cloruro di allile
Il cloruro di allile è un importante intermedio nell’industria petrolchimica. Viene utilizzato principalmente per produrre epicloridrina, che viene utilizzata per realizzare resine epossidiche. Il cloruro di allile è anche un materiale di partenza per la sintesi di vari altri prodotti chimici, come glicerolo, esteri, eteri allilici e allilammine.
Altri composti che possono essere realizzati dal cloruro di allile includono isotiocianato di allile (olio di senape sintetico), solfonato di allile, allilsilano e ciclopropano.
Ecco una ripartizione più dettagliata degli utilizzi del cloruro di allile:
- Epicloridrina: il cloruro di allile viene utilizzato per produrre epicloridrina, che è un composto versatile con un’ampia gamma di applicazioni. L’epicloridrina viene utilizzata per realizzare resine epossidiche, che vengono utilizzate in una varietà di prodotti, tra cui adesivi, rivestimenti e compositi. L’epicloridrina è anche usata per produrre glicerolo, un liquido dolce e incolore che viene utilizzato in una varietà di prodotti, tra cui alimenti, cosmetici e prodotti farmaceutici.
- Esterificazione: il cloruro di allile viene utilizzato nell’esterificazione degli acidi ftalico, fosforico e carbossilico. Questo processo produce esteri, che sono composti con una vasta gamma di applicazioni. Gli esteri sono usati in profumi, aromi e materie plastiche. Sono anche usati come solventi e come intermedi nella produzione di altri prodotti chimici.
- Eteri allilici e allilammine: il cloruro di allile viene utilizzato per produrre eteri allilici e allilammine. Gli eteri allilici sono composti con un odore caratteristico che vengono usati in profumi e aromi. Le allilammine sono composti con una vasta gamma di applicazioni. Sono utilizzati in prodotti farmaceutici, prodotti chimici agricoli e materie plastiche.
- Altri composti: il cloruro di allile può anche essere utilizzato per produrre altri composti, come isotiocianato di allile, solfonato di allile, allilsilano e ciclopropano. L’isotiocianato di allile è un composto dall’odore forte che viene utilizzato in agenti fitosanitari e preparati farmaceutici. L’allilsolfonato viene utilizzato come additivo per bagni di elettrodeposizione e nella produzione di fibre di carbonio. L’allilsilano viene utilizzato per la produzione di additivi per l’industria della gomma. Il ciclopropano è un anestetico utilizzato in chirurgia.
5. Manipolazione e protezione ambientale del cloruro di allile
Il cloruro di allile è una sostanza altamente reattiva, tossica e infiammabile. È quindi soggetto a rigide normative in molti paesi per quanto riguarda le sue emissioni nell’atmosfera. Il cloruro di allile deve essere maneggiato in sistemi chiusi per rispettare tali normative.
Le miscele gassose contenenti cloruro di allile o sottoprodotti derivati dal processo di produzione devono essere purificate tramite condensazione, assorbimento, adsorbimento o combustione prima dello sfiato. Una tecnica efficace per trasferire il cloruro di allile da un contenitore all’altro è la tecnica di compensazione.
La contaminazione del suolo, delle falde acquifere, dei corsi d’acqua o delle acque reflue deve essere evitata a tutti i costi. Qualsiasi potenziale contaminazione deve essere segnalata immediatamente alle autorità.
Lo smaltimento dei rifiuti contenenti cloruro di allile non presenta rischi importanti quando vengono impiegati inceneritori specializzati come quelli utilizzati per lo smaltimento dei solventi. I gas di combustione di questi inceneritori devono essere trattati in assorbitori o scrubber per rimuovere l’acido cloridrico che si forma.
A causa della sua elevata volatilità e del basso punto di infiammabilità, gli impianti per la produzione e la lavorazione del cloruro di allile devono rispettare rigide normative di sicurezza antincendio ed esplosive.
La combustione di idrocarburi clorurati produce acido cloridrico, quindi i vigili del fuoco che intervengono in caso di incendi che coinvolgono il cloruro di allile devono essere dotati di tute protettive e autorespiratori. Un’inadeguata fornitura di aria durante la combustione potrebbe causare la formazione di monossido di carbonio.
Il cloruro di allile è altamente reattivo e può reagire vigorosamente, esotermicamente e persino in modo esplosivo con altre sostanze. Ciò è particolarmente vero per i metalli alcalini e alcalino-terrosi, ma anche per alluminio e zinco e forti agenti ossidanti, come l’acido solforico concentrato.
Anche gli alogenuri anidri (ad esempio, i cloruri) dei metalli sopra menzionati reagiscono vigorosamente con il cloruro di allile. È necessario prestare attenzione agli aspetti di sicurezza di queste reazioni esotermiche negli impianti che producono o elaborano il cloruro di allile.
Nel 1996, l’Unione Europea ha classificato il cloruro di allile come “pericoloso per l’ambiente” e “molto tossico per gli organismi acquatici”.
6. Tossicologia e salute sul lavoro
In studi di laboratorio su ratti e conigli, i valori LD50 indicano che il consumo orale di 460 mg/kg di cloruro di allile si è rivelato letale per i ratti, mentre l’applicazione percutanea di 3,7 mg/kg ha portato alla mortalità nei conigli. Inoltre, l’inalazione di cloruro di allile a una concentrazione di 11 mg/L per 2 ore ha avuto un esito letale per i ratti.
Il cloruro di allile è una sostanza chimica tossica che può essere assorbita per inalazione, ingestione e attraverso la pelle.
È un forte irritante per la pelle e le mucose e può causare sintomi come irritazione agli occhi, tosse, mancanza di respiro e intorpidimento.
In alte concentrazioni, il cloruro di allile può causare edema polmonare (liquido nei polmoni), danni cardiaci, danni al fegato e danni renali.
Si sospetta inoltre che sia cancerogeno e mutageno.
Il valore limite di soglia (TLV) per il cloruro di allile è 1 ppm (media ponderata nel tempo di 8 ore). Ciò significa che la concentrazione media di cloruro di allile nell’aria non deve superare 1 ppm per una giornata lavorativa di 8 ore.
Il limite di esposizione a breve termine per il cloruro di allile è 2 ppm. Ciò significa che la concentrazione di cloruro di allile nell’aria non deve superare 2 ppm per un periodo di 15 minuti.
Il cloruro di allile ha un odore pungente, ma questo odore non è un segnale di avvertimento affidabile. La soglia di percezione dell’odore per il cloruro di allile è da 3 a 6 ppm, che è notevolmente al di sopra delle concentrazioni di lavoro consentite.
Esistono ricerche limitate sugli effetti del cloruro di allile sulla salute umana. Tuttavia, le prove disponibili suggeriscono che si tratta di una sostanza chimica tossica con il potenziale di causare una serie di problemi di salute, tra cui cancro e danni riproduttivi.
È importante notare che le informazioni nel testo sono solo un riassunto della nota tossicità del cloruro di allile. Gli effetti effettivi dell’esposizione al cloruro di allile possono variare a seconda del livello di esposizione dell’individuo, della durata dell’esposizione e di altri fattori.
Riferimenti
- Composti allilici; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_425
- https://www.solvay.com/sites/g/files/srpend221/files/2021-01/PSS-Allyl-Chloride-Epichlorohydrin.pdf
