Chloordioxide: eigenschappen, productie en toepassingen
Wat is chloordioxide?
Chloordioxide is een anorganische chemische verbinding met de formule ClO2. Het bestaat als een geelgroen gas bij kamertemperatuur, een roodbruine vloeistof tussen 11 °C en -59 °C en als helderoranje kristallen onder -59 °C. Het wordt meestal behandeld als een waterige oplossing en wordt ter plaatse geproduceerd voor industriële toepassingen.
Chloordioxide wordt voornamelijk gebruikt bij het bleken van chemische houtpulp. Historisch gezien was elementair chloor het dominante bleekmiddel. Vanwege aanzienlijke milieuzorgen die verband houden met het gebruik ervan, is chloordioxide echter sinds eind jaren 80 het favoriete alternatief geworden.
Inhoudsopgave
1. Eigenschappen van chloordioxide
Chloordioxide (ClO2) is een chloor-zuurstofverbinding met een chlooratoom met een valentie van vier. Het heeft een moleculair gewicht van 67,45 g/mol, een smeltpunt van -59 °C en een kookpunt van 11 °C.
Deze eigenschap maakt chloordioxide een gas bij kamertemperatuur. Dit gas heeft een duidelijke geur, vergelijkbaar met chloor maar met een scherp karakter. Het is gemakkelijk te detecteren bij lage concentraties. Inademing bij matige concentraties kan echter gevaarlijk zijn en ademhalingsschade veroorzaken.
Vanwege veiligheids- en economische zorgen bestaat commercieel verkrijgbaar chloordioxide niet in zuivere gas-, vloeibare of vaste vorm. Voor kleine hoeveelheden zijn gestabiliseerde vormen beschikbaar.
Chloordioxide lost gemakkelijk op in water en vertoont een kleur die varieert van lichtgeel tot donkergroengeel, afhankelijk van de concentratie (zowel in gas- als oplossingsfase). Het is zeer oplosbaar in zuiver water en bereikt ongeveer 60 g/l. Oplosbaarheid is omgekeerd evenredig met de temperatuur; het neemt af naarmate de temperatuur stijgt. Het oplossingsproces omvat geen hydrolyse of dimerisatie.
Chloordioxide heeft een absorptiemaximum bij 360 nm. Hoewel niet bijzonder duidelijk, kan deze piek worden gebruikt om de chloordioxideconcentratie in gas-, waterige en zelfs organische oplossingen te meten.
Het chloordioxidemolecuul is inherent instabiel vanuit een thermodynamisch perspectief. Kinetische beperkingen staan verwerking in de gasfase toe, maar er zijn strikte beperkingen. De dampspanning mag niet hoger zijn dan 10–12 kPa om snelle ontleding met potentieel explosieve gevaren te voorkomen.
Chloordioxide is relatief stabiel wanneer het wordt geabsorbeerd in waterige oplossingen (vanwege de hitte van de oplossing), vooral onder koele en donkere omstandigheden. De dampspanning boven dergelijke oplossingen vereist echter concentratiebeperkingen (ongeveer 1 gew.%) om gevaarlijke dampspanningsopbouw te voorkomen. Bovendien kan de vorming van kristallijn ClO2·8 H2O optreden. Chloordioxide kan ook in verschillende andere oplosmiddelen worden opgelost.
De twee chloor-zuurstofbindingen bezitten een dubbelbindingskarakter met een bindingshoek van 117,5°. Met 19 valentie-elektronen, waaronder één ongepaard elektron, heeft chloordioxide een radicaalachtig gedrag, waardoor diverse reactiepaden mogelijk zijn.
Net als alle chlooroxiden vormt het een hoog explosierisico bij thermische of fysieke schokken. Compressie van de gasfase moet strikt worden vermeden.
Chloordioxide werkt als een sterk oxidatiemiddel, dat de spontane en soms explosieve ontbranding van organisch materiaal veroorzaakt. In waterige oplossingen oxideert het koolwaterstoffen tot ketonen en alcoholen.
2. Industriële productie van chloordioxide
Chloordioxide (ClO2) wordt geproduceerd uit natriumchloriet (NaClO2) of natriumchloraat (NaClO3). Beide uitgangsmaterialen zijn relatief stabiel, ondanks hun oxiderende potentieel.
Productiemethoden omvatten ofwel de reductie van chloraat of de oxidatie van chloriet. Echter, chloraatreductie blijft de dominante methode vanwege de kosteneffectiviteit, vooral voor grootschalige toepassingen van meer dan 2.000 kg/dag ClO2. Kleinere operaties kunnen zowel chloriet als chloraat gebruiken.
De belangrijkste reactie voor chloraatreductie is:
ClO3– + reductiemiddel + zuur → ClO2 + bijproducten
Dit proces vindt plaats in een sterk elektrolytmedium dat een krachtig zuur bevat (zwavelzuur of zoutzuur) en een reductiemiddel (meestal methanol). Het reductiemiddel reduceert selectief de valentie van het chlooratoom met één eenheid. Het handhaven van een stoichiometrische overmaat aan zuur en reductiemiddel optimaliseert de economie, aangezien chloraat de duurste grondstof is.
Kosteneffectiviteit is een cruciale factor bij de selectie van het proces. De toegankelijkheid en veiligheid van de ClO2-voorziening zijn echter even belangrijk. Effectieve chloordioxideproductieprocessen minimaliseren de impact op het milieu en voldoen aan de veiligheidsvoorschriften.
Tegenwoordig zijn er twee belangrijke procesregelingen voor de reductie van chloraat:
- Vacuümprocessen bieden een complexere aanpak, maar leveren superieure algehele productie-economieën op voor grootschalige operaties. Deze processen houden grondstoffen in de reactor terwijl ze bijproductzouten kristalliseren en scheiden.
- Atmosferische processen gebruiken een reactorserie om een volledige reactie te bereiken. Verbruikt zuur effluent van deze systemen bevat bijproducten, restchloraat en aanzienlijke hoeveelheden zuur.
Het productieproces is niet zo eenvoudig als het lijkt; Er kunnen meerdere concurrerende en parallelle reacties bestaan, die vaak uit 10 tot 20 afzonderlijke stappen bestaan.
Zorgvuldige controle van reactantconcentraties en zuiverheid is essentieel om optimale opbrengsten en generatorefficiënties te bereiken. Procesaanpassingen kunnen worden gemaakt om te voldoen aan specifieke productiecapaciteit en minimale vereisten voor de vorming van bijproducten zonder aanzienlijke investeringen.
2.1. Productie van chloordioxide uit chloraat met methanol als reductiemiddel
De reactie tussen natriumchloraat, methanol en zwavelzuur vertegenwoordigt de belangrijkste industriële route voor de productie van chloordioxide:
9 NaClO3 + 2 CH3OH + 6 H2SO4 → 9 ClO2 + 3 Na3H(SO4)2 + 0,5 CO2 + 1,5 HCOOH + 7 H2O
Deze vergelijking lijkt eenvoudig, maar omvat talrijke concurrerende reactiestappen. Niettemin blijft dit proces de meest kosteneffectieve en betrouwbare methode, goed voor ongeveer 75% van de wereldwijde ClO2-productie. Het biedt verschillende voordelen:
- Economische efficiëntie: Het proces heeft lage operationele kosten.
- Betrouwbaarheid: Consistente en betrouwbare productie is haalbaar.
- Minimale chloorvorming: Elementaire chloorvorming is minimaal, doorgaans minder dan 0,1 g/l in een 10 g/l ClO2-oplossing.
- Compatibiliteit bijproducten: Het gegenereerde mierenzuur (HCOOH) remt de daaropvolgende bleekprocessen niet.
De belangrijkste processen die deze methodologie gebruiken, zijn SVP-LITE (Eka Chemicals) en de gerelateerde R8 (ERCO Wereldwijd).
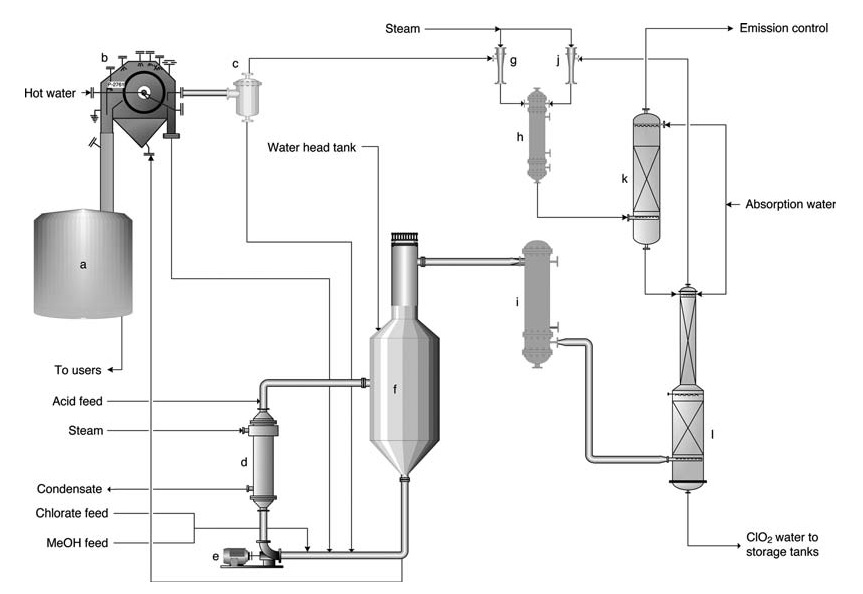
a) Zoutkoekoplossingstank; b) Zoutkoekfilter; c) Filtraatontvangsttank; d) Reboiler; e) Generatorcirculatiepomp; f) SVP-generator; g) Ejector voor filtervacuüm; h) Ejector-stoomcondensor; i) Hoofdinjector voor procesvacuüm; j) Gaskoeler; k) Ventilatiewasser; l) Absorptietoren
Het SVP-LITE-proces (Figuur 1) maakt gebruik van een circulatiesysteem in een hoofdreactorvat dat onder vacuüm wordt gehouden. Reactanten (chloraat, methanol en zwavelzuur) worden in de reactor gebracht, waar ze reageren om ClO2 te vormen en bijproductzouten neer te slaan.
Warmte wordt geleverd via een reboiler en door de verdunningswarmte van het zwavelzuur. Chloordioxide verlaat de reactor samen met verdampt water en wordt vervolgens geabsorbeerd in water in een absorptietoren.
De resulterende ClO2-oplossing wordt vervolgens naar de opslag gepompt. Restgas uit de absorber ondergaat verdere reiniging om emissies te minimaliseren. Een deel van de reactoroplossing wordt omgeleid naar een filter voor het verwijderen van bijproductzout voordat het terug in de reactor wordt gecirculeerd.
Voor operationele eenvoud wordt het vaste zout doorgaans opnieuw opgelost en naar het chemische systeem van de molen geleid.
Productiesnelheden variëren over het algemeen van 5 tot 60 ton per dag. Het eindproduct bevat 9–10 g/L ClO2 en is vrijwel vrij van elementair chloor (Cl2-gehalte doorgaans lager dan 0,1 g/L, maar gegarandeerd lager dan 0,2 g/L).
Het onverwerkte bijproductzout van de generator is doorgaans een zuur sulfaatzout, bekend als natriumsesquisulfaat (Na3H(SO4)2). Het proces kan echter worden aangepast om neutraal natriumsulfaat (Na2SO4) te verkrijgen.
Deze omzetting wordt bereikt door natriumsesquisulfaat te transformeren in een speciale fabriekseenheid (wat respectievelijk leidt tot de procesnamen SVP-SCW en R10).
De sesquisulfaatstroom uit het reactorsysteem wordt naar een meng-/metathesetank geleid, waar het gedeeltelijk wordt omgezet in natriumsulfaat, dat vervolgens wordt gescheiden door herkristallisatie en filtratie. De zure oplossing wordt vervolgens teruggevoerd naar de ClO2-reactor.
Het omzetten van het zure zout in een neutrale vorm biedt aanzienlijke voordelen, zoals een lager zuurverbruik en een kleiner zoutkoekvolume.
2.2. Productie van chloordioxide uit chloraat met waterstofperoxide als reductiemiddel
Waterstofperoxide (H2O2) kan ook worden gebruikt als reductiemiddel bij de productie van ClO2 op basis van chloraat. Dit proces genereert zuurstof (O2) als bijproduct, dat in de atmosfeer wordt vrijgegeven:
NaClO3 + 0,5 H2O2 + 0,5 H2SO4 → ClO2 + 0,5 Na2SO4 + 0,5 O2 + H2O
Ondanks de schijnbare eenvoud is de werkelijke reactie complexer. Het bijproductzout onder vacuümomstandigheden kan natriumsulfaat of natriumsesquisulfaat zijn, afhankelijk van de zuurgraad van de reactor. Hoewel werken bij een hogere zuurgraad natriumsesquisulfaatproductie oplevert, gaat dit ten koste van een verhoogd zuurverbruik en zoutkoekvorming.
De voordelen van waterstofperoxide zijn als volgt:
- Verhoogde capaciteit: De snellere reactiekinetiek van waterstofperoxide maakt een hogere productiecapaciteit mogelijk binnen bestaande ClO2-installaties met minimale kapitaalinvestering.
- Veiliger reductiemiddel: Waterstofperoxide biedt een veiliger alternatief vergeleken met andere reductiemiddelen zoals methanol, zwaveldioxide of chloride.
- Potentieel voor neutrale zoutkoek: Procesaanpassingen kunnen een neutrale zoutkoek opleveren, waardoor de impact op het milieu wordt verminderd.
- Zuivere chloordioxide: Het gebruik van waterstofperoxide kan bijdragen aan een zuiverder ClO2-product.
Vergelijkbaar met op methanol gebaseerde vacuümprocessen (Figuur 1), gebruiken vacuümprocessen de handelsnamen SVP-HP of R11 (de laatste met behulp van een katalysator).
Het meest voorkomende proces onder atmosferische omstandigheden is het Eka Chemicals HP-A-proces (Figuur 2), dat ook van toepassing is op Solvay-, Mathieson- en R2-processen. Dit proces wordt doorgaans geïmplementeerd als een upgrade voor oudere installaties vanwege het vergelijkbare ontwerp.
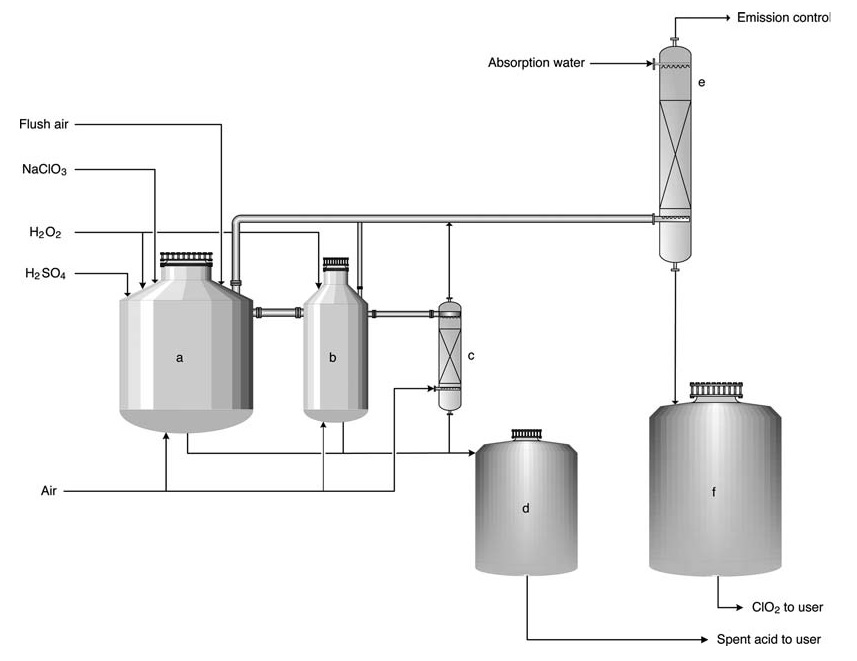
a) Primaire reactor; b) Secundaire reactor; c) Stripper; d) Tank voor verbruikt zuur; e) Absorptietoren; f) Opslagtank voor ClO2-oplossing
In het HP-A-proces worden reactanten in een serie (meestal 2-3) open reactoren gevoerd. Het proces is in wezen adiabatisch en vertrouwt op de verdunningswarmte van zwavelzuur om de reactietemperatuur (meestal 58 °C) en een lichte sub-omgevingsdruk te handhaven. Het grootste deel van de chloraatconversie naar chloordioxide vindt plaats in de eerste reactor.
Het bijproduct zout blijft in oplossing, terwijl grote luchtvolumes worden geïntroduceerd om ClO2 te desorberen en gasconcentraties onder de explosiegrens (10–12 vol%) te houden. Het gas wordt vervolgens naar een absorptietoren geleid voor de productie van ClO2-water.
Verbruikt zuur kan worden gebruikt voor molenverzuring of -aanvulling in het terugwinningsketelsysteem. Het product bevat 8 g/l chloordioxide en is vrijwel vrij van elementair chloor (Cl2-concentratie < 0,2 g/l).
Voor toepassingen op kleinere schaal, zoals waterzuivering of biocideproductie, biedt het SVP-Pure-proces van Eka Chemicals (Figuur 3) een eenvoudige oplossing met een lage investering. Dit proces maakt gebruik van een vooraf gemengde chloraat- en waterstofperoxideoplossing samen met zwavelzuur.
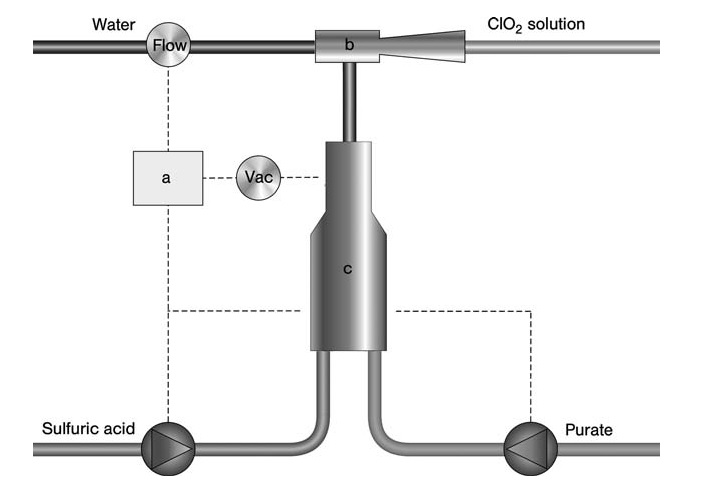
a) Controller; b) Eductor; c) Reactor
Alle reactanten worden gelijktijdig in een subatmosferische reactor gevoerd met behulp van een eductor die wordt aangestuurd door een waterstroom. Deze waterstroom absorbeert de gegenereerde ClO2 en bijproducten om het eindproduct (chloordioxide in water) te vormen.
Het hele systeem is compact en wordt aangestuurd door een microprocessor, wat on-demand productie met directe toepassing van het product mogelijk maakt. Het ClO2-gehalte in dit proces varieert doorgaans van 1–1,5 g/L, met varianten tot 7 g/L voor bleektoepassingen.
2.3. Productie van chloordioxide uit chloraat met zwaveldioxide als reductiemiddel
Zwaveldioxide (SO2) kan worden gebruikt als reductiemiddel in op chloraat gebaseerde processen. Deze integratie bood economische en operationele voordelen en droeg bij aan de populariteit van het Mathieson-proces in de jaren 50.
Het Mathieson-proces speelde, samen met de Solvay- en R2-processen, een belangrijke rol bij de productie van chloordioxide voor pulpbleektoepassingen. Het belang ervan is echter de laatste tijd afgenomen.
Het Mathieson-proces volgt een licht exotherme reactie, zoals weergegeven door de vergelijking:
2 NaClO3 + H2SO4 + SO2 → 2 ClO2 + 2 NaHSO4
Hoewel een concurrerende reactie kan leiden tot chloorvorming, kan deze worden onderdrukt en reageert het meeste gegenereerde chloor verder. De reactiekinetiek is echter relatief traag, wat resulteert in onvolledige chloraatconversie.
Het toevoegen van 1–10 gew.% natriumchloride ten opzichte van chloraat is een gebruikelijke praktijk om de reactiesnelheid te verbeteren. Deze toevoeging verhoogt echter ook de vorming van bijproductenchloor, wat in bepaalde toepassingen ongewenst kan zijn.
De lay-out van het Mathieson-proces lijkt sterk op het HP-A-proces (Figuur 2). Het belangrijkste verschil is de afwezigheid van waterstofperoxide-inlaten. In plaats daarvan wordt zwaveldioxide via de spargerlucht ingebracht.
2.4. Productie van chloordioxide uit natriumchloriet
Natriumchloriet (NaClO2) kan ook worden gebruikt als grondstof voor de productie van chloordioxide, voornamelijk voor kleinschalige toepassingen. Sommige drinkwaterzuiveringsinstallaties kunnen deze methode echter gebruiken voor grootschaligere productie (tot enkele tonnen per dag). Er zijn twee hoofdmethoden:
- Door activering met een zuur
In dit proces reageert chloriet met een zuur (zoutzuur, HCl), zoals weergegeven in de volgende vergelijking:
5 NaClO2 + 4 HCl → 4 ClO2 + 5 NaCl + H2O
Zwavelzuur kan een vervanging zijn, maar leidt tot lagere productiesnelheden vanwege de afwezigheid van chloridekatalyse. Hoewel duurder, met 25% hogere productiekosten, biedt deze methode een ClO2-product zonder chloor.
- Door activering met chloor
Deze methode maakt gebruik van elementair chloor in de gasfase of opgelost in water (waar het hydrolyseert tot hypochloorzuur en zoutzuur). De algehele reactie wordt geïllustreerd in de vergelijking:
2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
Het chloorgas-geactiveerde proces is al lange tijd de industriestandaard. Dit systeem met twee toevoersystemen maakt gebruik van de snelle reactie tussen moleculair chloor en chlorietionen.
De Rio Linda-methode gebruikt aparte toevoersystemen van natriumchlorietoplossing en gasvormig chloor, waardoor ze kunnen reageren voordat ze door een waterstroom via een eductor in de toepassing worden getrokken die de benodigde lage druk creëert.
2.5. Productie van chloordioxide door elektrochemische processen
Chloordioxide kan door elektrochemische methoden worden geproduceerd uit natriumchloriet, meestal vergezeld door natriumhydroxide-productie. Elektrochemie maakt nauwkeurige controle over de ClO2-productie mogelijk; elektroden en membranen zijn echter gevoelig voor onzuiverheden, waardoor gedemineraliseerd water nodig is voor een optimale werking.
De oxidatie van chloriet tot chloordioxide vindt plaats bij de anode en natriumionen migreren door een membraan naar de kathodezijde, waar waterelektrolyse waterstofgas en hydroxide-ionen produceert.
Elektrolyse kan ook worden gebruikt om het zuur te genereren dat nodig is voor de activering van chloriet in het natriumchlorietproces.
Het geproduceerde chloordioxide wordt van de chlorietoplossing gescheiden door luchtstrippen voordat het wordt gebruikt.
Elektrochemie kan ook worden gebruikt om de productie van zoutkoeken te minimaliseren in grootschalige chloraat-gebaseerde processen. Deze methode vermindert het zwavelzuurverbruik door elektrochemisch gegenereerde protonen te gebruiken en natriumionen te verwijderen door middel van co-geproduceerde natronloog.
Hoewel deze elektrochemische processen gunstig zijn voor het milieu, vereisen ze een hoge kapitaalinvestering en een aanzienlijk elektriciteitsverbruik.
2.6. Gestabiliseerde chloordioxideproducten
Verschillende commerciële leveranciers bieden gestabiliseerde chloordioxideproducten aan. Deze producten zijn allemaal gebufferde oplossingen die chloriet- (of chloraat-)ionen bevatten die geactiveerd moeten worden om chloordioxide vrij te geven.
Deze producten zijn er in twee vormen:
- Waterige oplossingen zijn gebufferde oplossingen met chloriet of chloraat, waarvoor zuur moet worden toegevoegd om chloordioxide vrij te geven.
- Vaste stoffen bevatten chloriet of chloraat dat is opgenomen in vaste matrices (gels of absorptiemiddelen) waar chloordioxide aan is gebonden. Activering wordt bereikt door het chloordioxide te verhitten of uit te spoelen.
Gestabiliseerde chloordioxideproducten worden gebruikt in verschillende kleinschalige toepassingen (minder dan 5 kg/dag), zoals geurbestrijding, luchtbehandeling, biocidetoepassingen, desinfectie en waterzuivering.
3. Toepassingen van chloordioxide
Chloordioxide wordt in verschillende sectoren gebruikt, waarbij het bleken van pulp de belangrijkste toepassing is. De economische levensvatbaarheid ervan blijft echter vaak onopgemerkt vanwege de aard van marketing- en vakpersstatistieken.
Vanwege de onstabiele aard ervan kan ClO2 niet worden opgeslagen en moet het op het punt van gebruik worden gegenereerd. Ondanks deze beperking blijft het het meest commercieel waardevolle chlooroxide of chloorzuurstofzuur.
3.1. Toepassingen bij het bleken van pulp
Meer dan 90% van de wereldwijde productie van Kraft-pulp (hardhout en zachthout) gebruikt chloordioxide in elementair chloorvrije (ECF) bleeksequenties. Dit komt doordat ClO2 lignine selectief oxideert, wat de pulpopbrengst verhoogt en de mechanische eigenschappen behoudt.
Hoewel het bleekpotentieel van chloordioxide al meer dan 150 jaar bekend is, vond de brede toepassing ervan pas in de jaren 80 plaats. Veilige en betrouwbare grootschalige productieprocessen die in de jaren 40 ontstonden, droegen bij aan de moderne continue processen die vandaag de dag worden gebruikt.
De belangrijkste reden voor de toepassing van ClO2 bij het bleken van pulp was om de milieu-impact van gechloreerde organische verbindingen die tijdens het bleken met elementair chloor werden gevormd, te beperken. Sinds eind jaren 80 heeft ClO2 elementair chloor grotendeels vervangen.
In tegenstelling tot elementair chloor (een sterke universele chlorinator) introduceert chloordioxide geen chlooratomen in aromatische ringen tijdens het bleken. Dit elimineert de vorming van giftige, sterk gechloreerde organische stoffen zoals dioxinen en polychloorfenolen.
Hoewel sommige adsorbeerbare organische haliden (AOX) nog steeds worden gegenereerd, zelfs met zuivere ClO2, zijn ze gemakkelijker biologisch afbreekbaar, wat resulteert in een lagere milieu-impact van pulpmolenafvalwater.
Zowel ECF als Total Chlorine-Free (TCF) bleken worden, wanneer uitgevoerd met best practices, als milieuvriendelijk beschouwd. Modern bleken omvat een combinatie van chemicaliën en processen om kostenefficiëntie, hoge pulpkwaliteit en lage milieu-impact te bereiken.
Hoogwaardige molens kunnen bleken bereiken met 8–16 kg chloordioxide per ton pulp.
3.2. Andere toepassingen
Naast het bleken van pulp wordt chloordioxide ook in andere sectoren gebruikt, vaak op kleinere schaal.
- Bleken van textielvezels: Net als bij het bleken van pulp, kan chloordioxide worden gebruikt om natuurlijke vezels (wol, katoen) te bleken met specifieke eigenschappen.
- Waterbehandeling: Chloordioxide wordt in duizenden drinkwaterzuiveringsinstallaties gebruikt vanwege de effectiviteit en selectiviteit in vergelijking met alternatieven zoals elementair chloor, hypochloriet, ozon en UV-licht. Het biedt superieure bacteriële controle, geurcontrole en smaakcontrole en genereert geen trihalomethanen zoals chloor en hypochloriet.
- Voedingsindustrie: ClO2 vindt toepassing in microbiële controle in de voedingsindustrie.
- Chloordioxide wordt gebruikt bij desinfectie van afvalwater en slijmcontrole in papiermachines.
- Chloordioxide wordt in olievelden gebruikt voor het verwijderen van biofilms en het neutraliseren van waterstofsulfide en ijzersulfide, die tegendruk in putten kunnen veroorzaken. Daarnaast wordt het gebruikt voor geurcontrole in de olie-industrie.
- Een opkomende toepassing van ClO2 is het verminderen van nitreuze gassen uit verbrandingsprocessen (kolenketels, afvalverbrandingsinstallaties en terugwinningsketels). Deze toepassing biedt een hoge verwijderingsefficiëntie (meer dan 90%) voor NOx en kwik met een goede economie.
4. Toxicologie van chloordioxide

Chloordioxide brengt specifieke gevaren met zich mee voor de menselijke gezondheid en kan explosies veroorzaken. In dit gedeelte worden de belangrijkste veiligheidsaspecten voor het hanteren van ClO2 uiteengezet.
Blootstellingseffecten en -limieten
- De afgifte van chloordioxidegas of -vloeistof is gemakkelijk te detecteren vanwege de scherpe geur, die lijkt op die van chloor.
- Lage concentraties irriteren de luchtwegen en ogen.
- Hogere concentraties kunnen ernstige hoest, longoedeem (vochtophoping in de longen) en zelfs de dood veroorzaken.
- Er zijn geen gegevens bij mensen over de carcinogeniciteit of genotoxiciteit van chloordioxide.
- Beroepsmatige blootstellingslimieten zijn:
- 8-uurs tijdgewogen gemiddelde (TWA): 0,1 ppm
- Kortetermijnblootstellingslimiet (STEL): 0,3 ppm
Veilige verwerkingspraktijken
- Voer verwerking en opslag uit in goed geventileerde ruimtes.
- Houd koele opslagtemperaturen aan en gebruik minimale hoeveelheden oplossing.
- Implementeer procedures voor procesveiligheidsbeheer.
- Zorg voor training en de juiste veiligheidsuitrusting (ademhalingsbescherming, chemische spatbrillen, handschoenen en laarzen).
- Voorzie ClO2-installaties en toepassingspunten van gaslekdetectiealarmen die zijn ingesteld op 0,1 ppm (TWA-limiet).
Explosiegevaar
- Gasvormig chloordioxide is explosief bij concentraties van meer dan 10% in lucht (partiële druk van 10 kPa).
- De ontleding tot chloor en zuurstof is exotherm en vergroot het gasvolume, wat leidt tot een toename van de druk en een mogelijke schokgolf.
- De ontleding kan worden geïnitieerd door metaaloxideverontreinigingen, hete oppervlakken, snelle zuurverdunning, drukschokken, hitte of zonlicht.
Referenties
- Chlorine Oxides and Chlorine Oxygen Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_483.pub2
- Halogens; Descriptive Inorganic Chemistry. – https://www.sciencedirect.com/science/article/abs/pii/B9780128046975000178
- The Chemistry of Chlorine Dioxide. – https://onlinelibrary.wiley.com/doi/10.1002/9780470166161.ch3
