2-Chloorfenol: Eigenschappen, Productie en Toepassingen
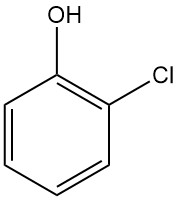
2-Chlorofenol, ook bekend als ortho-chlorofenol, is een aromatische verbinding met de chemische formule C6H4ClOH. Het is een vloeistof met een sterke, onaangename geur.
Inhoudsopgave
1. Fysieke eigenschappen van 2-chloorfenol
2-chloorfenol is een kleurloze tot amberkleurige vloeistof (commerciële monsters kunnen een gele tint hebben) met een sterke, doordringende geur. Het is oplosbaar in water en zeer oplosbaar in alcoholen, ethers en alkali-oplossingen omdat het een zwak zuur is. Belangrijke fysieke eigenschappen van 2-chloorfenol worden weergegeven in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [95-57-8] |
| Moleculair gewicht | 128,56 g/mol |
| Smeltpunt | 8,7 °C |
| Kookpunt | 174,5 °C |
| pKa | 8,52 |
| Dichtheid bij 20 °C | 1,263 |
| Soortelijke warmte bij 20 °C, J.mol-1K-1 | 177 |
| Vormingswarmte bij 50 °C, kJ/mol | 185 |
| Dampspanning bij 25 °C | 2,53 mmHg |
| Viscositeit bij 50 °C, mPa.s | 2 |
| Breukindex | 1,55 |
| Oplosbaarheid in water bij 20 °C | 28,5 g/L |
| Vlampunt (gesloten beker) | 121 °C |
2. Chemische reacties van 2-chloorfenol
2-chloorfenol is een waardevol uitgangsmateriaal in verschillende chemische syntheses vanwege de reactiviteit van zowel de hydroxylgroep als de aromatische ring. Het neemt deel aan zowel elektrofiele als nucleofiele substituties en oxidatiereacties.
2.1. Reactiviteit van de hydroxylgroep
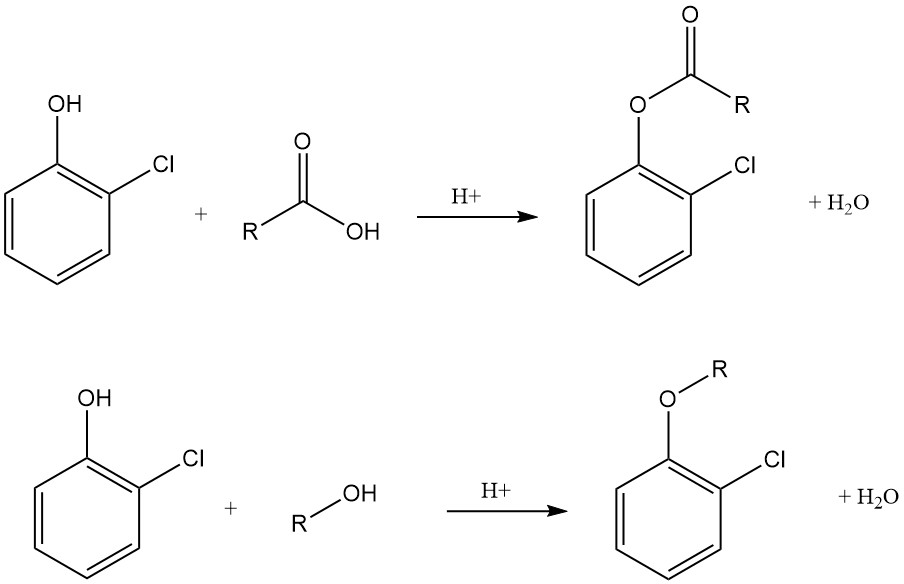
Vergeleken met fenol is 2-chloorfenol zuurder en vormt het stabiele en in water oplosbare zouten met alkali- en aardalkalimetaalhydroxiden, carbonaten of aminen. Het vormt gemakkelijk esters met organische en anorganische zuren, waaronder het veelgebruikte 2-chloorfenylfosfaat, carbamaat, chloorformiaat, carbonaat en lauraat.
2-chloorfenol ondergaat O-alkylering om een divers scala aan ethers te genereren die zijn afgeleid van alifatische, aromatische en heterocyclische verbindingen.
2.2. Elektrofiele aromatische substitutie
De aanwezigheid van een chlooratoom op de aromatische ring van 2-chloorfenol maakt elektrofiele substitutiereacties eenvoudiger. Daarom kan het deelnemen aan standaardreacties zoals alkylering, acylering, nitratie, sulfonering, halogenering, carboxylering en condensatie met aldehyden zoals formaldehyde, chloraal en glyoxylzuur.
2.3. Nucleofiele aromatische substitutie
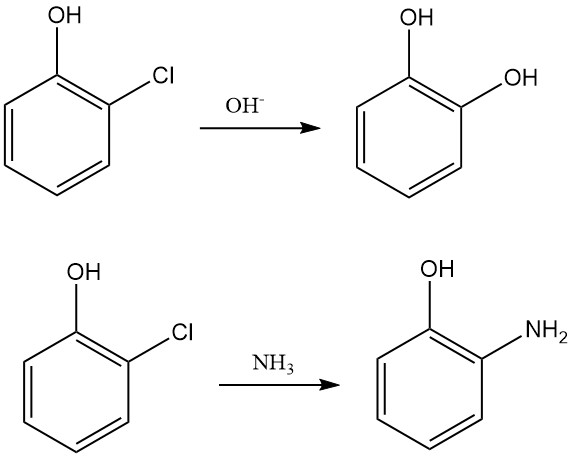
Nucleofiele substitutie van het chlooratoom in 2-chloorfenol wordt nog steeds gebruikt in chemische synthese, voornamelijk om pyrocatechol te produceren door te reageren met kalium of natriumhydroxide. 2-Chloorfenol reageert ook met ammoniak om 2-aminofenol te vormen.
Dit type reactie is met name nuttig voor de productie van verschillende gesubstitueerde difenylethers, die efficiënte herbiciden zijn.
2-Chlorofenol kan worden omgezet in polychlooralicyclische ketonen, zoals “hexachlorofenol” (een pesticide), door reactie met chloor in waterig azijnzuur. In aanwezigheid van een zure katalysator zoals zwavelzuur hydrolyseert hexachlorofenol tot chloranil.
2.4. Oxidatie
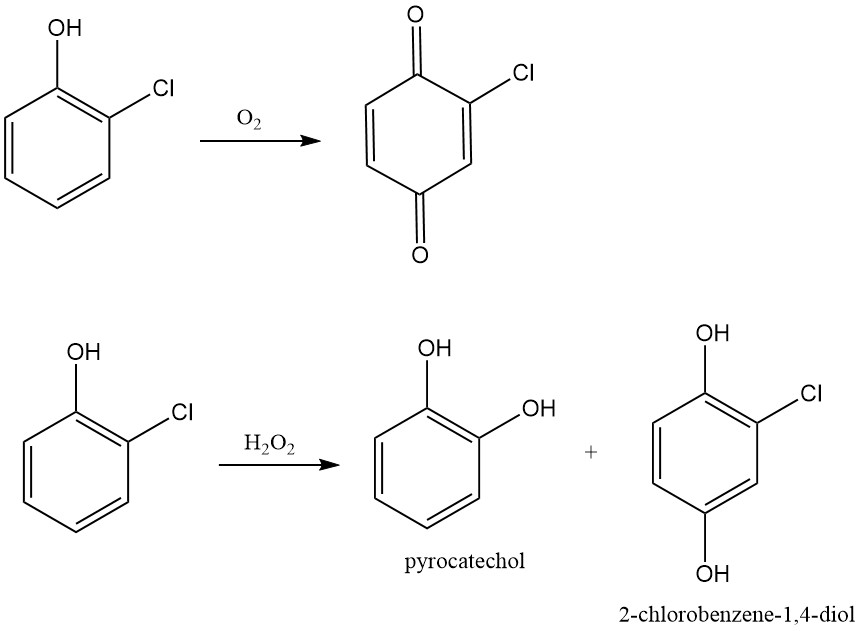
Net als andere fenolen ondergaat 2-chlorofenol oxidatie. Luchtoxidatie leidt tot de vorming van 2-chlorochinon, terwijl waterstofperoxideoxidatie de overeenkomstige gechloreerde difenolen produceert. Peroxide-gemedieerde oxidatie van 2-chloorfenol met behulp van perpropionzuur in benzeen bij 80 °C levert chloordifenolen (3-chloorcatechol en chloorhydrochinon) op met een opbrengst van 85%.
3. Productie van 2-chloorfenol
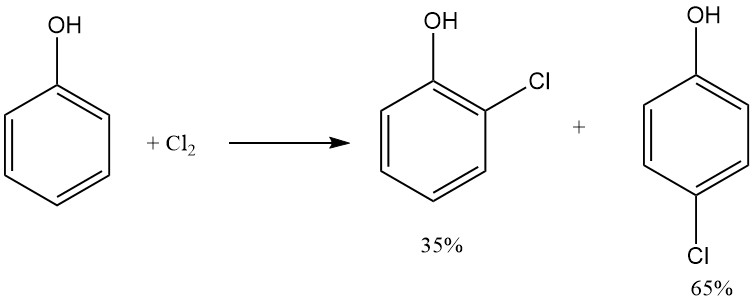
2-chloorfenol wordt geproduceerd door de directe chlorering van gesmolten fenol met behulp van chloorgas. Dit proces levert een mengsel op van ortho- en para-monochloorfenol, met 2-chloorfenol op 35% en 4-chloorfenol op 65%, en is bijna niet afhankelijk van de temperatuur.
Om de opbrengst van 2-chloorfenol te verhogen, kunnen de volgende wijzigingen worden aangebracht aan het chloreringsreagens of het reactiemedium:
- Oplosmiddel: Aprotische niet-polaire oplosmiddelen zoals hexaan, koolstoftetrachloride en dichloorethaan bevorderen de vorming van 2-chloorfenol.
- Temperatuur en concentratie: Hogere temperaturen en lagere fenolconcentraties begunstigen het ortho-isomeer.
- Chloreringsmiddel: Bepaalde reagentia zoals diisopropylamine (0,01 gew.% in perchloorethyleen, 110 °C) leveren een zeer hoge o/p-verhouding (15).
- De chlorering van fenol met behulp van natriumhypochloriet (pH 10), tert-butylhypochloriet, alkalifenolaten in watervrije media en chloor in azijnzuur met azijnzuuranhydride bevordert de vorming van 2-chloorfenol.
4. Toepassingen van 2-chloorfenol
2-chloorfenol heeft beperkte huidige toepassingen vanwege de beschikbaarheid van veiligere en effectievere alternatieven. Het heeft echter enkele historische en potentiële toepassingen.
In het verleden werd 2-chloorfenol gebruikt als ontsmettingsmiddel vanwege zijn bacteriedodende en kiemdodende eigenschappen. De potentiële gezondheidsrisico’s leidden er echter toe dat het in de meeste ontsmettingstoepassingen werd stopgezet.
Het primaire gebruik van 2-chloorfenol is tegenwoordig als tussenproduct bij de productie van andere chemicaliën. Het dient als uitgangsmateriaal voor de synthese van verschillende verbindingen, waaronder:
- Herbiciden: Bepaalde fenoxyherbiciden, zoals dichloorfenoxyazijnzuur (2,4-D), kunnen worden geproduceerd met 2-chloorfenol als voorloper.
- Kleurstoffen: Sommige kleurstoffen, met name azokleurstoffen, gebruiken 2-chloorfenol als uitgangsmateriaal bij hun synthese.
- Hoger gechloreerde fenolen, catechol en profenofos.
Er wordt onderzoek gedaan naar mogelijke nieuwe toepassingen voor 2-chloorfenol, met name op gebieden als de ontwikkeling van nieuwe fungiciden of insecticiden, de productie van biobased polymeren en de extractie van zwavel- en stikstofverbindingen uit steenkool.
5. Toxicologie van 2-chloorfenol
2-chloorfenol vertoont aanzienlijke toxiciteit en veroorzaakt verschillende nadelige effecten bij blootstelling.
Hoge doses 2-chloorfenol veroorzaken convulsies, vaak veroorzaakt door externe stimuli zoals aanraking of geluid. Andere symptomen zijn onder meer agitatie, snelle ademhaling (polypneu), spierzwakte, ademnood (dyspnoe) en coma, wat mogelijk tot de dood kan leiden. Herhaalde blootstelling aan toxische niveaus beschadigt voornamelijk de lever en de nieren.
Voor ratten zijn de orale en percutane LD50-waarden respectievelijk 670 mg/kg en 950 mg/kg.
Onderzoek naar de eliminatie en het metabolisme van 2-chloorfenol blijft inconclusief. Studies suggereren dat honden het voornamelijk uitscheiden via de urine, zowel in vrije als geconjugeerde vorm (87%). Konijnen lijken daarentegen 2-chloorfenol om te zetten in chloorbenzeen vóór de uitscheiding.
Momenteel zijn er geen gerapporteerde gevallen van chronische gezondheidseffecten bij mensen die zijn blootgesteld aan lage doses 2-chloorfenol.
Referenties
- Chlorophenols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a07_001.pub2
- https://pubchem.ncbi.nlm.nih.gov/compound/2-Chlorophenol
