Wat is aceton?
Aceton, ook bekend als 2-propanon, is een kleurloze, ontvlambare vloeistof met een scherpe geur en een lage viscositeit. Het is de eenvoudigste keton, met de formule C3H6O. Aceton is mengbaar met water, wat betekent dat het gemakkelijk mengt met water in elke verhouding.
Het wordt voornamelijk gebruikt als oplosmiddel en tussenproduct bij de synthese van verschillende chemicaliën, zoals bisfenol A, methylmethacrylaat, aldolchemicaliën (diacetonalcohol, mesityloxide en methylisobutylketon) en andere producten.
Historisch gezien werd aceton tot begin 1900 commercieel geproduceerd via de droge distillatie van calciumacetaat.
Aceton is ook aanwezig in de natuur, zoals in bomen en planten en het wordt ook metabolisch geproduceerd in het menselijk lichaam, voornamelijk door de afbraak van vet. Bovendien is aceton gemakkelijk biologisch afbreekbaar.
Inhoudsopgave
1. Productie van aceton
Op dit moment is het cumeenproces het belangrijkste middel voor de productie van aceton, goed voor meer dan 6 miljoen ton productie wereldwijd per jaar.
Andere productiemethoden dragen minder dan 5% bij aan de wereldwijde capaciteit.
1.1. Productie van aceton door cumeenproces
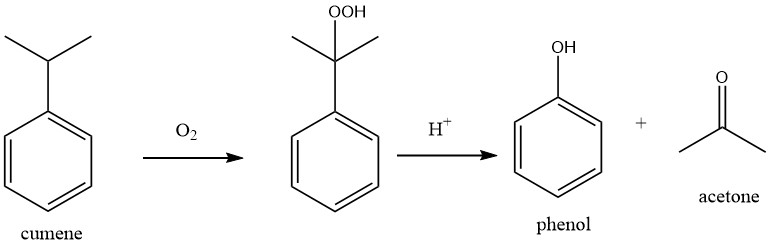
De productie van aceton uit benzeen en propeen omvat een proces in twee stappen.
In de eerste stap wordt Friedel-Crafts-alkylering gebruikt om cumeen te produceren uit benzeen en propeen in het cumeenproces.
Tijdens dit proces worden laagkokende koolwaterstoffen, zoals propaan, gescheiden van de propeengrondstof in de cumeendestillatie-eenheid. De hoogkokende componenten, voornamelijk polyisopropylbenzenen, worden gescheiden en verzameld als residu.
De benzeen- en propeengrondstoffen genereren een kleine hoeveelheid water als onzuiverheden.
In de tweede stap van het proces, bekend als het Hock-proces, wordt cumeen geoxideerd met atmosferische zuurstof om cumeenhydroperoxide (CHP) te produceren. Met behulp van een sterk mineraalzuur als katalysator wordt CHP vervolgens gesplitst om fenol en aceton op te leveren.
Tijdens het destillatieproces worden laagkokende componenten, voornamelijk ketonen uit aceton, gescheiden, terwijl de hoogkokende componenten die in de oxidatie- en splitsingseenheid worden gevormd, als residu worden verzameld.
In het fenol-acetonproces wordt een bepaalde hoeveelheid proceswater gegenereerd en moet worden behandeld in een biologische afvalwaterzuiveringsinstallatie.
De algehele reactie van het proces kan worden beschreven als een dubbele oxidatie, waarbij benzeen wordt geoxideerd tot fenol en propeen wordt geoxideerd tot aceton.
1.2. Productie van aceton door dehydrogenering van 2-propanol

De dehydrogenering van 2-propanol (isopropanol), dat wordt gevormd door de hydratatie van propeen, vertegenwoordigt een alternatieve route om aceton te produceren. De dehydrogeneringsreactie is bekend endotherm te zijn.
Dit proces was verantwoordelijk voor ongeveer 50-60% van de totale acetonproductie in de VS in de jaren 70.
Tegenwoordig is het cumeenoxidatieproces met aceton als co-product echter de belangrijkste bron van acetonproductie wereldwijd geworden.
Er zijn verschillende katalysatoren in de literatuur gerapporteerd voor de dehydrogenering van 2-propanol.
Propeen is het primaire bijproduct, dat wordt gevormd door de dehydratie van de overeenkomstige alcohol. Naast propeen worden ook aldehyden en mesityloxide gevormd.
Het dehydrogeneringsproduct, dat aldehyden, mesityloxide, water, 2-propanol en aceton bevat, wordt onderworpen aan een wasstap met 35% waterige natronloog om de aldehyden te verwijderen. Dit wordt gevolgd door distillatie in verschillende stappen om lichte boilers en aceton uit de alcohol en het water te verwijderen.
1.3. Productie van aceton door propeenoxidatie

Het Wacker-Hoechst-proces biedt een elegante methode voor de productie van aceton. Dit proces omvat de oxidatie van propeen met behulp van lucht of zuurstof als oxidant, bij een temperatuurbereik van 110-120 °C en een druk van 10-14 bar.
Een katalysatorsysteem bestaande uit PdCl2 en CuCl2 wordt in het proces gebruikt.
De PdCl2 fungeert als katalysator, terwijl de CuCl2 Pd° reoxideert tot de bivalente toestand. Het koper(I)chloride kan eenvoudig worden geoxideerd tot koper(II)chloride met behulp van zuurstof.
De selectiviteit van dit proces voor aceton is ongeveer 92%, waarbij propionaldehyde wordt gevormd als bijproduct, samen met gechloreerde verbindingen zoals monochlooraceton en 1,1-dichlooraceton.
Er zijn twee verschillende processen voor directe oxidatie mogelijk, vergelijkbaar met het acetaldehydeproces.
In het eerste proces wordt de katalysator in één fase behandeld met propeen en zuurstof.
In het tweede proces wordt de katalysator in de eerste fase behandeld met propeen en vervolgens in de tweede fase geregenereerd met behulp van zuurstof.
Het tweefasenproces heeft de voorkeur omdat een propeen-propaanmengsel als voeding kan worden gebruikt. Propaan is inert voor oxidatie en neemt niet deel aan de reactie.
2. Chemische reacties van aceton
Zuivere aceton is zeer gevoelig voor krachtige oxidatiemiddelen, zoals waterstofperoxide en organische peroxiden.
Bij blootstelling aan verdund zuur en waterstofperoxide wordt acetonperoxidetrimeer gevormd.
Wanneer aceton reageert met sterke reductiemiddelen, genereert het hitte en kan het explosies veroorzaken.
Sterke alkali veroorzaakt ook hitteproductie bij reactie met aceton.
Bovendien kan aceton gemengd met chloroform in aanwezigheid van alkali een heftige reactie veroorzaken.
De reactiviteit van aceton wordt bepaald door de CO-binding. Het zuurstofatoom heeft de neiging elektronen van de dubbele binding aan te trekken, zoals blijkt uit de mesomere structuur van de carbonylgroep. Als gevolg hiervan is het meest voorkomende carbonylreactiemechanisme nucleofiele aanval op het C-atoom van de carbonylgroep.
Protonering van het zuurstofatoom gaat vaak gepaard met nucleofiele aanval.
De reactie van aceton met HCN in aanwezigheid van een base zoals KOH leidt tot de vorming van acetoncyaanhydrine, waarbij het cyanide-ion, afgeleid van HCN en KOH, verantwoordelijk is voor de nucleofiele aanval.
Zuren katalyseren de additie van zwakke nucleofielen.
De protonering van het zuurstofatoom van de carbonylgroep creëert een carbokation dat gemakkelijker kan worden aangevallen door de nucleofiel. Een voorbeeld van zo’n reactie is de vorming van een hemiketaal of een ketaal uit de reactie van een alcohol met aceton.
Verschillende nucleofiele reacties met aceton zijn in de literatuur gerapporteerd, zoals de vorming van tertiaire alcoholen door te reageren met Grignard-reagentia (RmgX), 2-propanol met LiAlH4 of NaBH4, en iminen met primaire aminen, oxime met hydroxylamine en fenylhydrazon met hydrazine.
Het α-waterstofatoom aan de carbonylgroep in aceton is zuur. De aanwezigheid van de carbonylgroep versterkt de elektronenpolarisatie, wat resulteert in een elektropositiever waterstofatoom. Het resulterende anion wordt gestabiliseerd door mesomere dislocatie van de negatieve lading tussen het koolstofatoom en het carbonylzuurstofatoom.
De base-gekatalyseerde aldolreactie van twee acetonmoleculen in aanwezigheid van alkali produceert diacetonalcohol.
3. Toepassingen van aceton
Aceton wordt gebruikt als chemisch tussenproduct bij de productie van verschillende chemicaliën, waaronder methylmethacrylaat (MMA), bisfenol A en aldolverbindingen zoals diacetonalcohol (DAA), mesityloxide (MOX) en methylisobutylketon (MIBK).
Het primaire gebruik in de chemische industrie is het produceren van acetoncyaanhydrine.
Naast het gebruik als chemisch tussenproduct is aceton een veelzijdig oplosmiddel met talloze toepassingen. De wereldwijde jaarlijkse productie van aceton wordt geschat op meer dan 6 miljoen ton.
In 2010 was 29% van het acetongebruik afkomstig van directe oplosmiddeltoepassingen, gevolgd door acetoncyaanhydrine/MMA met 24% en bisfenol A met 22%.
Referentie
- Acetone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_079.pub4