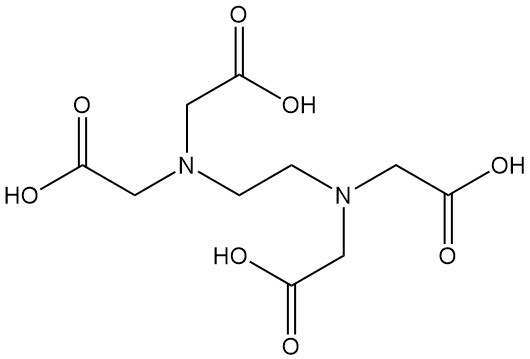
Was ist Ethylendiamintetraessigsäure?
Ethylendiamintetraessigsäure, besser bekannt als EDTA, ist eine Aminopolycarbonsäure mit der Formel C10H16N2O8. Es ist ein weißer Feststoff, der in Wasser unlöslich ist und einer der am häufigsten verwendeten Chelatbildner in verschiedenen Industrien ist.
Ethylendiamintetraessigsäure (EDTA), Nitrilotriessigsäure (NTA) und ihre jeweiligen Salze wurden erstmals in den 1930er Jahren von Ferdinand Munz in den Laboren der I.G. Farbenindustrie synthetisiert. Seitdem haben sie als industrielle Chelatbildner erheblich an Bedeutung gewonnen.
Aminopolycarbonsäuren (wie EDTA) können ähnlich wie Aminosäuren Salze mit starken Säuren und Basen bilden. Darüber hinaus besitzen sie die Fähigkeit, starke, wasserlösliche Komplexe mit zwei- und dreiwertigen Kationen zu bilden. Diese Komplexe verändern die Reaktivität des Metallions erheblich und machen sie zu wertvollen Verbindungen in verschiedenen industriellen Prozessen.
Die wichtigste industrielle Anwendung von EDTA besteht darin, Kesselstein und unlösliche Ablagerungen, die Kalzium, Barium, Eisen und andere Kationen enthalten, zu verhindern oder zu entfernen.
Table of Contents
1. Physikalische Eigenschaften von Ethylendiamintetraessigsäure (EDTA)
Ethylendiamintetraessigsäure ist ein farbloser, kristalliner Feststoff, der in Wasser leicht löslich ist. Wichtige physikalische Eigenschaften von EDTA sind in der folgenden Tabelle aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [60-00-4] |
| Chemische Formel | C10H16N2O8 |
| Molekulargewicht | 292,24 g/mol |
| Schmelzpunkt | 245 °C (Zersetzung) |
| Relative Dichte | 0,86 g/cm3 |
| Löslichkeit in Wasser bei 20 °C | 0,1 g/L |
| pKa1 | 2 |
| pKa2 | 2,7 |
| pKa3 | 6,16 |
| pKa4 | 10,26 |
| Flammpunkt | > 100 °C |
2. Chemische Eigenschaften von Ethylendiamintetraessigsäure
EDTA bildet wasserlösliche Komplexe mit zwei- und dreiwertigen Metallkationen. Diese Komplexe weisen eine Ringstruktur auf, die als Chelat bezeichnet wird (vom griechischen „chele“, was Klaue bedeutet), wobei das Metallion fest durch den dissoziierten Liganden EDTA4- gebunden ist.
Die Stärke dieses Komplexes wird durch die Stabilitätskonstante quantifiziert, die die Gleichgewichtskonzentrationen des Metallions (M) und des Chelatbildners (EDTA4-) widerspiegelt.
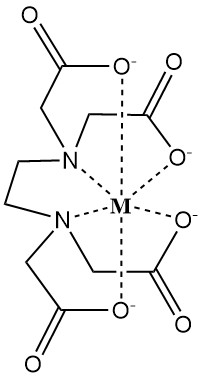
Faktoren, die die Chelatstärke beeinflussen, sind pH-Wert, konkurrierende Anionen und ausfällende Anionen.
Ein höherer pH-Wert begünstigt die Chelatbildung, da er die Konzentration vollständig dissoziierter Chelat-Anionen (z. B. EDTA4-) erhöht und so deren Bindungskapazität verbessert. Dieser Effekt kann jedoch durch Hydroxylionen (OH–) bei hohem pH-Wert ausgeglichen werden, die Metallchelate zerstören können, wenn das Metall unlösliche Hydroxide bildet (z. B. Fe3+-Ausfällung über pH 5,5).
Anionen wie Karbonat, Phosphat und Oxalat können mit dem Chelatbildner konkurrieren und so die effektive Stärke des Metall-Chelatbildner-Komplexes verringern.
Im Allgemeinen bilden Chelatbildner wie EDTA 1:1-Komplexe mit Metallionen. Eine Erhöhung der Chelatbildnerkonzentration über 1:1 kann die Stabilität jedoch weiter verbessern.
Die Umwandlung von Metallkationen in anionische Metallkomplexe verändert ihre Wechselwirkung mit anderen Spezies. Beispielsweise kann sich der negativ geladene [Fe(III)(EDTA)]–-Komplex leichter durch den Boden bewegen als das absorbierte Fe3+-Kation.
Die Chelatisierung senkt die Konzentration freier Metallionen (M) durch Komplexbildung und erhöht so effektiv das effektive Oxidationspotential. Dieses Prinzip ist die Grundlage für verschiedene wichtige industrielle Prozesse.
3. Herstellung von Ethylendiamintetraessigsäure (EDTA)
Ethylendiamintetraessigsäure (EDTA) wurde kommerziell durch die Reaktion von Ethylendiamin, Chloressigsäure und Natriumhydroxid hergestellt. Dieser Prozess führte zu einem mit Natriumchlorid verunreinigten Produkt und wurde aufgrund von Reinigungsproblemen aufgegeben.
Andere Methoden, wie die katalytische Oxidation bestimmter Ausgangsstoffe, wurden untersucht, aber nie kommerziell übernommen.
Heute dominieren zwei Hauptprozesse die Produktion von EDTA und verwandten Chelatbildnern, die beide die Cyanomethylierung des Stammpolyamins beinhalten.
3.1. Die alkalische Cyanomethylierung von Ethylendiamin
Die alkalische Cyanomethylierung von Ethylendiamin ist das am häufigsten verwendete Verfahren zur Synthese von Ethylendiamintetraessigsäure.
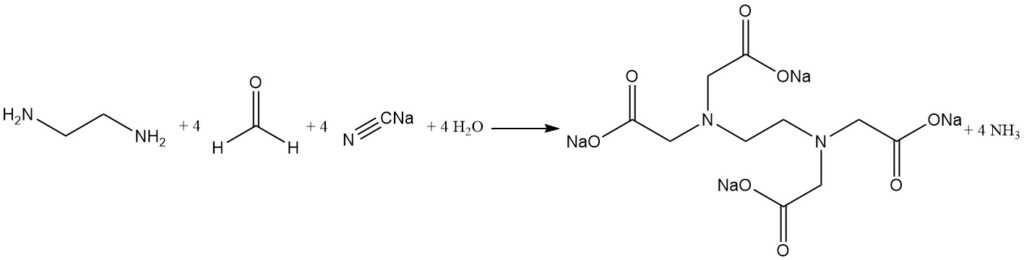
Natriumcyanid und Formaldehyd reagieren mit Ethylendiamin zu EDTA in hoher Ausbeute (über 90 %). Ammoniak ist das wichtigste Nebenprodukt und wird während der Reaktion kontinuierlich entfernt. Kleinere Mengen Ammoniak reagieren jedoch zu Salzen unerwünschter Nebenprodukte wie Nitrilotriessigsäure und Glycin.
Glykolsäuresalze können auch aus der Reaktion zwischen Ausgangsstoffen entstehen. Diese Verunreinigungen haben nur minimale Auswirkungen auf die meisten Anwendungen von Chelatbildnern.
3.2. Die zweistufige Singer-Synthese
Die zweistufige Singer-Synthese trennt den Cyanomethylierungsschritt von der Hydrolysereaktion. Dabei reagieren Cyanwasserstoff und Formaldehyd mit Ethylendiamin zu einem Zwischenprodukt mit hoher Ausbeute (über 96 %), (Ethylendinitrilo)tetraacetonitril.
Dieses unlösliche Zwischenprodukt wird isoliert, gewaschen und dann mit Natriumhydroxid hydrolysiert, um reines Tetranatrium-EDTA mit Ammoniak als Nebenprodukt zu erhalten. Durch die Aufteilung der Reaktion in zwei Schritte wird die Bildung von Verunreinigungen minimiert und ein hochgereinigtes Chelatisierungsmittel erzeugt.
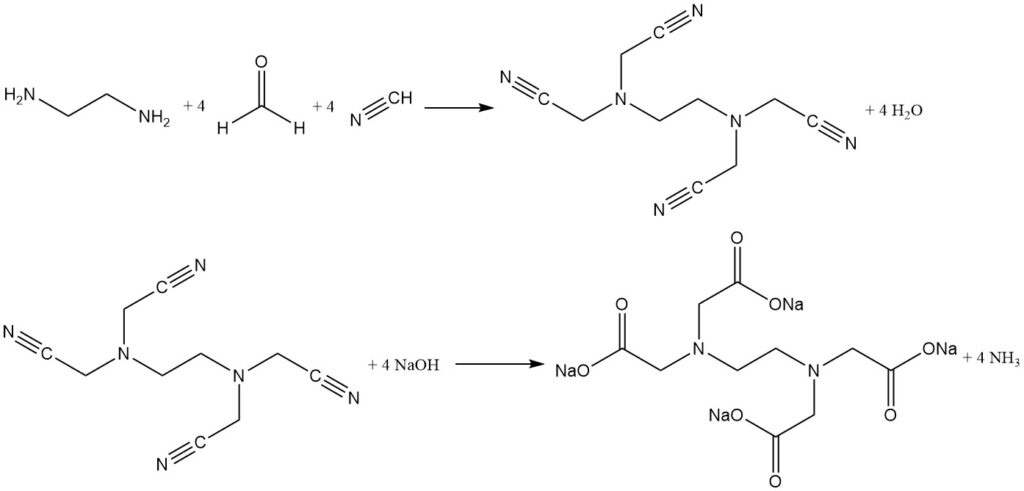
Dieser zweistufige Ansatz wird auch zur effizienten Herstellung von reiner Nitrilotriessigsäure unter Verwendung von Ammoniak verwendet.
4. Verwendung von Ethylendiamintetraessigsäure (EDTA)
Chelatbildner wie EDTA mit ihrer einzigartigen Fähigkeit, Metallionen zu binden und zu inaktivieren, finden Anwendung in verschiedenen Branchen.
EDTA-artige Chelatbildner verhindern unerwünschte Farbveränderungen in Farbstoffen, indem sie Spurenmetallverunreinigungen aus Fasern, Chemikalien und Wasser komplexieren.
EDTA verbessert die Helligkeit von mit Wasserstoffperoxid oder Dithionit gebleichtem Papierzellstoff. Es wirkt als Stabilisator und Metallionenkontrollmittel während der Zellstoffherstellung und Bleichphase.
EDTA wird verwendet, um Kesselsteinablagerungen zu entfernen und die Bildung von Kalzium- und Magnesiumablagerungen durch Komplexierung dieser Metallionen zu verhindern. Eine ordnungsgemäße Dosierungskontrolle ist jedoch wichtig, um zu vermeiden, dass übermäßige Chelatbildner zu Korrosion führen.
Polymere werden manchmal in Verbindung mit Chelatbildnern verwendet, um ihr Korrosionspotenzial zu minimieren.
EDTA kann zum Reinigen von Metalloberflächen eingesetzt werden, indem es anhaftende Oxidfilme auflöst und so ein gründliches Abspülen ermöglicht. Metallbeschichtungslösungen enthalten häufig Chelatbildner wie EDTA, um komplexe Metallionen zu bilden, was zu glatteren und gleichmäßigeren Metallbeschichtungen führt.
Waschmitteln, Reinigern für harte Oberflächen und Badezimmerreinigern wird EDTA zugesetzt, was ihre Reinigungskraft verbessert.
EDTA zerstört die äußere Zellwand bestimmter Bakterien, insbesondere gramnegativer Bakterien, und erhöht so die Wirksamkeit von Desinfektionsmitteln. Es wirkt auch als Konservierungsmittelverstärker in Kosmetika, Shampoos und ophthalmischen Produkten, indem es deren bakterizide Wirkung erhöht.
Ethylendiamintetraessigsäure verhindert oxidative Ranzigkeit in Fettemulsionen wie Mayonnaise und Salatdressings, indem sie Metallionen komplexiert, die den Verderb beschleunigen können. Außerdem verhindert sie Verfärbungen, die durch Eisen in Lebensmitteln wie Kartoffeln verursacht werden.
Die Chelatisierung mit EDTA wird kommerziell bei der Emulsionspolymerisation von Styrol-Butadien-Kautschuk und beim Bleichen von Fotofilmen eingesetzt. Eisenchelate werden zur Kontrolle industrieller Schwefelwasserstoffemissionen und als reversible Absorptionsmittel für Stickoxide eingesetzt.
Spurenmetallionen können chemische Prozesse stören. Chelatbildner wie EDTA entfernen diese unerwünschten Metalle, um die Prozesseffizienz sicherzustellen und die Produktspezifikationen zu erfüllen.
Mikronährstoffe wie Eisen, Zink, Mangan und Kupfer werden Düngemitteln in chelatierter Form zugesetzt. Dies verhindert, dass sie mit Phosphaten und anderen Bodenbestandteilen interagieren, die Niederschläge verursachen und ihre Aufnahme durch Pflanzen verringern können.
Durch die Chelatisierung können diese Mikronährstoffe leichter durch den Boden in die Wurzelzone gelangen, wo sie von den Pflanzen aufgenommen werden.
EDTA wird aufgrund der schnellen Änderung der Konzentration freier Metallionen am Äquivalenzpunkt häufig in titrimetrischen Methoden verwendet. Es wird auch als Maskierungsmittel in einigen spektrophotometrischen Methoden verwendet, um Störungen durch Metallionen zu eliminieren.
EDTA ist der dominierende Chelatbildner und macht fast die Hälfte des Gesamtverbrauchs in Westeuropa aus (78.000 Tonnen im Jahr 2004). Zu den wichtigsten Herstellern zählen Dow Chemical, BASF und AkZO.
5. Toxikologie von EDTA
EDTA und seine Salze werden seit langem sicher in verschiedenen Anwendungen eingesetzt, darunter als Lebensmittelzusatzstoffe, Pharmazeutika und Kosmetika. Frühe toxikologische Studien deuten auf eine relativ geringe Toxizität hin.
Studien an Ratten weisen auf eine hohe letale Dosis (LD50) für Na2EDTA (Dinatriumsalz) hin, die zwischen 2,0 und 2,2 Gramm pro Kilogramm Körpergewicht liegt.
Studien mit 0,5 % bis 5,0 % Na2EDTA in der Nahrung zeigten keine signifikanten Nebenwirkungen außer Durchfall und verringerter Nahrungsaufnahme bei der höchsten Dosierung. Trinatrium-EDTA scheint kein Hautsensibilisator zu sein.
Obwohl EDTA mit genetischem Material interagieren kann, scheint seine Bedeutung für die menschliche Genotoxizität (Verursachung genetischer Schäden) minimal zu sein. Studien zu Na3EDTA (Trinatriumsalz) haben keine Karzinogenität im Zusammenhang mit der Verbindung gezeigt.
Referenz
- Ethylenediaminetetraacetic Acid and Related Chelating Agents; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a10_095.pub2