Wijnsteenzuur: eigenschappen, reacties, productie en toepassingen
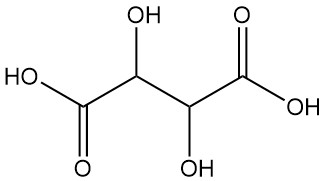
Wat is wijnsteenzuur?
Wijnsteenzuur, ook bekend als acidum tartaricum, 2,3-dihydroxybutaandizuur (IUPAC-nomenclatuur), is een wit kristallijn organisch zuur dat van nature voorkomt in veel fruitsoorten met de formule C4H6O6. Het molecuul bezit twee asymmetrische koolstofcentra met twee carbonzuurgroepen en een dialcohol in hetzelfde molecuul, wat resulteert in vier stereo-isomeren.
Enantiomeren:
- L(+)-wijnsteenzuur en D(-)-wijnsteenzuur zijn optisch actieve isomeren die het vlak van gepolariseerd licht roteren. Deze spiegelbeeldmoleculen (enantiomeren) delen identieke fysieke en chemische eigenschappen, behalve tegengestelde optische rotaties.
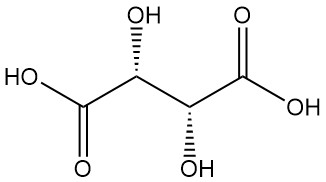
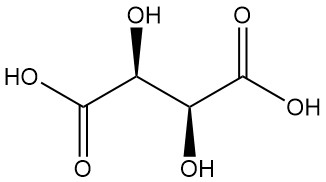
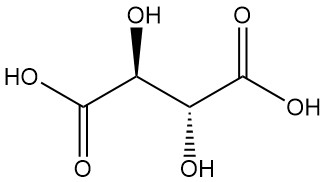
Diastereomeren:
- DL-wijnsteenzuur (racemisch mengsel) is een synthetische equimolaire combinatie van L(+) en D(-) vormen. Het is optisch inactief vanwege interne compensatie.
- Meso-wijnsteenzuur (onoplosbaar wijnsteenzuur) is een ander optisch inactief diastereomeer met verschillende fysieke eigenschappen vergeleken met zowel de actieve als de racemische vormen. Noch racemisch noch meso-wijnsteenzuur zijn optisch actieve zuren.
Wijnsteenzuur, al sinds de oudheid bekend om zijn kaliumzout (tartaar), werd voor het eerst geïsoleerd door Scheele in de 18e eeuw. Berzelius bepaalde de structuur ervan in 1830. Pasteurs baanbrekende werk (1848-1860) over wijnsteenzuurzouten bracht een revolutie teweeg in de organische chemie.
Hij legde het verband uit tussen racemische en optisch actieve vormen door kristallen van natriumammoniumtartraat te scheiden en hun overeenkomstige optische rotaties te demonstreren.
L(+)-wijnsteenzuur is de overheersende natuurlijke vorm en commercieel geproduceerde variant. Het wordt aangetroffen als zuur of zout in verschillende planten, met name druiven, waar het zich ophoopt als kaliumbitartraat (tartaar) tijdens de wijnfermentatie. Dit onoplosbare neerslag is de primaire bron voor commerciële L(+)-wijnsteenzuurproductie.
Inhoudsopgave
1. Fysieke eigenschappen van wijnsteenzuur
De fysieke eigenschappen van het natuurlijke L(+)-wijnsteenzuur worden gegeven in Tabel 1 en zijn identiek aan die van D(-)-wijnsteenzuur.
Wijnsteenzuur is een geurloze vaste stof met een sterke zure smaak die stabiel is in de lucht.
Wijnsteenzuuroplossingen hebben een optische rotatie die varieert afhankelijk van de concentratie, zoals weergegeven door de volgende vergelijking:
[α] =15,050-0,1535 c
waarbij c de concentratie van wijnsteenzuur is in het bereik van 20–50% wt/vol.
Tabel 2 presenteert de oplosbaarheid bij verschillende temperaturen.
Bij verschillende temperaturen (°C) wordt de relatieve dichtheid van wijnsteenzuuroplossingen vermeld in Tabel 3.
| Eigenschap | Waarde |
|---|---|
| Moleculaire massa | 150,09 g/mol |
| Kristalvorm | Watervrije monokliene naalden (boven 5 °C) |
| Dichtheid | 1,7598 g/cm³ |
| Smeltpunt | 169–170 °C |
| Uiterlijk | Kleurloze kristallen |
| Ontleding | Boven 220 °C (geur van gekarameliseerde suiker) |
| Oplosbaarheid | |
| Water | Zeer oplosbaar |
| Alcohol (18 °C) | 20,4 g per 100 g |
| Di-ethylether (18 °C) | 0,3 g per 100 g |
| Optische rotatie bij 20% wt/vol | +11,98° (-11,98° voor D(-)-wijnsteenzuur) |
| Verbrandingsenthalpie | 1149,9 kJ/mol |
| Specifieke warmtecapaciteit (0-100 °C) | 1237 kJ kg⁻¹ K⁻¹ |
| Zuurdissociatieconstanten (25 °C) |
K₁ = 1,17 × 10⁻³ K₂ = 5,0 × 10⁻⁵ |
| Kookpunten van oplossingen |
25% oplossing: 102,2 °C 50% oplossing: 106,7 °C |
| Breukindex bij smeltpunt (170 °C) | 1,464 |
| Temperatuur (°C) | 0 | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Oplosbaarheid (g/100 g H2O) | 115 | 120 | 125 | 139 | 156 | 176 | 195 | 218 | 244 | 273 | 307 | 343 |
| Temperatuur (°C) | Dichtheid |
|---|---|
| 1 | 1,0045 |
| 10 | 1,0469 |
| 20 | 1,0969 |
| 30 | 1,1505 |
| 40 | 1,2078 |
| 50 | 1.2696 |
2. Chemische reacties van wijnsteenzuur
L(+)-wijnsteenzuur smelt tussen 170-180 °C en isomeriseert (herschikt zijn structuur) tot metawijnsteenzuur zonder waterverlies. Verdere verhitting levert amorfe anhydriden op. Deze anhydriden keren terug naar wijnsteenzuur bij koken met water.
Boven 220 °C ontleedt wijnsteenzuur, zwelt op en ontbrandt, waarbij een koolstofhoudend residu achterblijft.
Wijnsteenzuur is zeer gevoelig voor oxidatiemiddelen. Oxidatie van wijnsteenzuur door waterstofperoxide en ijzersulfaat (Fenton-reagens) produceert dioxobarnsteenzuur.
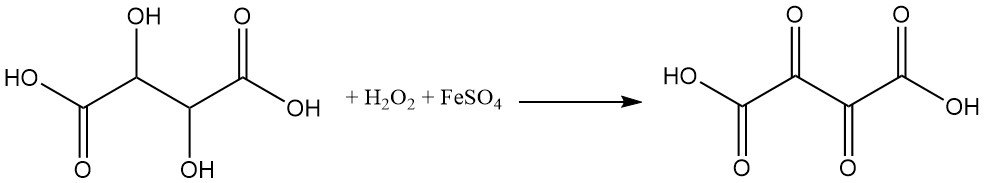
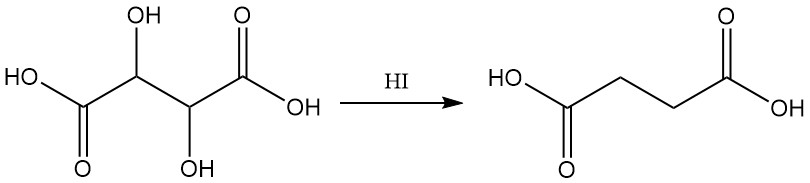
Reductie met waterstofjodide levert barnsteenzuur op.
Tartraten in oplossing reageren met ammonium-zilvernitraat om metallisch zilver te produceren.
Wijnsteenzuur wordt gebruikt als complexvormer om de neerslag van zware metaalzouten door basen te remmen.
Langdurig koken van L(+)-wijnsteenzuuroplossingen met alkaliën (KOH of NaOH) resulteert in de vorming van racemisch en meso-wijnsteenzuur.
3. Natuurlijke bronnen van wijnsteenzuur
L(+)-wijnsteenzuur is het enige isomeer dat op grote schaal commercieel wordt geproduceerd. Het exclusieve bronmateriaal komt van natuurlijke residuen die ontstaan tijdens het wijnmaken. Deze residuen bevatten voornamelijk wijnsteenzuur in de vorm van kaliumbitartraat (wijnsteenroom) en, in mindere mate, calciumtartraat.
Wijnsteenzuurbronnen zijn als volgt:
- Tartar is een roodachtig neerslag dat zich afzet op de wanden van wijnvaten naarmate de ethanol-concentratie toeneemt. Het bevat een hoge concentratie (80–90%) kaliumbitartraat.
- Lees: Deze sedimenten bezinken op de bodem van wijnvaten en bevatten een lagere concentratie (19–38%) kaliumbitartraat.
- Dried Lee: Dit is verwerkte lie met een hoger (55-70%) kaliumbitartraatgehalte.
- Distillery Byproduct: Distilleerderijen verkrijgen dit materiaal uit wijnmoer of druivendraf (de overgebleven vaste stoffen na het persen van druiven). Na het verwijderen van alcohol door distillatie, wordt de droesem of draf behandeld met calciumhydroxide om calciumtartraat te laten neerslaan.
4. Productie van wijnsteenzuur
Hoewel er meerdere wijnsteenzuurisomeren bestaan, is L(+)-wijnsteenzuur het enige isomeer dat op grote schaal commercieel wordt geproduceerd. Een zeer kleine hoeveelheid racemisch zuur wordt ook gesynthetiseerd voor specifieke toepassingen.
4.1. Productie van L(+)-wijnsteenzuur
De belangrijkste producenten van L(+)-wijnsteenzuur bevinden zich in Spanje, Frankrijk en Italië. Zo is Société Legré-Mante, opgericht in 1784, een van de oudste producenten.
Alle methoden voor de productie van L(+)-wijnsteenzuur zijn gebaseerd op de ontleding van calciumtartraat met zwavelzuur. Historisch gezien werden twee concurrerende methoden gebruikt om het uitgangsmateriaal (calciumtartraat) te verkrijgen: het Scheurer-Kestner-zuurproces en het Scheele-Lowitz-neutrale proces (inclusief de Desfosses-variant).
Momenteel is het meer economische neutrale proces de dominante methode.
Het gedroogde uitgangsmateriaal (wijnsteen of droesem) wordt eerst gemalen en vervolgens 2 uur lang geroosterd bij 160 °C in een rooster. Deze stap verwijdert organische onzuiverheden die de filtratie in latere stadia moeilijk zouden kunnen maken.
Het warm geroosterde product wordt overgebracht naar een reactor, waar het wordt verdund met water en geneutraliseerd met calciumhydroxide tot een pH van 5. De reactietemperatuur wordt gehandhaafd op 70 °C.
Om de reactie-efficiëntie te verbeteren en verliezen te minimaliseren, wordt een overmaat van 10% calciumchloride of calciumsulfaat toegevoegd in vergelijking met de vereiste stoichiometrische hoeveelheid. De volgende chemische reactie vindt plaats:
2 KHC4H4O6 + Ca(OH)2 + CaCl2 → 2 CaC4H4O6 + 2 KCl + 2 H2O
Het gevormde calciumtartraat wordt gescheiden van de resterende vloeistof (moederloog) door filtratie met behulp van een roterend filter en vervolgens gewassen. Als het uitgangsmateriaal afkomstig is van distilleerderijen, kan deze eerste fase worden omzeild.
In de tweede fase wordt het verkregen calciumtartraat ontleed in een waterige oplossing met behulp van zwavelzuur. Deze reactie levert wijnsteenzuuroplossing en onoplosbaar calciumsulfaat op:
CaC4H4O6 + H2SO4 → H2C4H4O6 + CaSO4
Een overmaat van ongeveer 5% zwavelzuur vergeleken met de hoeveelheid wijnsteenzuur wordt gebruikt om de reactie te optimaliseren. Het resulterende mengsel wordt gefilterd en gewassen om onzuiverheden te verwijderen.
De rode wijnsteenzuuroplossing, met een concentratie van ongeveer 200 g/l, wordt vervolgens geconcentreerd in vacuümverdampers bij 70 °C om een concentratie van 650 g/l te bereiken. Verdere concentratie onder vacuüm bij 70 °C vindt plaats totdat er kristallen beginnen te vormen (bij ongeveer 1300 g/l).
Dit vloeibaar-kristalmengsel wordt vervolgens overgebracht naar kristallisatoren voor langzame afkoeling, wat een maximale kristalopbrengst bevordert. Na afkoeling wordt het mengsel gedroogd in centrifuges om de kristallen van de moederloog te scheiden.
De moederloog, die nog steeds wijnsteenzuur bevat, ondergaat herhaalde cycli van verdamping, granulatie en droging om de opbrengst van gegranuleerd wijnsteenzuur te maximaliseren. De verkregen korrels worden gekoeld om een 650 g/L wijnsteenzuuroplossing te vormen.
Deze oplossing ondergaat verdere verwerking, waaronder ontkleuring met actieve kool en chemische zuivering om overtollig ijzer en zwavelzuur te verwijderen, allemaal uitgevoerd bij 70 °C. Het wordt vervolgens gefilterd en geconcentreerd onder vacuüm totdat de kristallisatie begint.
Het mengsel wordt vervolgens overgebracht naar kristallisatoren of gekoeld om de kristalopbrengst te maximaliseren. Het mengsel wordt vervolgens gescheiden door centrifugatie. De moederloog, die resterend wijnsteenzuur bevat, ondergaat verdere cycli van verdamping, granulatie en droging voordat het opnieuw wordt gebruikt.
De gezuiverde korrels worden gedroogd in een oven bij 140 °C en vervolgens gezeefd in verschillende korrelgroottes variërend van 2000 μm tot minder dan 100 μm (poeder).
Hoewel het hierboven beschreven proces de primaire methode is, zijn er andere productieprocessen onderzocht. Deze omvatten de op fermentatie gebaseerde productie van L(+)-wijnsteenzuur en de chemische synthese van racemisch DL-wijnsteenzuur.
4.2. Productie van L(+)-wijnsteenzuur door fermentatie
Hoewel de conventionele productiemethode van L(+)-wijnsteenzuur afhankelijk is van chemische reacties, wordt er voortdurend onderzoek gedaan naar alternatieven op basis van fermentatie.
Twee belangrijke bacteriestammen zijn voor dit doel onderzocht:
- Acetobacter suboxydans: Deze bacteriesoort is onderzocht op zijn vermogen om glucose om te zetten in L(+)-wijnsteenzuur.
- Nocardia tartaricans: Deze bacterie lijkt veelbelovend in het omzetten van cis-epoxysuccinezuur en zijn natriumderivaten in het gewenste product.
4.3. Chemische synthese van racemisch DL-wijnsteenzuur
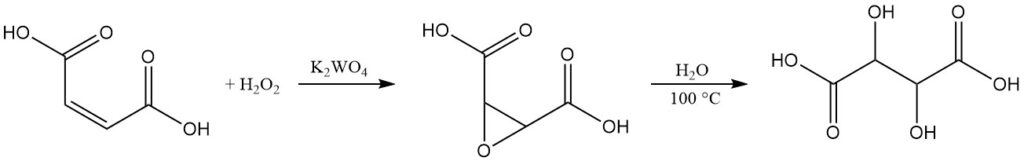
Terwijl L(+)-wijnsteenzuur de commerciële markt domineert, bestaat er een kleinschalig productieproces voor racemisch DL-wijnsteenzuur.
Deze methode begint met maleïnezuur of de zouten daarvan. In een waterige oplossing ondergaat maleïnezuur oxidatie met behulp van 35% waterstofperoxide in aanwezigheid van kaliumwolframaat als katalysator. Deze reactie levert epoxy-barnsteenzuur op, een tussenproduct.
Door het reactiemengsel te koken, hydrolyseert het epoxy-barnsteenzuur om racemisch wijnsteenzuur te vormen. Na afkoeling wordt het eindproduct geïsoleerd door middel van centrifugatie, wassen en drogen.
Verschillende variaties van dit proces zijn onderzocht en gedocumenteerd in wetenschappelijke publicaties. Deze onderzoeksactiviteit wordt verder weerspiegeld in talrijke patentaanvragen die voor deze methode zijn ingediend.
Momenteel blijft de commerciële productie van racemisch DL-wijnsteenzuur beperkt, met slechts één kleine productie-eenheid die in Zuid-Afrika actief is.
5. Derivaten van L(+)-wijnsteenzuur
Wijnsteenzuur vormt gemakkelijk talrijke zouten en esters, waarvan sommige een belangrijke commerciële toepassing vinden. In deze sectie worden de bekendste verbindingen besproken.
5.1. Natriumkaliumtartraat
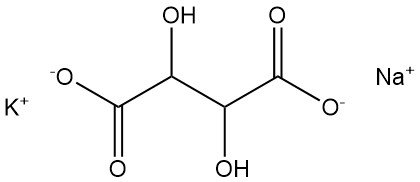
Natriumkaliumtartraat, ook bekend als Seignette’s zout of Rochelle-zout, werd in 1672 ontdekt door Pierre Seignette.
Fysische eigenschappen:
- Formule: KNaC4H4O6 · 4 H2O
- CAS-nummer: [6381-59-5]
- Molaire massa: 282,23 g/mol
- Dichtheid: 1,79 g/cm³
- Smeltpunt: 70–80 °C (ontleedt bij 220 °C)
- Oplosbaarheid: 26 g/100 ml water bij 0 °C, 66 g/100 ml water bij 26 °C
Het uitgangsmateriaal voor de productie van natriumkaliumtartraat is wijnsteen met een wijnsteenzuurgehalte van minimaal 68%.
Deze oplossing wordt verdund met water, geneutraliseerd met hete natriumhydroxide, ontkleurd met actieve kool en vervolgens gefilterd. Het filtraat wordt geconcentreerd door verdamping en vervolgens gekristalliseerd door afkoeling om het vaste zout te produceren, dat wordt gescheiden, gewassen, gedroogd en gezeefd voordat het wordt verpakt.
Commerciële korrelgroottes variëren van 2000 μm tot < 250 μm (poeder).
5.2. Kaliumbitartraat
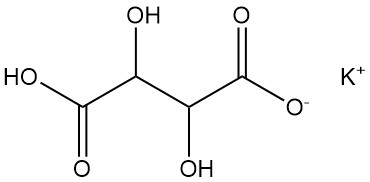
Kaliumbitartraat is algemeen bekend als wijnsteen.
Fysische eigenschappen:
- Formule: KHC4H4O6
- CAS-nummer: [868-14-4]
- Dichtheid: 1,96 g/cm³
- Oplosbaarheid: 0,57 g/100 ml water bij 20 °C, 6,1 g/100 ml water bij 100 °C
Het wordt voornamelijk verkregen uit de moederloog die overblijft na de productie van Rochelle-zout. Kaliumbitartraat wordt ontkleurd, gezuiverd, gefilterd, aangezuurd met zoutzuur of zwavelzuur, neergeslagen, gecentrifugeerd, gedroogd, gemalen en verpakt als een fijn poeder.
5.3. Kaliumantimonyltartraat
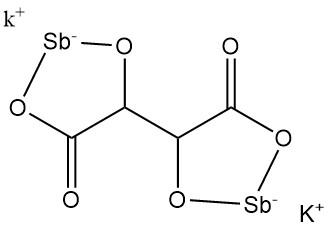
Kaliumantimonyltartraat (wijnsteenbraakmiddel) werd in 1631 ontdekt door Adrien de Mynsicht.
Fysische eigenschappen:
- Formule: KSbC4H2O6 · 1,5 H2O
- CAS-nummer: [28300-74-5]
- Molaire massa: 333,93 g/mol
- Dichtheid: 2,61 g/cm³
- Oplosbaarheid: 8,7 g/100 ml water bij 25 °C, 35,7 g/100 ml water bij 100 °C
Kaliumantimonyltartraat wordt geproduceerd door de reactie van antimoonoxide met de room van wijnsteen in water, gevolgd door de concentratie van de resterende oplossing en kristallisatie. Na filtratie worden de kristallen gedroogd en verpulverd.
5.4. Metawijnsteenzuur
Metawijnsteenzuur wordt geproduceerd door wijnsteenzuur te verhitten tot 170-180 °C. Deze omzetting omvat interne verestering binnen de wijnsteenzuurmoleculen, wat leidt tot een min of meer gepolymeriseerd product. Metawijnsteenzuur heeft uitzonderlijke remmende eigenschappen tegen de neerslag van wijnsteenzuurzouten.
6. Toepassingen van wijnsteenzuur
L(+)-wijnsteenzuur en zijn derivaten worden gebruikt in verschillende industrieën, waaronder voedingsmiddelen, farmaceutica, wijnbouw en andere.
L(+)-wijnsteenzuur (E 334) wordt gebruikt:
- als een zuurmiddel in wijnmost, snoep, gelei, jam, vruchtennectar, ijs, gelatine en pasta’s, waardoor hun smaakprofielen worden verbeterd.
- om fruit, groenten of vis te conserveren als een synergetische antioxidant, die de pH, kleur, smaak en voedingswaarde stabiliseert.
- Als antioxidant in vetten en oliën.
- Bij de bereiding van koolzuurhoudende dranken.
- Als hulpstof of drager voor actieve farmaceutische ingrediënten, ter ondersteuning van het corrigeren van de basiciteit.
- Als zuurmiddel voor schuimtabletten en poeders vanwege de stabiliteit en hoge oplosbaarheid
- Als vertrager in de cementindustrie, met name bij gips en pleister.
- Bij het polijsten en reinigen van metalen.
Winkelwijnsteen (E 336) wordt gebruikt om de neerslag van wijnsteenzuurzouten in wijn te versnellen, bij de productie van chemische gisten en als laxeermiddel in sommige medicijnformuleringen.
Seignette’s zout (E 337) wordt gebruikt in galvanisatieprocessen om de afzetting en opbrengst te verbeteren, in elektronica en piëzo-elektriciteit, als reductiemiddel bij het verzilveren van spiegels en als bestanddeel van Fehling’s oplossing. Het wordt ook gebruikt als verbrandingsregelaar bij de productie van sigarettenpapier, als laxeermiddel in sommige farmaceutische producten en als bijtmiddel in de textiel- en leerindustrie.
In kleine hoeveelheden wordt kaliumantimonyltartraat gebruikt als slijmoplossend middel in hoestsiropen en helpt het bij de behandeling van sommige tropische ziekten.
Metawijnsteenzuur wordt gebruikt om de kristallisatie van wijnsteen in tafelwijnen te remmen.
Tartraten van vetzuurmonoglyceriden en diglyceriden worden gebruikt als emulgatoren in de bakkerij-industrie.
7. Toxicologie van wijnsteenzuur
In tegenstelling tot citroenzuur is wijnsteenzuur niet direct betrokken bij de Krebs-cyclus (energieproductiepad) in het menselijk lichaam.
L(+)-wijnsteenzuur, de natuurlijke vorm, wordt aangetroffen in fruit en wijn. Na orale inname wordt ongeveer 20% via de urine uitgescheiden, terwijl een aanzienlijk deel door bacteriën wordt afgebroken door de darmflora. Er zijn geen sporen te vinden in de ontlasting.
Opgenomen wijnsteenzuur wordt snel uit de bloedbaan verwijderd en ofwel door de nieren uitgescheiden of in verschillende weefsels gemetaboliseerd.
Langetermijnstudies bij ratten met L(+)-natriumtartraat hebben geen tekenen van toxiciteit of carcinogeniciteit aan het licht gebracht. Bovendien werden er geen negatieve effecten op de nierfunctie of pathologie waargenomen bij een dagelijkse dosis van 3 g/kg lichaamsgewicht.
Racemisch (DL)-wijnsteenzuur is minder uitgebreid bestudeerd en onderzoek suggereert dat het zich anders gedraagt dan de natuurlijke L(+)-isomeer.
DL-wijnsteenzuur wordt langzamer uit de bloedbaan verwijderd en hoopt zich gedurende een langere periode op in de nieren, wat mogelijk gewichtstoename in deze organen veroorzaakt. Vanwege dit nefrotoxische effect is de DL-vorm niet goedgekeurd voor gebruik in voedsel of farmaceutica.
Referenties
- Tartaric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a26_163
- Tartaric Acid; Van Nostrand’s Encyclopedia of Chemistry. – https://onlinelibrary.wiley.com/doi/full/10.1002/0471740039.vec2453
- Organic Acids in Fruits. https://onlinelibrary.wiley.com/doi/abs/10.1002/9781119431077.ch8
- Tartaric acid. https://www.sciencedirect.com/science/article/abs/pii/B9780128190968000197
