Productiemethoden van hydrazine
De meeste potentiële routes om hydrazine te verkrijgen zijn beperkt vanwege de beschikbaarheid van grondstoffen en productiekosten. Stikstof en ammoniak springen eruit als de enige haalbare startmaterialen voor een eenvoudiger proces.
Een evaluatie van de standaard vrije energievariatie ΔF°(g) (298 K) binnen het gassysteem H2-N2-NH3-N2H4 geeft aan dat de directe synthese van hydrazine uit stikstof en waterstof energetisch ongunstig is. De vormingsvrije energie is sterk in het voordeel van de productie van ammoniak.
Ondanks voortdurende inspanningen is er momenteel geen praktische of kosteneffectieve oplossing voor het selectief reduceren van stikstof. Daarom blijft ammoniak de enige waardevolle stikstofbron voor hydrazineproductie.
Op papier lijkt de koppeling van twee ammoniakmoleculen met gelijktijdige waterstofproductie een aantrekkelijk proces. Het is echter zowel endotherm als zeer inefficiënt.
Verschillende methoden zoals elektrische ontlading, fotolyse of radiolyse die worden gebruikt om ammoniak te ontleden, leveren bijvoorbeeld slechts lage hoeveelheden hydrazine op. Een alternatieve aanpak is het oxideren van de waterstofatomen die uit ammoniak zijn gescheiden.
In een industriële omgeving zijn slechts drie oxidanten van belang: chloor, zuurstof en waterstofperoxide.
Een extra uitdaging is dat hydrazine, een veel sterker reductiemiddel dan ammoniak, ook kan reageren met het oxidatiemiddel.
Chloor is uitgebreid gebruikt in het Raschig-proces, dat nog steeds in werking is. Om verdere oxidatie van hydrazine door chloor te voorkomen, moeten sterk verdunde omstandigheden worden gebruikt, wat resulteert in opbrengsten die niet hoger zijn dan 60%.
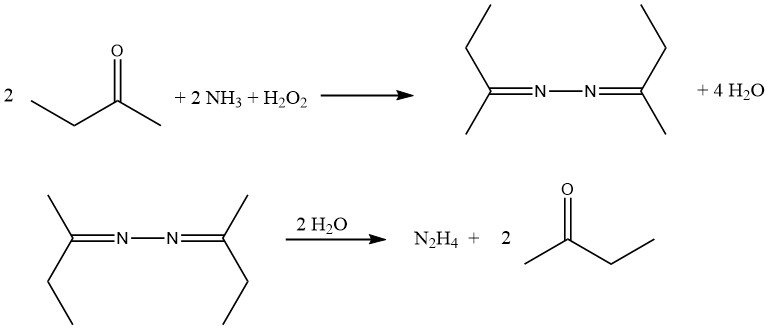
De hydrolyse van azines afgeleid van aceton en butanon onder druk biedt een manier om hydrazine te produceren terwijl het keton wordt geregenereerd.
Bayer heeft de opbrengsten aanzienlijk verbeterd door aceton in het Raschig-proces te introduceren.
In de jaren 70 ontwikkelde PCUK (nu Atochem) een nieuw, efficiënt en milieuvriendelijk proces gebaseerd op de oxidatie van ammoniak door waterstofperoxide in aanwezigheid van een keton. Momenteel wordt de meeste hydrazine geproduceerd via het ketazine-proces, waarbij de oxidatie van ammoniak door chloor of waterstofperoxide plaatsvindt.
Inhoudsopgave
1. Raschig-proces
In het Raschig-proces wordt de oxidatie van ammoniak bereikt met behulp van natriumhypochloriet, dat wordt verkregen door chloor te laten reageren met natriumhydroxide.
De oxidatie vindt plaats in twee stappen. In de eerste stap, uitgevoerd bij ongeveer 5 °C, vormt een snelle reactie chloramine:
Vervolgens wordt het reactiemengsel gecombineerd met een aanzienlijke overmaat ammoniak (met een verhouding van 40:1) en vindt de langzame reactie plaats die leidt tot hydrazine bij temperaturen tussen 130 en 150 °C, onder een druk van 3,0 MPa:
Er kunnen verschillende opvallende bijwerkingen optreden, waaronder:
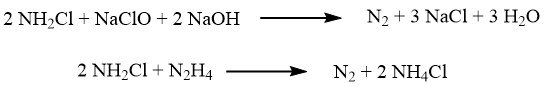
Bij het verlaten van de reactor bevat de reactieoplossing ongeveer 1% hydrazinehydraat en ongeveer 4% natriumchloride. De druk wordt vervolgens verlaagd tot atmosferische niveaus met behulp van een reeks verdampers.
Ammoniak wordt gecondenseerd, geconcentreerd en gerecycled. De oplossing die op de bodem van de stripkolommen wordt verzameld, ondergaat zoutverwijdering in een conventionele geforceerde circulatiezoutverdamper. Het resulterende destillaat wordt verder geconcentreerd om 100% hydrazinehydraat te verkrijgen.
Om redelijke opbrengsten in dit proces te behalen, is het belangrijk om verdunde oplossingen te gebruiken en een hoge verhouding van ammoniak tot hypochloriet te handhaven. De kosten die gepaard gaan met verdamping blijven echter hoog, zelfs met potentiële stoombesparingen.
a) Chlooraminereactor; b), c) Hydrazinereactoren; d) Ammoniakverdamper; e) Hydrazine-natriumchloridescheider; f) Hydrazinehydraatconcentrator
2. Olin Raschig-proces
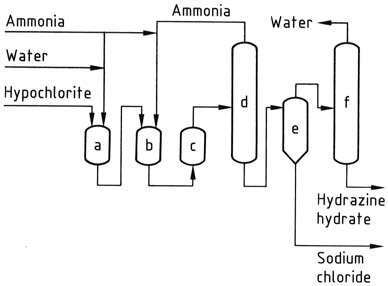
In het Olin Raschig-proces, voor de productie van watervrije hydrazine in ruimtevaarttoepassingen, wordt nauwkeurige controle uitgeoefend over de generatie van natriumhypochloriet. Een lage temperatuur wordt gebruikt om ontleding en de vorming van chloraat te voorkomen, terwijl een minimale overmaat aan natriumhydroxide wordt gehandhaafd.
De natriumhypochlorietoplossing wordt gecombineerd met drie keer de hoeveelheid ammoniak bij 5 °C om chloramine te creëren. Deze chloramine wordt vervolgens snel toegevoegd aan een 30-voudige overmaat aan watervrije ammoniak onder druk (20-30 MPa) en verhit tot 130 °C.
Het resulterende reactiemengsel, dat 1-2% hydrazinehydraat bevat, ondergaat een behandeling die vergelijkbaar is met het conventionele Raschig-proces om hydrazinehydraat te verkrijgen. Watervrije hydrazine wordt verkregen door water te elimineren door azeotropische destillatie met aniline in een kolom die werkt bij atmosferische druk.
Condensatie van de damp produceert een distillaat met twee lagen, waarbij de waterige fase wordt verwijderd en de anilinefase terugvloeit naar de bovenkant van de kolom. Watervrij hydrazine wordt gewonnen als een mengsel met aniline, dat vervolgens kan worden gescheiden door distillatie.
a) Chlooraminereactor; b), c) Hydrazinereactoren; d) Ammoniakverdamper; e) Hydrazine-natriumchloridescheider; f) Hydrazinehydraatconcentratie; g) Hydrazinehydraatopslag; h) Hydrazinehydraatdehydratie; i) Aniline-waterdecantatie; j) Watervrije hydrazinedestillatie; k) Anilineopslag
3. Ureumproces
Ureum kan dienen als alternatieve ammoniakbron in het Raschig-proces. Hoewel het momenteel niet wordt gebruikt voor de commerciële productie van hydrazinehydraat, is deze aanpak op commerciële schaal gebruikt.
Aanvankelijk bleek het de meest kosteneffectieve methode voor kleinere productievolumes. Naarmate de fabrieken echter groter werden, werd het traditionele Raschig-proces gunstiger, waardoor de op ureum gebaseerde methode overbodig werd.
Sinds 1990 worden er in Azië aanzienlijke hoeveelheden hydrazodicarbonamide geproduceerd met behulp van het ruwe reactiemengsel van ureum en natriumhypochloriet als hydrazinebron.
Dit specifieke proces omvat echter de substantiële generatie van bijproducten en vereist dure behandeling van afvalwater. Als gevolg hiervan is het waarschijnlijk dat het na verloop van tijd verouderd raakt.
4. Bayer Ketazine-proces
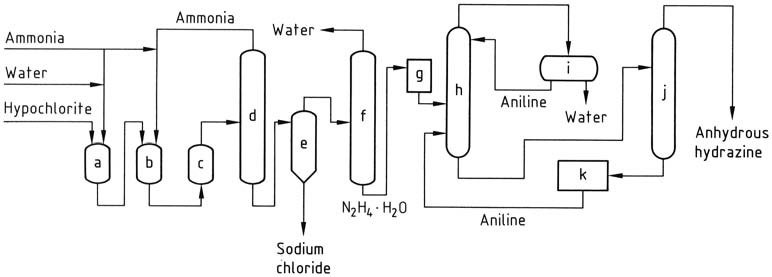
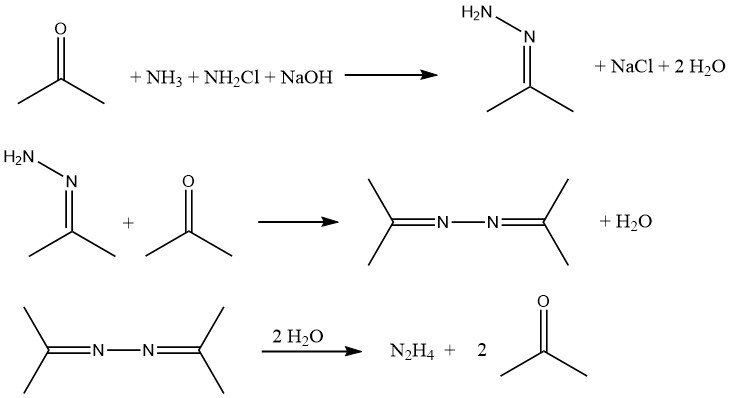
Het Bayer-proces is een aangepaste versie van het Raschig-proces waarbij chlooramine reageert met ammoniak in aanwezigheid van aceton bij een pH-bereik van 12-14:
Gelijktijdig en continu worden natriumhypochloriet, aceton en een 20% waterige oplossing van ammoniak (in een molaire verhouding van respectievelijk 1:2:20) in een reactor gebracht bij ongeveer 35 °C en 200 kPa.
Overtollige ammoniak wordt uit het reactiemengsel verwijderd door strippen, vervolgens geblust met water en teruggevoerd naar de reactor als een waterige oplossing.
De resulterende waterige oplossing die dimethylketazine bevat, met restaceton, natriumchloride en organische onzuiverheden, wordt in een destillatiekolom gevoerd. In deze kolom wordt de dimethylketazine gewonnen als een waterige azeotroop (bestaande uit 55% dimethylketazine) bij atmosferische druk (kookpunt van 95 °C bij 101,3 kPa).
De introductie van aceton in de destillatiekolom is bedoeld om voortijdige hydrolyse van de ketazine te voorkomen. Het bijproduct dat uit de distilleerderij wordt verkregen, is een oplossing van natriumchloride die sporen van hydrazine en organische verbindingen bevat. Deze oplossing moet worden behandeld voordat deze kan worden afgevoerd of gerecycled voor elektrolyse.
Vervolgens ondergaat de dimethylketazine hydrolyse in een onder druk staande destillatiekolom (die werkt bij 0,8-1,2 MPa), wat aceton oplevert, dat wordt gerecycled naar de reactor, en een 10% waterige oplossing van hydrazine. De hydrazine-oplossing wordt vervolgens geconcentreerd tot een hydrazinegehalte van 64%.
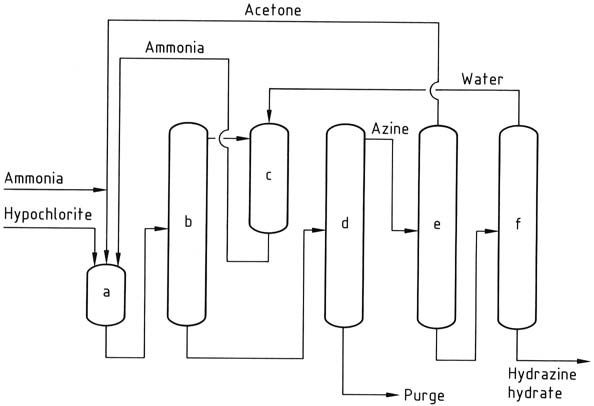
a) Azinereactor; b) Ammoniakstrippen; c) Ammoniakblussing; d) Azinedestillatie; e) Azinehydrolyse; f) Hydrazinehydraatconcentratie
5. Fisons-proces
Het proces, oorspronkelijk geïmplementeerd door Whiffen and Sons, werd verder ontwikkeld door Fisons en werd operationeel in de jaren 60. In dit proces werd methylethylketon gebruikt in plaats van aceton om de hydrazine op te vangen, en de hydrolysestap omvatte het gebruik van zwavelzuur.
Dit specifieke proces is echter niet langer in gebruik.
6. Peroxideproces
Het meest recente hydrazineproces, ontwikkeld door PCUK en momenteel gebruikt door ATOFINA in Frankrijk en Mitsubishi Gas in Japan, gebruikt waterstofperoxide als oxidatiemiddel. De reactie vindt plaats bij atmosferische druk en 50 °C in aanwezigheid van methylethylketon (MEK), met een verhouding van H2O2:MEK:NH3 van 1:2:4.
Om de waterstofperoxide te activeren, worden acetamide en dinatriumwaterstoffosfaat gebruikt door ATOFINA, terwijl Mitsubishi Gas een arseenverbinding gebruikt. De algehele reactie leidt tot de vorming van methylethylketazine met een hoge opbrengst.
Het reactiemechanisme omvat de activering van zowel ammoniak als waterstofperoxide, aangezien deze twee reactanten niet van nature met elkaar reageren, in tegenstelling tot ammoniak en hypochloriet in het Bayer-proces. De reactie verloopt via de vorming van een oxaziridine-intermediair, dat ammoniak kan oxideren tot een hydrazinederivaat.
Vanwege de onoplosbaarheid van methylethylketazine in het reactiemengsel kan het eenvoudig worden gescheiden door decanteren. De gescheiden ketazine wordt vervolgens gezuiverd via destillatie. Onder druk (0,8-10 MPa) wordt de gezuiverde ketazine gehydrolyseerd, wat resulteert in geconcentreerde waterige hydrazine en overheadmethylethylketon, dat wordt gerecycled.
De waterige laag die de activator bevat, wordt geconcentreerd om water te verwijderen en vervolgens terug naar de reactoren gerecycled na het elimineren van in water oplosbare onzuiverheden door een purge. Het peroxideproces biedt verschillende voordelen ten opzichte van andere methoden, waaronder de afwezigheid van zoutbijproducten, hoge opbrengsten, laag energieverbruik, minimale molaire overmaat en geen vereiste voor behandeling van waterig afvalwater.
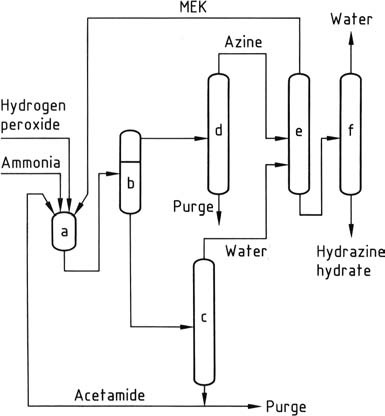
a) Azinereactor; b) Faseseparator; c) Concentratie van de waterige fase; d) Zuivering van azine; e) Hydrolyse van azine; f) Concentratie van hydrazinehydraat
Referentie
- Hydrazine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_177
