Malonzuur: eigenschappen, reacties, productie en toepassingen
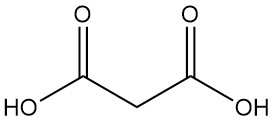
Wat is malonzuur?
Malonzuur, ook bekend als propaandizuur of methaandicarbonzuur, is een dicarbonzuur met de chemische formule C3H4O4. Het is een kleurloze, hygroscopische vaste stof die sublimeert in een vacuüm. De geïoniseerde vorm van malonzuur, evenals de esters en zouten ervan, staan bekend als malonaten.
Inhoudsopgave
1. Fysieke eigenschappen van malonzuur
Malonzuur is een witte, hygroscopische vaste stof die zeer oplosbaar is in water (139 g in 100 g water bij 22 °C) en oplosbaar in pyridine (15 g in 100 g pyridine bij 15 °C). Het is licht oplosbaar in ethanol en di-ethylether en onoplosbaar in benzeen.
De fysieke eigenschappen van malonzuur staan vermeld in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-registratienummer | [141-82-2] |
| Moleculaire formule | C3H4O4 |
| Moleculair gewicht | 104,06 g/mol |
| Smeltpunt | 134 – 138 °C |
| Kookpunt punt | Ontleedt bij 140 °C |
| Dichtheid | 1,62 g/cm³ |
| pKa1 | 2,83 |
| pKa2 | 5,70 |
| Vlampunt | 157 °C |
2. Reacties van malonzuur
Malonzuur wordt in kleine hoeveelheden aangetroffen in suikerbieten en groene tarwe en wordt gevormd door oxidatieve afbraak van appelzuur.
Malonzuur vertoont reacties die typisch zijn voor carbonzuren en een hoge reactiviteit van de centrale methyleengroep vanwege de zuurgraad van de waterstofatomen op de 2-positie.
Malonzuur reageert zoals de meeste carbonzuren om amiden, esters, anhydriden en zuurchloriden te produceren.
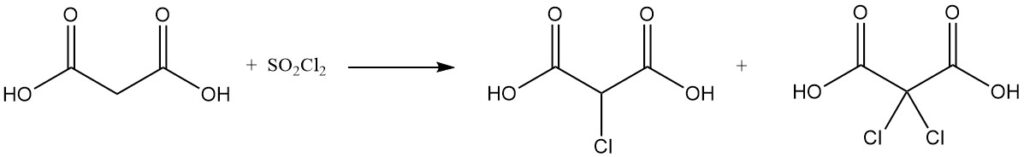
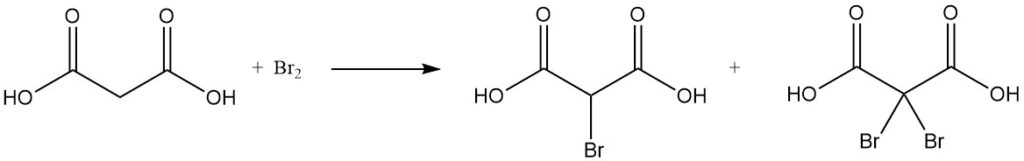
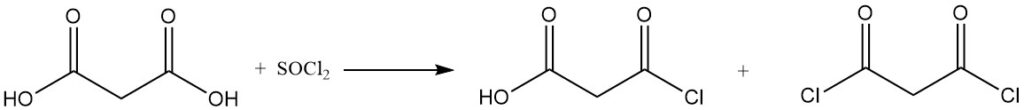
De reactie van malonzuur met sulfurylchloride of broom levert mono- of dihalogeneerde derivaten op, terwijl thionylchloride of fosforpentachloride mono- of diacylchloriden vormt.
Malonzuur reageert met ureum om barbituurzuur te produceren, een voorloper van verschillende medicijnen, en met aceton om Meldrumzuur te vormen, een belangrijk tussenproduct in de organische synthese.
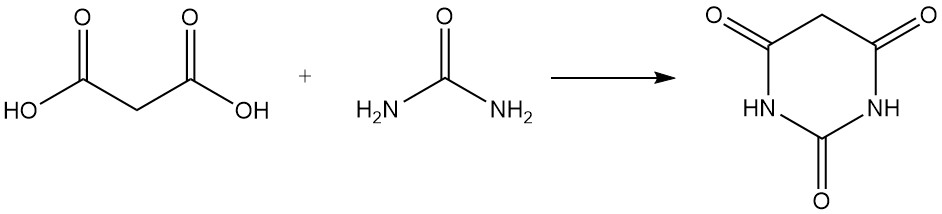
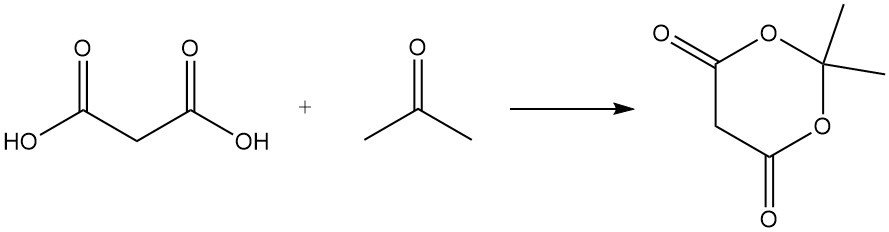
In tegenstelling tot gewone carbonzuren ontstaat er bij verhitting van malonzuur met fosforpentoxide geen anhydride, maar koolstofsuboxide, een giftig gas dat bij contact met water snel weer malonzuur vormt.
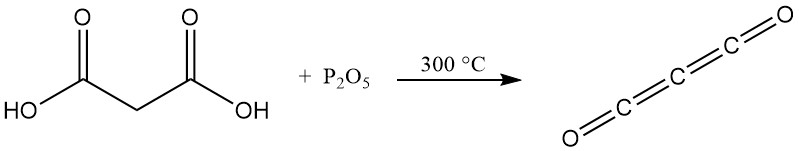
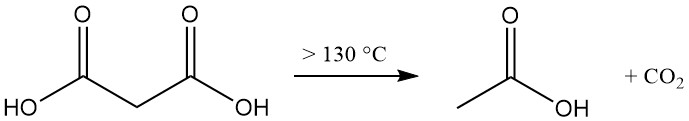
Thermische ontleding van malonzuur boven 130 °C (vrij zuur) of 70 °C (waterige oplossing) produceert azijnzuur en koolstofdioxide.
De mono- en dianionen van malonzuur zijn stabieler vergeleken met het vrije zuur. In waterige oplossingen ontleedt mononatriummalonaat boven 90 °C, terwijl dinatriummalonaat boven 130 °C ontleedt.
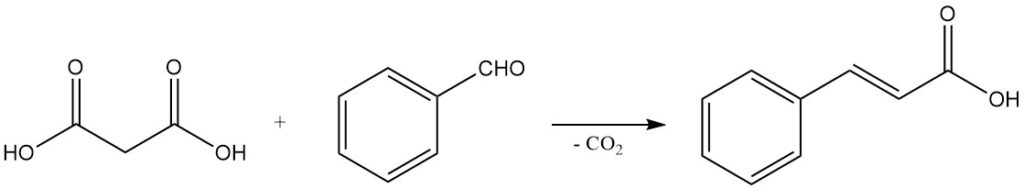
Het milde decarboxylatiegedrag, gekoppeld aan het vermogen om Knoevenagel-condensaties te ondergaan, maakt malonzuur een belangrijk reagens voor de synthese van α,β-onverzadigde carbonzuren. Bijvoorbeeld, reactie met benzaldehyde levert kaneelzuur op, en reacties met alifatische aldehyden produceren acrylzuren.
Onderzoek heeft ook platinacomplexen van malonzuur en zijn derivaten onderzocht als potentiële antitumormiddelen.
3. Industriële productie van malonzuur
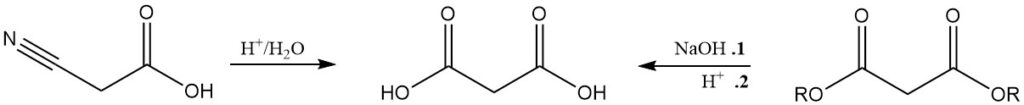
Hoewel minder belangrijk dan malonaatproductie, wordt malonzuur gewoonlijk geproduceerd door de hydrolyse van cyanoazijnzuur of door de zure verzeping van malonaten.
Er zijn ook opkomende methoden gerapporteerd voor de productie van malonzuur, waaronder ozonolyse van cyclopentadieen, palladium-gekatalyseerde luchtoxidatie van 1,3-propaandiol, metaal-gekatalyseerde oxidatie van 3-hydroxypropionaldehyde of 3-hydroxypropionzuur en biokatalytische omzetting van malonnitril met behulp van een nitrilase-enzym.
De eerste laboratoriumsynthese van malonzuur, bereikt in 1858, omvatte de oxidatieve ontleding van appelzuur met behulp van kaliumdichromaat. Deze methode wordt tegenwoordig niet algemeen gebruikt.
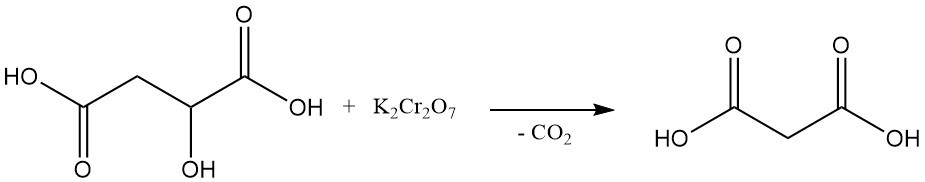
4. Toepassingen van malonzuur
Malonzuur wordt gebruikt als bouwsteen voor verschillende organische verbindingen vanwege het vermogen om een azijnzuurgroep te introduceren onder milde omstandigheden via Knoevenagel-condensatie gevolgd door decarboxylatie. Voorbeelden van verbindingen die gesynthetiseerd worden uit malonzuur zijn:
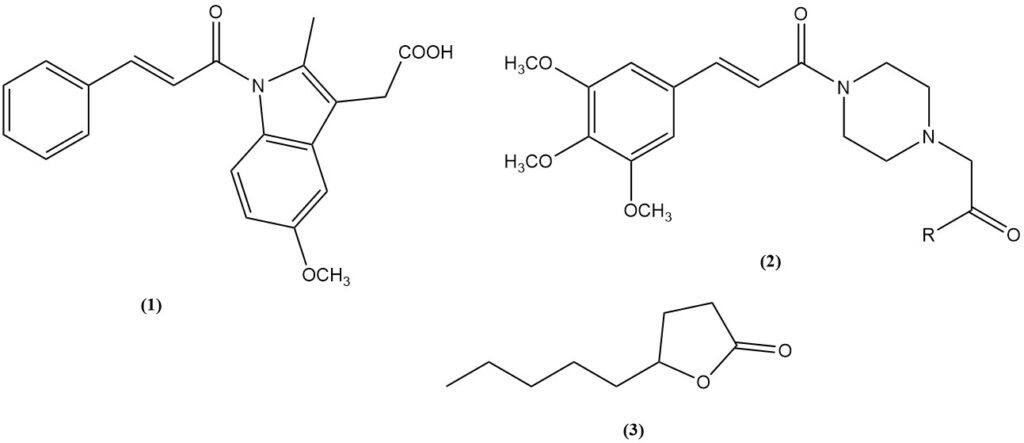
- Kaneelzuur is een voorloper van het ontstekingsremmende medicijn cinmetacine (1).
- 3,4,5-trimethoxykaneelzuur: een tussenproduct voor de vaatverwijders cinepazet (2, R = OEt) en cinepazide (2, R = 1-pyrrolidinyl).
- γ-Nonanoic lactone (3): een geurige verbinding verkregen door Knoevenagel-condensatie van malonzuur met heptaldehyde gevolgd door cyclisatie.
Malonzuur wordt ook gebruikt bij de productie van technische kunststoffen met gewenste eigenschappen, biologisch afbreekbare containers, barbituraten en coatings.
5. Toxicologie van malonzuur
Malonzuur wordt beschouwd als matig toxisch, voornamelijk voor de ogen en de huid. Dit zijn de beschikbare toxicologische gegevens:
Acute orale toxiciteit: LD50 (oraal, rat): 2750 mg/kg
Malonzuur kan de huid irriteren (lichte huidirritatie bij konijnen) en ernstige oogschade veroorzaken bij contact. Veiligheidsinformatiebladen (SDS) raden aan om geschikte persoonlijke beschermingsmiddelen (PBM) te dragen om contact te voorkomen.
Er zijn geen direct beschikbare gegevens over chronische gezondheidseffecten bij mensen.
Inademing van malonzuurstof kan ook schadelijk zijn, hoewel specifieke gegevens mogelijk beperkt zijn.
De specifieke effecten van blootstelling aan malonzuur kunnen variëren, afhankelijk van factoren zoals de hoeveelheid, duur van blootstelling en de route van binnendringing (inademing, inname, huidcontact).
Zoals bij elke chemische stof is het cruciaal om malonzuur te hanteren volgens de aanbevolen veiligheidsprotocollen die zijn uiteengezet in Veiligheidsinformatiebladen (SDS).
Referenties
- Malonic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a16_063.pub2
- Malonic acid. – https://www.acs.org/molecule-of-the-week/archive/m/malonic-acid.html
- The Knoevenagel Reaction. – https://www.sciencedirect.com/science/article/abs/pii/B9780080523491000330
- https://beta-static.fishersci.com/content/dam/fishersci/en_US/documents/programs/education/regulatory-documents/sds/chemicals/chemicals-m/S25416.pdf
