Glycolzuur: eigenschappen, productie, reacties en toepassingen

Wat is glycolzuur?
Vaste glycolzuur is het eenvoudigste α-hydroxycarbonzuur met de formule C2H4O3. Het vormt kleurloze, monokliene, prismatische kristallen. Dit zuur is zeer oplosbaar in verschillende oplosmiddelen, waaronder water, methanol, ethanol, aceton en ethylacetaat.
De vluchtigheid van glycolzuur is beperkt, met minimale neiging om te verdampen bij blootstelling aan hitte. Bijgevolg kan het niet effectief worden gedistilleerd onder vacuümomstandigheden.
Pogingen om het te distilleren resulteren vaak in zelfverestering, gepaard gaand met waterverlies, wat leidt tot de vorming van di- en polyglycoliden.
Inhoudsopgave
Fysische eigenschappen van glycolzuur
In zuivere vorm is glycolzuur kristalliseerbaar en kan het niet worden gedestilleerd zonder ontleding, zelfs niet onder vacuüm.
De fysieke eigenschappen zijn als volgt:
- Molaire massa = 76 g/mol
- smeltpunt = 78-80 °C
- kookpunt = 100 °C (ontleden)
- Dichtheid bij 25 °C = 1,49
- Breukindex (20 °C) = 1,423
- pKa = 3,81 bij 25 °C
Chemische reacties van glycolzuur
Glycolzuur vertoont het vermogen om dimerisatie te ondergaan door water te elimineren, wat resulteert in de vorming van cyclische diester die bekend staat als 1,4-dioxaan-2,5-dion. Deze diesters worden gewoonlijk lactiden genoemd vanwege hun eerste ontdekking tijdens studies met melkzuur.

Polymerisatie van glycolzuur door polycondensatie geeft Polyglycolide of poly(glycolzuur), wat een biologisch afbreekbaar en thermoplastisch polymeer is. Dit type verestering, bekend als estolidevorming, is niet beperkt tot α-hydroxycarbonzuren.

Een ander belangrijk kenmerk van glycolzuur is dat de nabijheid van de twee functionele groepen de tussenliggende C-C-binding(en) verzwakt. Bijgevolg leidt de behandeling van dergelijke verbindingen met zwavelzuur tot de eliminatie van mierenzuur. Bij blootstelling aan geconcentreerd zwavelzuur ontleedt mierenzuur, waarbij koolmonoxide en water ontstaan.
Deze eliminatiereactie vindt plaats met een hoge efficiëntie, waardoor het een waardevol hulpmiddel is voor de kwantitatieve bepaling van glycolzuur.
Oxidatieve splitsing is ook mogelijk voor glycolzuur. Wanneer glycolzuur bijvoorbeeld wordt behandeld met waterstofperoxide in aanwezigheid van ijzer(II)-ionen, ondergaat het gemakkelijk de eliminatie van kooldioxide.
Glycolzuur kan in de dampfase katalytisch worden gedehydrogeneerd tot glyoxylzuur.
Wanneer glycolzuur reageert met PCl3, vormt het chlooracetylchloride (ClCH2COCl).
Productie van glycolzuur
Glycolzuur wordt gewoonlijk gesynthetiseerd door de hydrolyse van gesmolten monochloorazijnzuur met behulp van een 50% waterige oplossing van natriumhydroxide bij temperaturen variërend van 90 tot 130 °C.
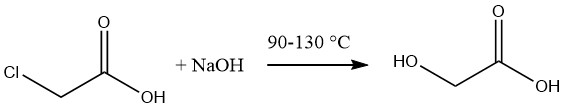
De resulterende oplossing van glycolzuur heeft een concentratie van ongeveer 60%, vergezeld van een natriumchloridegehalte van 12-14%. De eliminatie van het zout kan worden bereikt door verdamping gevolgd door extractie van het zuur met behulp van aceton.
Alternatieve benaderingen zijn onderzocht waarbij de hydrolyse wordt uitgevoerd met zure katalysatoren bij hogere temperaturen van 150-200 °C, waarbij water of stoom onder druk wordt gebruikt.
Bij dit proces wordt waterstofchloride gevormd als bijproduct in plaats van natriumchloride, dat kan worden gescheiden door destillatie. Deze methode vereist echter het gebruik van aanzienlijke hoeveelheden water, wat een aanzienlijk nadeel vormt.
In de Verenigde Staten omvat de commerciële productie van glycolzuur (door Du Pont) de behandeling van formaldehyde of trioxymethyleen met koolmonoxide en water in aanwezigheid van zure katalysatoren onder drukken van meer dan 30 MPa.

Een andere methode, eerder gebruikt door Degussa, omvat de elektrolytische reductie van oxaalzuur.
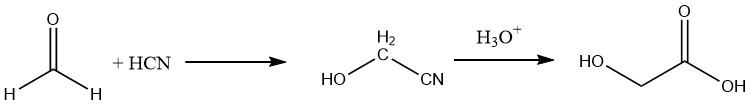
Verder kan glycolzuur worden bereid met een opbrengst van ongeveer 90% door het overeenkomstige nitril te hydrolyseren, dat wordt verkregen door formaldehyde te laten reageren met blauwzuur.
Een recent onderzoek toont aan dat glycolzuur kan worden geproduceerd door een selectief oxidatieproces van ethyleenglycol met behulp van een zeer efficiënte bimetalen PtMn/MCM-41 nanokatalysator.
Toepassingen van glycolzuur
Glycolzuur is commercieel verkrijgbaar in de vorm van waterige oplossingen, met concentraties van 57% (Hoechst) of 70% (Du Pont). De wereldwijde jaarlijkse consumptie van deze oplossingen is ongeveer 2000-3000 ton.
In verschillende industrieën vindt glycolzuur toepassing in textielverven, bedrukken en kreukvrij maken. Het vermogen om chelaten te vormen met calcium(II)-ionen maakt het bijzonder geschikt voor het maskeren van ontkalking in de leerindustrie. Het wordt ook gebruikt in aluin– en chroombeitsen, evenals in bontverwerkingsbewerkingen.
Vanwege de lage corrosieve aard en bacteriedodende eigenschappen wordt glycolzuur vaak opgenomen in zure reinigingsmiddelen. Het is vooral effectief bij het reinigen van melkcontainers, melkverwerkingsapparatuur, drinkfonteinen en voor het verwijderen van roest en kalkaanslag in warmtewisselaars en pijpleidingen.
Glycolzuur vertoont een remmende werking op de groei van ijzeroxiderende bacteriën. Door het gebruik ervan is het niet nodig om gelijktijdig chelerende middelen en bacteriedodende middelen toe te voegen.
De complexerende eigenschappen van glycolzuur maken het ook geschikt voor toepassingen zoals koperpolijstmiddelen, etsmiddelen voor lithografische platen en bij de formulering van elektropolijst- en galvanisatiebaden.
Derivaten van glycolzuur
Methylglycolaat en ethylglycolaat zijn twee glycolzuuresters die gewoonlijk worden gebruikt als uitgangsmaterialen voor de laboratoriumsynthese van zuiver glycolzuur. In het verleden werden ze ook gebruikt als oplosmiddelen voor harsen en nitro- of acetylcellulose. Naast deze esters zijn alleen carboxymethylcellulose en n-butylglycolate commercieel van belang.
n-Butylglycolaat
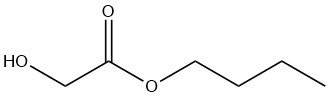
n-Butylglycolaat is een kleurloze vloeistof die mengbaar is met de meeste organische oplosmiddelen. De oplosbaarheid in water is beperkt tot 8% gewicht bij 20 °C, hoewel de verbinding zelf tot 25% gewicht water kan bevatten.
Productie van n-butylglycolaat
De productie van n-butylglycolaat omvat de behandeling van natriumchlooracetaat met n-butylalcohol bij temperaturen variërend van 125 tot 160 °C, gevolgd door vacuümdestillatie.
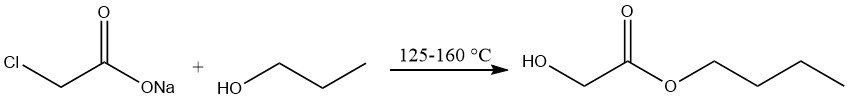
Toepassingen van n-butylglycolaat
n-Butylglycolaat wordt voornamelijk gebruikt als additief in lakken, gewaardeerd om zijn lage vluchtigheid. Enkele handelsnamen voor n-butylglycolaat zijn Polysolvan-O (Hoechst) en GB-Ester (Wacker).
Het geeft gladde spreideigenschappen en een hoge glans aan nitrocelluloselakken. In het geval van acetylcellulose fungeert het effectief als een bloosremmer onder omstandigheden met een hoge luchtvochtigheid.
Vanwege zijn gunstige mengeigenschappen wordt n-butylglycolaat ook gebruikt als additief in alkydharsen en verf op oliebasis.
n-Butylglycolaat wordt als niet-gevaarlijk beschouwd.
Referenties
- Hydroxycarboxylic Acids, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_507
- Process for manufacture of glycolic acid. – https://patents.google.com/patent/US2152852A/en
- Glycolic Acid Production from Ethylene Glycol. – https://pubs.acs.org/doi/10.1021/acssuschemeng.1c03717
