Dichloorazijnzuur: eigenschappen, productie en toepassingen

Wat is dichloorazijnzuur?
Dichloorazijnzuur is een derivaat van azijnzuur met de chemische formule CHCl2COOH. Het is een zeer corrosieve vloeistof die zure dampen afgeeft, die irritatie van de slijmvliezen kunnen veroorzaken.
Dichloorazijnzuur is volledig mengbaar met water en kan gemakkelijk oplossen in verschillende organische oplosmiddelen zoals alcoholen, ketonen, koolwaterstoffen en gechloreerde koolwaterstoffen.
Inhoudsopgave
1. Fysische eigenschappen van dichloorazijnzuur
De fysische eigenschappen van dichloorazijnzuur, ook bekend als 2,2-dichloorethaanzuur, omvatten:
- Molaire massa: 128,95 g/mol
- Kookpunt: 192 °C (101,3 kPa)
- Vriespunt: 13,5 °C
- Dichtheid: 1,564
- Dampspanning: 0,19 kPa (bij 20 °C)
- Dissociatieconstante: 5×10-2 mol/L (bij 18 °C)
2. Chemische reacties van dichloorazijnzuur
Dichloorazijnzuur bezit twee chlooratomen die gevoelig zijn voor verdringingsreacties.
Wanneer het reageert met aromatische verbindingen, vormt het diarylazijnzuren, terwijl in aanwezigheid van fenol difenoxyazijnzuren worden geproduceerd.
Vergeleken met chloorazijnzuur vertoont dichloorazijnzuur een lagere gevoeligheid voor hydrolyse. De aanwezigheid van dichloorazijnzuurverontreiniging in chloorazijnzuur kan echter leiden tot crosslinking tijdens de productie van carboxymethylcellulose (CMC’s) en zetmelen. Het resulterende crosslinkingeffect kan wenselijk of onwenselijk zijn, afhankelijk van de beoogde toepassing van het eindproduct.
3. Productiemethoden van dichloorazijnzuur
De meest economisch haalbare aanpak voor het produceren van dichloorazijnzuur omvat de hydrolyse van dichlooracetylchloride.

Bovendien kan een opbrengst van 90% aan 98% zuiver dichloorazijnzuur worden bereikt door hydrolyse van pentachloorethaan met behulp van 88–99% zwavelzuur of door oxidatie van 1,1-dichlooraceton met salpeterzuur en lucht.
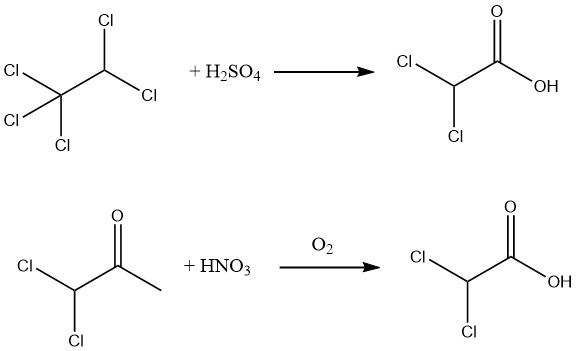
Hydrolyse van de methylester, die eenvoudig te verkrijgen is door verestering van ruw dichloorazijnzuur, maakt de productie van uitzonderlijk zuiver dichloorazijnzuur mogelijk.

Bovendien verschaft de katalytische dechlorering van trichloorazijnzuur of ethyltrichlooracetaat met waterstof over een palladiumkatalysator een methode voor het verkrijgen van dichloorazijnzuur en ethyldichlooracetaat.

Het scheiden van zuiver dichloorazijnzuur van andere chloorazijnzuren blijkt een uitdaging te zijn via fysieke middelen zoals fractionele destillatie, voornamelijk vanwege de kleine verschillen in kookpunten, met name tussen di- en trichloorazijnzuur.
Effectieve destillatiekolommen kunnen echter op bevredigende wijze estermengsels fractioneren. Bovendien kunnen mengsels van de zouten die zijn afgeleid van de drie chloorazijnzuren worden gewassen met water, alcohol of water-alcoholoplossingen om bij voorkeur dichlooracetaat op te lossen, dat vervolgens kan worden aangezuurd om zuiver dichloorazijnzuur te verkrijgen.
In laboratoriumomgevingen kan dichloorazijnzuur worden gesynthetiseerd door chloraalhydraat te laten reageren met kalium- of natriumcyanide:
Cl3CCH(OH)2 + KCN → HCN + KCl + Cl2CHCOOH
4. Toepassingen van dichloorazijnzuur
Dichloorazijnzuur is bruikbaar als testreagens bij analytische metingen tijdens de productie van vezels, met name voor de productie van poly(ethyleentereftalaat). Het dient ook als een medicinaal ontsmettingsmiddel en dient als vervanger voor formaline.
Bovendien speelt dichloorazijnzuur een essentiële rol als deblokkeringsmiddel bij de vastefasesynthese van oligonucleotiden. Om deze functie te vervullen, is een zeer zuiver dichloorazijnzuur nodig, dat grotendeels vrij is van chloraal (trichlooraceetaldehyde).
Bij organische synthese dient dichloorazijnzuur, met name in de vorm van zijn esters, als een reactief startmateriaal. Het wordt gebruikt bij de productie van glyoxylzuur, dialkoxy- en diaroxyzuren, evenals sulfonamiden, en dient dus als een cruciale tussenverbinding.
Referentie
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3
