Broom: reacties, productie en toepassingen

Wat is broom?
Broom is een vloeistof met de chemische formule Br2 die een hoge dichtheid, donkerrode kleur en sterke dampende eigenschappen heeft, en daarnaast zeer corrosief en tranenverwekkend is. De geur van broom is zo scherp dat het kan worden gedetecteerd bij een volume van 1 ppm in de lucht.
De kleur van broom is temperatuurafhankelijk, met geeloranje tinten bij 20 K, overgaand in oranjerood, roodbruin en uiteindelijk bijna zwart bij het smeltpunt. Vloeibaar broom behoudt een donkerrode tint, terwijl de dampen over het algemeen oranje tot roodbruin zijn.
A. J. Balard ontdekte broom in 1824 tijdens het bestuderen van de flora in een zoutmoeras nabij Montpellier, Frankrijk. Tijdens zijn onderzoek observeerde hij een afzetting van natriumsulfaat die was gekristalliseerd in een pan met moederloog afkomstig van gewoon zout.
Tijdens het onderzoek naar mogelijke toepassingen voor de afvalvloeistoffen ontdekte BALARD dat de verzadiging van chloor een nieuwe rode vloeistof kon opleveren die kon worden gedistilleerd.
Inhoudsopgave
1. Chemische reacties van broom
De robuuste oxiderende eigenschappen van broom zijn verantwoordelijk voor veel van zijn chemische reacties. De elektronenaffiniteit van broom ligt tussen die van chloor en jodium, net als de meeste andere chemische eigenschappen.
Broom fungeert als een matig sterk oxidatiemiddel en wordt door chloor geoxideerd om elementair broom te produceren, in overeenstemming met zijn positie in de elektromotorische reeks.
Broom wordt gereduceerd tot bromide in water, waarbij het reductiemiddel ofwel het water ofwel het resterende broom is. In het eerste geval wordt zuurstof gevormd, zoals blijkt uit de vergelijking:
2 Br2 + 2 H2O → 4 H+ + 4 Br– + O2 E0298 = +0,25 V
Broom reageert met waterstofcyanide om cyanogeenbromide te vormen:
Br2 + HCN → BrCN + HBr
Carbonaten reageren met broom, waarbij bromide- en bromaatzouten ontstaan:
3 Br2 + 3 Na2CO3 → 5 NaBr + NaBrO3 + 3 CO2
Broom kan zwaveldioxide oxideren tot zwavelzuur, zoals blijkt uit de volgende vergelijking:
Br2 + SO2 + 2 H2O → 2HBr + H2SO4
Broom reageert met rode fosfor en andere fosforverbindingen om fosforzuur en waterstofbromide te produceren, als volgt:
3 Br2 + 2 P + 6 H2O → 6 HBr + 2 H3PO3
H3PO3 + Br2 + H2O → H3PO4 + 2 HBr
H3PO3 + Br2 + NaOH → NaH2PO4
Verbindingen die stikstof bevatten, zoals ammoniak, hydrazine, nitrieten en aziden, ondergaan ook oxidatie door broom, waarbij elementaire stikstof het frequente product van deze reacties is.
Bij hogere temperaturen reageert broom direct met waterstof om waterstofbromide te produceren, wat de basis is voor commerciële productie van HBr met behulp van katalysatoren zoals verhitte houtskool en fijn verdeeld platinametaal.
Broom reageert met veel metalen om bromiden te produceren, waarbij natrium heftig reageert in aanwezigheid van natriumdamp. Kalium en cesium reageren heftig met broom.
Aluminium en titanium zijn ook zeer reactief met broom, waarbij aluminium licht uitzendt bij de reactie, terwijl magnesium, zilver, nikkel en lood worden bedekt met hun bromiden, waardoor verdere reactie wordt voorkomen.
De beschermende coating van lood maakt het een bruikbaar materiaal voor containers om broom in te bewaren, net als nikkel, tantaal, Hastelloy C en Monel en andere koperlegeringen.
Vocht is een belangrijke factor in de corrosie van metalen door broom, waarschijnlijk vanwege de hydrolyseproducten, waterstofbromide en hypobromig zuur.
Bij een vochtgehalte onder de 40 ppm kunnen nikkelcontainers worden gebruikt voor het transport van broom, maar kwik mag niet worden gebruikt in instrumenten en meters die worden blootgesteld aan broomdamp.
Droog broom reageert langzaam met ijzer om een beschermende laag van ferribromide te vormen, maar wanneer het nat is, ontstaat er een mengsel van gehydrateerde ijzerbromiden, die niet aan het ijzeroppervlak hechten.
Verschillende andere zware metalen, zoals koper, mangaan, chroom, antimoon, kobalt, cadmium en bismut, reageren met broom, waarbij sommige metalen hogere temperaturen nodig hebben om de reactie te laten plaatsvinden.
1.1. Alkeen- en alkynbromering
Broom kan zich gemakkelijk toevoegen aan onverzadigde verbindingen. Deze reacties worden doorgaans uitgevoerd bij lage temperaturen om substitutienevenreacties te voorkomen. Hoewel een katalysator doorgaans niet nodig is, kunnen hoge temperaturen of ultraviolette straling de reactie versnellen.
Verschillende belangrijke commerciële producten kunnen worden verkregen door bromering van onverzadigde verbindingen, waaronder ethyleenbromide, acetyleentetrabromide, 2,3-dibroompropanol, hexabroomcyclodecaan en tetrabroombisfenol A bis(2,3-dibroompropylether).
1.2. Bromering van aromatische verbindingen
Bromering van aromatische verbindingen kan plaatsvinden via drie soorten reacties: additie, substitutie op zijketens en substitutie op de aromatische ring.
De additie van broom over aromatische dubbele bindingen is doorgaans een langzame reactie wanneer deze wordt gekatalyseerd door licht, maar chloor kan de reactiesnelheid verhogen. Bromering van aromatische zijketens verloopt doorgaans via een vrije-radicalenreactie.
Elektrofiele substitutie op de aromatische ring is het belangrijkste type aromatische bromering. In aanwezigheid van een katalysator kan broom reageren met aromatische verbindingen om arylbromiden en waterstofbromide te produceren via de volgende reactie:
ArH + Br2 → ArBr + HBr
Geschikte katalysatoren voor aromatische bromering omvatten Lewis-zuren zoals haliden van aluminium, ijzer, zink of antimoon. Geactiveerde aromatische verbindingen, zoals fenol, aniline en aromatische ethers, kunnen worden gebromeerd zonder het gebruik van een katalysator.
Omgekeerd kunnen zeer sterk gedeactiveerde aromatische verbindingen die elektronenonttrekkende groepen bevatten, bromering ondergaan in aanwezigheid van zwavelzuur met salpeterzuur.
Broom gegenereerd uit waterstofbromide in situ wordt efficiënter gebruikt in aromatische substitutiereacties:
ArH + HBr + Cl2 → ArBr + 2 HCl
Voorgevormde broomchloride kan ook voor dit doel worden gebruikt. Substitutiereacties die BrCl gebruiken, zijn over het algemeen veel sneller dan die waarbij alleen broom wordt gebruikt.
1.3. Vrije-radicalenbromering
Broom reageert gemakkelijk met verzadigde koolwaterstoffen en alkylzijketens van aromatische verbindingen via een kettingreactiemechanisme waarbij vrije radicalen betrokken zijn. De reactie verloopt via de volgende stappen:
Br2 → 2 Br•
RH + Br• → R• + HBr
R• + Br2 → RBr + Br•
De initiatie van de reactie vereist de dissociatie van broommoleculen, wat kan worden bereikt door thermische, fotolytische of peroxide-initiatoren. Vergeleken met chloor is het broomatoom minder reactief en is de waterstofabstractiestap endotherm, wat resulteert in relatief lage reactiesnelheden.
Niettemin vertoont het broomatoom een hoge positieselectiviteit. Bijvoorbeeld, bij de bromering van n-butaan worden secundaire waterstofatomen 82 keer sneller vervangen dan primaire. Bromering van aromatische zijketens is veel sneller dan die van alkanen.
1.4. Productie van waterstofbromide
Waterstofbromide is een belangrijk tussenproduct bij de productie van een verscheidenheid aan organische en anorganische bromiden, waaronder geneesmiddelen, kleurstoffen, parfums, fotografische chemicaliën en vele andere chemische verbindingen.
De gebruikelijke commerciële methode voor het bereiden van waterstofbromide omvat de directe gasfasereactie van waterstof en broom, die kan worden bereikt zonder katalysator door een zichzelf in stand houdende vlam in een gesloten brander te onderhouden.
Br2 + H2 → 2 HBr + Warmte
In het laboratorium kan waterstofbromide worden gegenereerd door een oplossing van natrium- of kaliumbromide te destilleren met fosforzuur of verdund zwavelzuur (5,8 M), maar geconcentreerder zwavelzuur of de reactietemperatuur boven de 75 °C laten komen is niet effectief omdat het aanvankelijk gevormde HBr zal oxideren tot gasvormig broom.
Als alternatief kan waterstofbromide worden gegenereerd door de reductie van broom met fosforigzuur:
H3PO3 + Br2 + H2O → H3PO4 + 2 HBr
1.5. Bromering met behulp van broomdragers
Broomcomplexen en bromoimiden worden gebruikt in bromeringsreacties die selectiviteit vereisen. N-broomsuccinimide (NBS) is de meest gebruikte broomdrager in laboratoriumbromeringen.
NBS heeft een unieke toepassing in vrije-radicale allylische bromeringen:

Andere effectieve dragers van broom voor chemische reacties zijn onder meer dibroomdimethylhydantoïne, dioxaandibromide, pyridinehydrobromidedibromide en verschillende soorten quaternaire ammoniumpolybromiden.
2. Productie van broom
Broom wordt geproduceerd uit natuurlijk voorkomende broomhoudende vloeistoffen (pekel) of uit zeewater, evenals uit de productie van kaliumzouten.
Het isoleren van broom uit deze bronnen is een uitdaging vanwege de aanzienlijk grotere molaire concentratie van chloride-ionen vergeleken met bromide-ionen in de meeste pekel- en zeewater.
Een scheidingsmethode met hoge selectiviteit is vereist om broom te extraheren. Gelukkig bestaat er een methode die is gebaseerd op het grotere gemak van het oxideren van bromide vergeleken met chloride en de vluchtigheid van het oxidatieproduct, broom.
Chloor wordt gebruikt als de meest economische en handige oxidant.
De vier belangrijkste fasen in de productie van broom omvatten oxidatie van bromide tot broom, strippen van broom uit de waterige oplossing, scheiding van broom uit de damp en zuivering van broom.
Twee algemene processen met behulp van chlorering voor broomwinning worden algemeen gebruikt, gebaseerd op de volgende chemische reactie:
2 Br– + Cl2 → Br2 + 2 Cl–
- Het eerste proces, het stoomproces, wordt gebruikt voor pekels en afvalvloeistoffen die broom bevatten wanneer de bromideconcentratie in de pekel boven de 1000 ppm ligt. Stoom wordt in dit proces gebruikt om het broom direct uit de stoom te condenseren.
- Het tweede proces, het uitblaasproces, wordt gebruikt voor zeewater en omvat het gebruik van lucht vanwege de grote hoeveelheden stripgas die nodig zijn. Om het broom te concentreren, is het nodig om het op te vangen in een alkalische of reducerende oplossing.
2.1. Productie van broom door middel van stoomproces
De productie van broom uit pekelwater dat Br– bevat in concentraties van 1–5 g/L volgt een proces dat voor het eerst werd beschreven door KUBIERSCHKY in 1906.
De ruwe pekel wordt verhit in een warmtewisselaar (a) en vervolgens door twee gepakte torens (b), (c) geleid door zwaartekrachtstroom (Figuur 1). In de bovenste toren ontmoet de pekel een gerecyclede stroom gassen die chloor en broom absorberen.
Dichtbij de bodem van de onderste toren (c) worden chloor en stoom geïntroduceerd. Terwijl ze omhoog gaan, reageert het chloor met bromide in de pekel, waardoor een mengsel van broomdamp en chloor (ongeveer 85:15 op gewicht) ontstaat met stoom die van bovenaf wordt afgevoerd.
Het water en de meeste halogenen worden gecondenseerd (d) en de vloeibare fasen gaan een zwaartekrachtseparator (e) binnen, terwijl het gas naar de bovenste toren gaat.
Vanuit de separator wordt water met opgeloste halogenen naar de onderste (uitstomende) toren gestuurd en stroomt de zwaardere broomlaag, die wat chloor bevat, naar een fractioneringskolom (g).
De chloordampen voegen zich bij de stroom naar de bovenste toren, terwijl het vloeibare broom, ongeveer 99% zuiver, wordt afgetapt voor direct gebruik bij de productie van broomverbindingen of voor verdere zuivering.
De hete gedebromineerde pekel wordt behandeld om de zuurgraad (h) te neutraliseren en om vrije halogenen te reduceren, indien nodig, en vervolgens door de warmtewisselaar geleid, waar het de binnenkomende pekel verwarmt.
Recente wijzigingen van het oorspronkelijke Kubierschky-proces houden verband met de grotere schaal van moderne operaties, corrosiebestendige constructiematerialen en de procedures en instrumentatie die nodig zijn voor controle.
De processen worden gecontroleerd door het meten van kritische punten zoals pH, oxidatie-reductiepotentialen, stroomsnelheden, temperaturen en druk.
Zuurgraad ontstaat wanneer chloor reageert met reducerende stoffen, zoals waterstofsulfide, in de pekel. Deze zuurgraad verbetert de efficiëntie van de broomvrijmaking door hydrolyse tot hypobromig zuur te voorkomen.
Het gebruik van zwavelzuur wordt echter niet aanbevolen als de pekel calcium of strontium bevat, omdat deze kunnen neerslaan als sulfaten en de torenpakking, warmtewisselingsoppervlakken of pekelafvoerputten kunnen vervuilen. Sulfaten worden gevormd als de pekel sulfiden bevat.
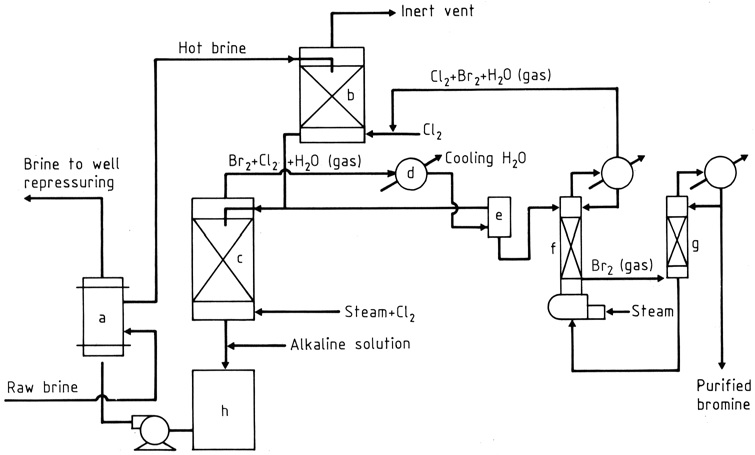
a) Broomkruiswarmtewisselaar; b) Chloorabsorber; c) Stoomuitstomingstoren; d) Condensor; e) Separator; f) Stripkolom; g) Fractioneringskolom; h) Neutralisator
2.2. Productie van broom door zeewaterproces
De extractie van broom rechtstreeks uit zeewater, wat leidde tot succesvolle commerciële winning, werd voor het eerst bereikt in de buurt van Wilmington, North Carolina (VS). Dit werd bereikt met behulp van een luchtblaasmethode die oorspronkelijk werd ontwikkeld voor pekelverwerking door H. H. DOW.
Het gebruik van lucht in plaats van stoom werd noodzakelijk geacht vanwege de hoge kosten van stoom, die nodig zou zijn om het oceaanwater te verwarmen dat slechts ongeveer 65 mg/l broom bevat. Het is opmerkelijk dat de fabriek in Wilmington niet langer operationeel is.
Het zeewater wordt naar de top van uitblaastorens gepompt, waarbij zwavelzuur en chloor net boven de pompen worden toegevoegd om een goede menging te garanderen terwijl het opstijgt.
Een hoeveelheid van 1,3 kg 10% zwavelzuur per ton water is nodig om de natuurlijke waterstofcarbonaten te neutraliseren en de pH op 3,5 te brengen, en er wordt een overmaat van 15% chloor boven de theoretische vereiste gebruikt.
Lucht wordt door de torens omhoog gezogen, wat de extractie van een mengsel van broom en chloor (of broomchloride) uit het dalende oceaanwater mogelijk maakt. De lucht wordt vervolgens door absorbertorens gezogen, waar het tegenstrooms wordt gewassen met behulp van een natriumcarbonaatoplossing.
De verschillende reacties die plaatsvinden, kunnen grofweg worden samengevat door de volgende vergelijking:
3 Na2CO3 + 2 Br2 + BrCl → NaBrO3 + 4 NaBr + NaCl + 3 CO2
Om nevel uit de lucht te verwijderen, worden kleine gepakte kamers geïnstalleerd tussen de absorbertorens en de ventilatoren.
Wanneer de alkaliniteit van de scrubberoplossing bijna is uitgeput, wordt de oplossing overgebracht naar een opslagtank en vervolgens naar een reactor, waar het wordt behandeld met zwavelzuur en uitgestoomd om broom vrij te maken. De chemische reactie wordt als volgt beschreven:
NaBrO3 + 5 NaBr + 3 H2SO4 → 3 Br2 + 3 Na2SO4 + 3 H2O
Andere methoden zijn gebruikt om broom te extraheren, waaronder het gebruik van elektrolyse in de vroege productie in Duitsland, dat in plaats van chloor werd gebruikt om bromiden te oxideren.
In de Verenigde Staten is een aangepast Kubierschky-proces gebruikt om broom terug te winnen als bijproduct uit kaliumchlorideproductievloeistoffen.
3. Toepassingen van broom
Broom is een veelzijdig element met een breed scala aan toepassingen. Het wordt uitgebreid gebruikt bij de productie van vlamvertragers, boorvloeistoffen, organische synthese, farmaceutica, biociden voor waterbehandeling en landbouw.
Daarnaast wordt het gebruikt bij de productie van kleurstoffen, insectenwerende middelen, parfums en fotografisch materiaal.
Andere toepassingen van broomverbindingen zijn onder meer kwikcontrole en papierproductie.
Gebromeerde vlamvertragers vormen een belangrijk onderdeel van de broomderivaten. Sinds het begin van de jaren negentig is hun consumptie aanzienlijk gestegen en in 2013 vormden ze meer dan de helft van de totale broomconsumptie. Ze worden gebruikt in industriële en huishoudelijke apparatuur zoals computers, meubels, borden, mobiele telefoons, televisies en textiel.
De hoge dichtheidseigenschappen van broomverbindingen worden met voordeel toegepast in hydraulische vloeistoffen, meetvloeistoffen, ertsflotatie en boorvloeistoffen.
Calcium-, zink- en natriumbromiden worden door de olie- en gasboorindustrie gebruikt om hoge dichtheid, heldere pekelboor-, voltooiings-, packer- en workovervloeistoffen te bereiden.
Een belangrijke en groeiende groep gebromeerde biociden is voor waterbehandeling, hoewel chloor de meerderheid van de waterbehandelingsmarkten beheerst.
Over het algemeen vervangen zowel industriële als consumentensegmenten van de waterbehandelingsindustrie chloor en gechloreerde verbindingen steeds vaker door op broom gebaseerde producten.
Gebromeerde biociden worden ook verkozen boven gechloreerde biociden in verschillende industriële toepassingen vanwege hun hogere tolerantie voor een breed scala aan pH-waarden, wat een zorg is in koeltorens en proceswateren.
Broom en zijn verbindingen worden gebruikt om kwikemissies bij kolengestookte elektriciteitscentrales te verminderen.
Anorganische broomverbindingen zoals calciumbromide en natriumbromide binden zich met kwik in rookgassen van kolengestookte elektriciteitscentrales, waardoor kwikverbindingen ontstaan die worden opgevangen in scrubbers, waardoor maar liefst 90% van het kwik dat vrijkomt bij verbranding wordt verwijderd.
Referenties
- Bromine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_391.pub2
- Bromine; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0218151310010311.a01.pub3
