Benzylalcohol: eigenschappen, reacties, productie en toepassingen
Wat is Benzylalcohol?
Benzylalcohol is de eenvoudigste en belangrijkste industriële aromatische alcohol, met de chemische formule C6H5CH2OH. Het is een kleurloze vloeistof bij kamertemperatuur met een zwakke, aangename geur die licht oplosbaar is in water, maar mengbaar is met veel organische oplosmiddelen.
Benzylalcohol werd voor het eerst bereid uit bittere amandelolie door Liebig en Wohler in 1832. Cannizzaro bepaalde de structuur ervan in 1853 met behulp van zijn naamgenootreactie, waarin benzaldehyde onevenredig wordt omgezet in benzoëzuur en benzylalcohol door alkali.
Benzylalcohol wordt in de natuur aangetroffen in zowel vrije vorm als als esters, zoals azijnzuur-, benzoëzuur-, salicylzuur– en kaneelzuuresters. Het wordt aangetroffen in Peru- en Tolubalsems, hyacint- en muurbloemoliën, ylang-ylangolie en andere essentiële oliën. Het komt ook voor als glucoside in maïs.
Inhoudsopgave
1. Fysieke eigenschappen van benzylalcohol
Benzylalcohol is een kleurloze vloeistof met een flauwe aromatische geur en een licht irriterend effect op de slijmvliezen. Het is mengbaar met veel organische oplosmiddelen.
De volgende tabel presenteert enkele van de fysieke eigenschappen van benzylalcohol:
| Eigenschap | Waarde |
|---|---|
| Moleculaire formule | C7H8O |
| Moleculair gewicht | 108,14 g/mol |
| Kookpunt | 205,4 °C bij 101,3 kPa |
| Smeltpunt | -15,4 °C |
| Refractief index | 1,5400 |
| Dichtheid | 1,061 g/cm3 bij 0 °C |
| Soortelijke warmte | 1972 J/kg·K bij 20 °C |
| Smeltwarmte | 82,9 J/g |
| Verdampingswarmte | 467,0 J/g bij 205,4 °C |
| Standaardverbrandingsenthalpie | 34,58 kJ/g |
| Vlampunt | 101 °C |
| Zelfontbrandingstemperatuur | 435 °C |
| Onderste explosiegrens | 1,3 vol % bij 170 °C en 101,3 kPa |
| Bovenste explosiegrens | 13,0 vol % |
| Oplosbaarheid in water | 4,0 g/100 g bij 20 °C |
| Oplosbaarheid van water in benzylalcohol | 5,1 g/100 g bij 20 °C |
| Dynamische viscositeit | 5,584×10-3 Pa·s bij 20 °C |
| Oppervlaktespanning | 39,96×10-3 N/m bij 20 °C |
| Dipoolmoment | 5,571×10-30 C·m (1,67 D) |
| Relatieve diëlektrische constante | 11,92 bij 30 °C |
| Relatieve diëlektrische constante | 9,81 bij 60 °C |
2. Chemische reacties van benzylalcohol
De unieke eigenschappen van benzylalcohol zijn voornamelijk te danken aan de hydroxylgroep, die zich gedraagt als die van alifatische alcoholen. De nabijheid van de aromatische ring maakt het echter reactiever. Benzylalcohol is minder zuur dan isomere cresolen, dus het lost niet volledig op in waterige alkaliën.
Wanneer benzylalcohol wordt verhit met dehydraterende middelen zoals aluminiumoxide, produceert het een verscheidenheid aan verbindingen, waaronder dibenzylether, tolueen en benzaldehyde. Dibenzylether kan ook worden gevormd door benzylalcohol te laten reageren met alkylhalogeniden in aanwezigheid van bis(acetylacetonato)nikkel als katalysator.

Oxidatie van benzylalcohol geeft benzaldehyde of benzoëzuur, afhankelijk van het oxidatiemiddel en de reactieomstandigheden. Salpeterzuur oxideert bijvoorbeeld benzylalcohol tot benzaldehyde, terwijl vast natriumpermanganaatmonohydraat het oxideert tot benzoëzuur.
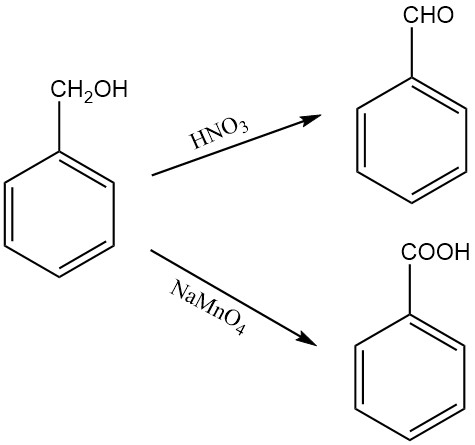
Benzylalcohol kan ook worden geoxideerd tot benzaldehyde onder Oppenauer-oxidatieomstandigheden, met furfural als waterstofacceptor. Blootstelling aan lucht kan benzylalcohol geleidelijk oxideren tot benzaldehyde.
Dehydrogenering van benzylalcohol in de gasfase, met koper of edelmetaalkatalysatoren, produceert ook benzaldehyde als hoofdproduct.
Hydrogenering van benzylalcohol onder verschillende omstandigheden kan een verscheidenheid aan producten produceren, waaronder tolueen, benzeen, methylcyclohexaan, cyclohexaan en hydroxymethylcyclohexaan. Benzylalcohol reageert ook met waterstofhalogeniden om de overeenkomstige benzylhalogeniden te vormen.

Bovendien kan benzylalcohol worden omgezet in benzoylchloride bij het chloreren van de zijketens van aromatische verbindingen. Het kan ook worden omgezet in verschillende alkylamines bij reactie met ammoniak of aminen.
Friedel-Crafts-katalysatoren kunnen worden gebruikt om benzylalcohol te alkyleren. Bijvoorbeeld, door benzylalcohol te laten reageren met benzeen ontstaat difenylmethaan, terwijl door reactie met fenol een mengsel van 2- en 4-benzylfenolen ontstaat.
Benzylalcohol reageert met organische en anorganische zuren, zuurhalogeniden of zuuranhydriden om esters te vormen. Zuurgekatalyseerde reacties met aldehyden leveren acetalen op. Bovendien levert het reageren van benzylalcohol met koolmonoxide in aanwezigheid van carbonylkatalysatoren fenylazijnzuur op.
Het behandelen van benzylalcohol met bepaalde katalysatoren, zoals watervrij aluminiumchloride of zinkchloride, verwijdert water om harsachtige producten te produceren. Zelfs kleine hoeveelheden waterstofbromide en ijzer(II) kunnen een exotherme polycondensatiereactie van benzylalcohol initiëren bij temperaturen boven 150 °C.
Deze reactie kan de temperatuur verhogen tot 240 °C en een plotselinge drukstijging veroorzaken in een gesloten vat. Daarom wordt aanbevolen om benzylalcohol niet boven 100 °C te verhitten, tenzij het vrij is van zure onzuiverheden en opgelost ijzer.
3. Productie van benzylalcohol
Er zijn slechts twee industrieel belangrijke methoden voor de productie van benzylalcohol:
- Hydrolyse van benzylchloride
- Hydrogenering van benzaldehyde
3.1. Productie van benzylalcohol door hydrolyse van benzylchloride

De hydrolyse van benzylchloride is een omkeerbare reactie die bijna kwantitatief kan worden uitgevoerd in aanwezigheid van basische verzepingsmiddelen die het zoutzuur neutraliseren dat als bijproduct wordt geproduceerd.
De reactie wordt doorgaans uitgevoerd door benzylchloride te verhitten met een overmaat van een waterige oplossing van een alkali- of aardalkalimetaaloxide, -hydroxide of -carbonaat. Soda is het voorkeursverzepingsmiddel.
Om benzylalcohol op industriële schaal te produceren, wordt doorgaans de volgende procedure gebruikt:
- 126,5 delen benzylchloride worden toegevoegd aan 610 delen kokende 10% soda-oplossing onder roeren.
- Het reactiemengsel wordt teruggevloeid en geroerd totdat er geen koolstofdioxide meer ontsnapt (dit duurt ongeveer 5-6 uur).
- Het reactiemengsel wordt afgekoeld en de bovenste laag, bestaande uit ruwe benzylalcohol, wordt verwijderd.
- De natriumchloride-oplossing hieronder wordt geëxtraheerd met een organisch oplosmiddel zoals benzeen of tolueen om opgeloste benzylalcohol terug te winnen.
- De ruwe benzylalcohol wordt gezuiverd door fractionele destillatie bij verminderde druk om een zuiver product te verkrijgen.
De opbrengst van benzylalcohol uit dit proces is 67% en voor dibenzylether is dit 8%.
Om de reactietijd te verkorten, kan het uiteindelijke residu van benzylchloride worden gehydrolyseerd met natriumhydroxide-oplossing na 3 uur verzeping met soda-oplossing. Dit verkort de totale verzepingstijd tot 4 uur.
Het percentage dibenzylether dat in de reactie wordt gevormd, kan worden verminderd door een inert oplosmiddel te gebruiken, zoals benzeen, tolueen of xyleen, of door het benzylchloride in een continu proces te hydrolyseren.
In een nieuw continu proces reageren benzylchloride en het alkalische verzepingsmiddel als tegenstromen in een inert organisch oplosmiddel in een stromingsreactor. De alcohol wordt uit de waterige alkalische fase geëxtraheerd door een inert organisch oplosmiddel in een extractiezone.
De ruwe benzylalcohol wordt vervolgens gewassen met water in een waszone. De stromingsreactor, extractiezone en waszone zijn geïntegreerd in een speciaal apparaat. Dit proces kan worden uitgevoerd bij lage reactietemperaturen (120-150 °C) en met een kleine stoichiometrische overmaat aan verzepingsmiddel (5-25%).
Er zijn ook tweestapsprocessen ontwikkeld voor de productie van benzylalcohol, maar deze hebben niet veel commerciële betekenis gekregen.
3.2. Productie van benzylalcohol door hydrogenering en reductie van benzaldehyde
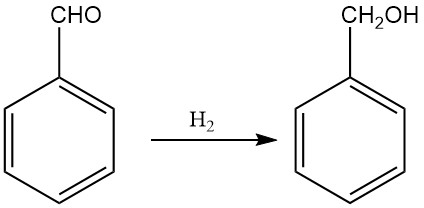
De industriële productie van benzylalcohol door hydrogenering van benzaldehyde werd belangrijk vanwege de grote hoeveelheden benzaldehyde die beschikbaar zijn als bijproduct van het Dow-proces voor fenolproductie en het Snia Viscosa-proces voor caprolactamproductie.
Afhankelijk van de reactieomstandigheden kan benzaldehyde worden gehydrogeneerd om een verscheidenheid aan producten te vormen, waaronder benzylalcohol, tolueen, hydroxymethylcyclohexaan en methylcyclohexaan. Hoge opbrengsten van benzylalcohol kunnen echter worden verkregen door de reactieomstandigheden en katalysatoren aan te passen.
Geschikte katalysatoren voor de hydrogenering van benzaldehyde omvatten:
- Raney-nikkel gedoteerd met overgangsmetalen
- Nikkel- of platinametalen met fosfinen of fosfineoxiden
- Palladium gecombineerd met een organische stikstof, alkalibase, water of een ander overgangsmetaal
Wanneer benzaldehyde wordt gehydrogeneerd bij temperaturen van 70-200 °C en een waterstofdruk van 1-4 MPa, worden hoge opbrengsten van benzylalcohol verkregen in korte reactietijden.
Een bekend continu proces gebruikt een platina-aluminiumoxide-lithiumoxide katalysator om benzaldehyde efficiënt en selectief te hydrogeneren tot benzylalcohol.
Andere methoden die gebruikmaken van reductiemiddelen zoals stannaan, natriumhydride, zink of micro-organismen, hebben geen industrieel belang.
De Cannizzaro-reactie wordt niet langer industrieel gebruikt om benzylalcohol te produceren.
3.3. Productie van benzylalcohol door oxidatie van tolueen
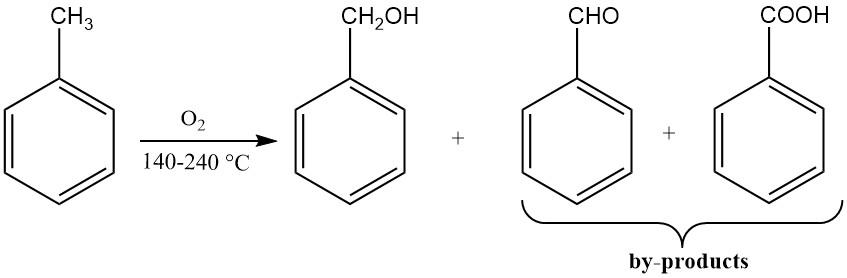
De katalytische oxidatie van tolueen levert lage opbrengsten van benzylalcohol op omdat de reactieomstandigheden verdere oxidatie tot benzaldehyde en benzoëzuur bevorderen. De meeste benzylalcoholproductieprocessen die tolueen als grondstof gebruiken, isoleren tussenproducten.
Een proces is om tolueen te oxideren met zuurstofarme lucht bij 170-220 °C en voldoende druk om het reactiemedium vloeibaar te houden. Deze reactie wordt uitgevoerd in aanwezigheid van stabilisatoren voor organische hydroperoxiden, zoals natriumpyrofosfaat of natriumfluoride.
Als niet meer dan 10% van de tolueen mag reageren, is het hoofdproduct benzylhydroperoxide. De daaropvolgende ontleding van benzylhydroperoxide bij 165 °C in aanwezigheid van oplosbare kobaltzouten levert benzylalcohol op.
Benzaldehyde en benzoëzuur worden gevormd als bijproducten. Benzylhydroperoxide kan ook worden gereduceerd tot benzylalcohol met behulp van alkalimetaalsulfieten.
Een ander proces is om tolueen in de lucht te oxideren in de vloeibare fase in aanwezigheid van zuren, zuurchloriden of zuuranhydriden. Dit vormt de benzylesters van deze zuren, die vervolgens kunnen worden verzeept om benzylalcohol te vormen.
Bijvoorbeeld, de oxidatie van tolueen in aanwezigheid van azijnzuuranhydride bij 140-240 °C en 1-3 MPa levert benzylacetaat op. De oxidatie wordt stopgezet nadat 10% van het tolueen heeft gereageerd. Na het verzepen van het oxidatieproduct kunnen 350 g benzylalcohol, 55 g benzaldehyde en 67 g benzoëzuur worden verkregen uit 500 g gereageerde tolueen.
Fenolische onzuiverheden, zoals cresolen, zijn onvermijdelijk aanwezig in de benzylalcohol die wordt verkregen door de oxidatie van tolueen. Deze onzuiverheden kunnen worden verwijderd door de benzylalcoholdamp te wassen met een tegenstroom van alkalibenzylaatoplossing in een platenkolom of een gepakte kolom.
3.4. Andere productieprocessen
De hydrogenering van benzoëzuuresters om benzylalcohol te vormen is een aantrekkelijke methode wanneer benzoëzuuresters in grote hoeveelheden worden geproduceerd, zoals bij de productie van dimethyltereftalaat door het Witten-proces.
Koperkatalysatoren hebben de voorkeur voor deze reactie. Benzoëzuuresters kunnen worden gehydrogeneerd tot benzylalcohol met behulp van een koperkatalysator ondersteund door aardalkalioxiden of -carbonaten. De selectiviteit kan worden verbeterd door chroom toe te voegen aan de katalysator. De reactie wordt doorgaans uitgevoerd bij temperaturen van 100-300 °C en drukken boven 6 MPa.
Andere katalysatoren voor de hydrogenering van benzoëzuuresters tot benzylalcohol zijn ruthenium, rhodium, platina en palladium, geactiveerd door alkalimetaalarenen, ketylen of alkoxiden. Deze katalysatoren maken het mogelijk om de reactie uit te voeren onder milde omstandigheden met een hoge selectiviteit.
Driestapsprocessen voor de productie van benzylalcohol uit tolueen omvatten doorgaans de hydrogenering van methylbenzoaat in aanwezigheid van een koper-chroomkatalysator:
- Oxidatie van tolueen tot benzoëzuur
- Verestering met methanol
- Hydrogenering van methylbenzoaat tot benzylalcohol
Dit proces produceert benzylalcohol tegen zeer lage kosten.
Andere processen, waaronder hydrogenering of elektrochemische reductie van benzoëzuur, hydrolyse van benzylsulfonzuur en decarboxylering van benzylformiaat, zijn niet belangrijk voor de industriële productie van benzylalcohol, maar ze kunnen worden gebruikt om derivaten te produceren die gesubstitueerd op de aromatische ring.
Benzylalcohol kan ook worden verkregen uit het benzylbenzoaat dat wordt geproduceerd als bijproduct van de productie van benzoëzuur.
4. Toepassingen van benzylalcohol
Benzylalcohol is een goed oplosmiddel voor oppervlaktecoatings, harsen, cellulose-esters, ethers, alkydharsen, acrylharsen en vetten. Het wordt ook gebruikt in inkt voor balpennen, om de vloei en glans van oppervlaktecoatings te verbeteren en als hulpmiddel bij het verven van wol, polyamiden en polyesters.
Omdat het een zwakke geur heeft, wordt het gebruikt als oplosmiddel en verdunningsmiddel in parfums en smaken.
Benzylalcohol wordt ook gebruikt als ontwikkelingsversneller in kleurenfotografie.
Het wordt gebruikt als lokaal verdovingsmiddel in de farmacie en als ingrediënt in zalven en andere preparaten vanwege het microbicide effect.
Benzylalcohol is een uitgangsmateriaal voor veel benzylesters, die worden gebruikt als geurstoffen, smaken, stabilisatoren voor vluchtige parfums en weekmakers.
Het wordt ook gebruikt bij de extractieve destillatie van m- en p-xylenen en m- en p-cresolen.
Andere toepassingen van benzylalcohol omvatten:
- Oplosmiddel voor reiniging en ontvetting
- Brandstofadditief
- Ingrediënt voor persoonlijke verzorgingsproducten (bijv. shampoo, conditioner, tandpasta)
- Farmaceutische hulpstof (bijv. conserveermiddel, oplosmiddel)
- Landbouwchemicaliën (bijv. mijtenbestrijdingsmiddel, insecticide)
5. Toxicologie van benzylalcohol
Benzylalcohol is een veelzijdige geurstof, conserveermiddel en antimicrobieel middel dat wordt gebruikt in farmaceutische producten, zepen, detergenten, cosmetica en voedingsproducten. Het wordt door de Amerikaanse Food and Drug Administration als “algemeen beschouwd als veilig” (GRAS) beschouwd, maar er zijn nog geen blootstellingslimieten voor het milieu of de werkplek vastgesteld.
Benzylalcohol is matig toxisch, met acute orale LD50-waarden van 1,2 g/kg bij ratten en 1,6 g/kg bij muizen. Het kan ook in toxische hoeveelheden door de huid worden opgenomen, met een dermale LD50 bij cavia’s van minder dan 5 ml/kg.
Benzylalcohol is niet geclassificeerd als kankerverwekkend en er zijn geen gegevens over de teratogene of reproductieve effecten. Het is echter belangrijk om op te merken dat benzylalcohol zeer giftig is voor pasgeboren mensen, met een geschatte dodelijke dosis die aanzienlijk lager is dan bij volwassenen.
Benzylalcohol wordt veel gebruikt als conserveermiddel in intraveneuze geneesmiddelenoplossingen, maar voorzichtigheid is geboden vanwege de hoge toxiciteit bij pasgeborenen.
Benzylalcohol is ook zeer giftig en irriterend voor de ogen en kan milde tot matige huidirritatie veroorzaken. Sommige mensen kunnen overgevoeligheidsreacties op benzylalcohol ervaren, zowel topisch als parenteraal.
Symptomen van benzylalcoholvergiftiging zijn onder meer braken, diarree, depressie van het centrale zenuwstelsel, prikkelbaarheid, spierverlamming, convulsies, ademhalingsmoeilijkheden en collaps.
Om blootstelling aan benzylalcohol te verminderen, is het belangrijk om adequate ventilatiesystemen, zelfstandige ademhalingsapparatuur, beschermende brillen, handschoenen en kleding te gebruiken.
Referentie
- Benzylalcohol; Ullmann’s Encyclopedie van Industriële Chemie. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_001
